磷及其化合物在工农业生产中有重要的作用。
(1)P元素有白磷、红磷、黑磷三种常见的单质。
①现代化学中,常利用_______ 上的特征谱线来鉴定元素。
②白磷(P4)易溶于CS2,难溶于水,原因是_________ 。
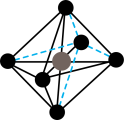
③黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体具有与石墨相类似的层状结构,如下图所示。下列有关黑磷晶体的说法不正确 的是_______ 。

A.黑磷晶体中磷原子杂化方式为sp3杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(2)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化磷和三溴化硼于高温下在氢气中反应合成。磷化硼晶体的晶胞如下图所示,其中实心球为磷原子。
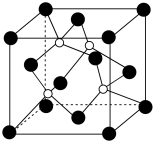
请回答下列问题:
①磷化硼的化学式为_________ ,该晶体的晶体类型是___________ 。
②三溴化磷中溴元素基态原子的电子排布式为_________ ,三溴化硼分子的空间构型是________ ,合成磷化硼的化学方程式为:___________ 。
③在一个晶胞中磷原子空间堆积方式为________ ,磷原子的配位数为________ ,该结构中有一个配位键,提供空轨道的原子是_______ 。已知晶体中B与P原子的最近距离为a nm,则该晶体的密度的表达式为(不需化简)________ g/cm3。
(1)P元素有白磷、红磷、黑磷三种常见的单质。
①现代化学中,常利用
②白磷(P4)易溶于CS2,难溶于水,原因是
③黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体具有与石墨相类似的层状结构,如下图所示。下列有关黑磷晶体的说法

A.黑磷晶体中磷原子杂化方式为sp3杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(2)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化磷和三溴化硼于高温下在氢气中反应合成。磷化硼晶体的晶胞如下图所示,其中实心球为磷原子。

请回答下列问题:
①磷化硼的化学式为
②三溴化磷中溴元素基态原子的电子排布式为
③在一个晶胞中磷原子空间堆积方式为
2019·云南红河·模拟预测 查看更多[2]
更新时间:2020-07-07 21:23:58
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增。A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小。则:
(1)A、B、C、D、E、F的名称分别是________________________________ 。
(2)在A至F中任选元素,写出一种含极性键的非极性分子的分子式_________ ,写出一种含非极性键的离子化合物的电子式______________________ 。
(3)由B和D组成,且B和D的质量比为3∶8的化合物的结构式是_________ ,
该化合物分子中B原子的杂化方式为_____________________
(4)E和F形成的化合物为_____ 晶体。
(1)A、B、C、D、E、F的名称分别是
(2)在A至F中任选元素,写出一种含极性键的非极性分子的分子式
(3)由B和D组成,且B和D的质量比为3∶8的化合物的结构式是
该化合物分子中B原子的杂化方式为
(4)E和F形成的化合物为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
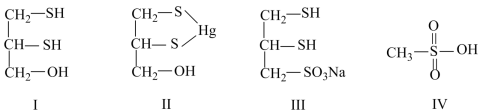
【推荐2】很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
(1)H2S、CH4、H2O 沸点由高到低顺序为
沸点由高到低顺序为_______ 。
(2)汞的原子序数为80,位于元素周期表中的位置是_______ 。
(3)化合物Ⅳ是一种强酸,请基于理论比较IV和硫酸的pKa1:化合物IV_______ 硫酸(填“>”或“<”)
(4)化合物Ⅲ也是一种汞解毒剂。下列关于上述物质的说法正确的有_______ 。
A.在I和Ⅲ中S原子均采取sp3杂化
B.在Ⅱ中所有元素中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的物质是_______ 。(填“化合物I”或“化合物Ⅲ”)

(1)H2S、CH4、H2O
 沸点由高到低顺序为
沸点由高到低顺序为(2)汞的原子序数为80,位于元素周期表中的位置是
(3)化合物Ⅳ是一种强酸,请基于理论比较IV和硫酸的pKa1:化合物IV
(4)化合物Ⅲ也是一种汞解毒剂。下列关于上述物质的说法正确的有
A.在I和Ⅲ中S原子均采取sp3杂化
B.在Ⅱ中所有元素中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的物质是
您最近一年使用:0次
【推荐3】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为______________ 。
(2)第一电离能I1:N__________ O(填“>”或“<”),第二电离能I2:O大于N的原因是_________________ 。
(3)O3的空间构型为__________________ ;分子中存在大π键,可用符号Π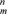 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为___________________________________ 。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H—N、____________________ 、__________________________ (任写两种即可)。
(5)已知:表格中键能和键长数目。
N2和N4都是N元素的单质,其中N4是正四面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________ 。
(6)Na2O的晶胞结构如图所示,X表示O2-,Y表示Na+,则O2-的配位数为____________ ,该晶胞的原子空间利用率为_____________ 。[已知该晶胞的棱长为a pm,r(Na+)=x pm,r(O2-)=y pm]

(1)O原子中价电子占据的轨道数目为
(2)第一电离能I1:N
(3)O3的空间构型为
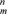 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H—N、
(5)已知:表格中键能和键长数目。
| 化学键 | 键长/pm | 键能/(kJ·mol-1) |
| N-N | 145 | 193 |
| N=N | 125 | 418 |
| N≡N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正四面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是
(6)Na2O的晶胞结构如图所示,X表示O2-,Y表示Na+,则O2-的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】H与O可以形成H2O和H2O2两种化合物。请回答:
(1)H+可与H2O形成H3O+,H3O+的空间构型名称为_____ 。
(2)H2O2分子结构如图所示,α、β、γ中相等的角是_____ ,H2O2是_____ 分子(填“极性”或“非极性”)。H2O2晶体中有4种作用力:①O-O键、②O-H键、③范德华力、④氢键,这4种作用力由强到弱依次为:_____ (用序号表示)。
(3)哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是_____ 。
A.Al3+ B.Mg2+ C.Cu2+ D.Mn2+ E.Fe2+
(4)实验测得,25℃时H2O2的pKa1小于H2O的pKa(pKa=-lgKa),原因是_____ (运用物质结构原理解释)。
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是_____ (填标号)。
(6)SF6分子的空间结构为正八面体形,如图所示。1molSF6中含有_____ molS-F键,它的二氯代物SF4Cl2有_____ 种。
(1)H+可与H2O形成H3O+,H3O+的空间构型名称为
(2)H2O2分子结构如图所示,α、β、γ中相等的角是

(3)哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是
A.Al3+ B.Mg2+ C.Cu2+ D.Mn2+ E.Fe2+
(4)实验测得,25℃时H2O2的pKa1小于H2O的pKa(pKa=-lgKa),原因是
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是

| A.CCl4 | B.CH4 | C.NH | D.H2O |

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】氮与氟、硫、镓三种元素之间可以形成具有特殊组成和性质的化合物。回答下列问题:
(1)基态镓原子电子排布式为___ ;硫原子核外有___ 种运动状态不同的电子。
(2)第一电离能符号为I1,I1(N)___ I1(S)(填“>”或“<”)。
(3)NSF(N=S-F)与SNF(S=N-F)互为同分异构体。
①关于NSF与SNF的说法正确的是___ (填标号)。
A.二者均含有极性键和非极性键
B.二者均含有σ键与π键
C.二者均为非极性分子
D.二者与SO2均互为等电子体
②NSF发生聚合生成三聚分子A(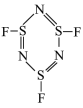 ),SNF发生聚合生成三聚分子B(
),SNF发生聚合生成三聚分子B( ),分子A中σ键与π键数目之比为
),分子A中σ键与π键数目之比为___ ,分子B中氮原子价电子空间构型为___ 。
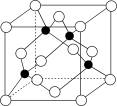
(4)氮化镓是直接隙半导体材料,具有易发光、电光转化效率高的特点。某种立方晶型氮化镓晶胞如图所示。(图中“O”与“●”大小比例关系符合二者原子实际大小比例关系)
①图中“●”表示的原子为___ (填元素符号)。
②已知NA为阿伏加 德罗常数的值,晶胞的密度为dg·cm-3。则晶胞的边长为___ nm。两个距离最近的氮原子之间的距离为___ nm。(均用含d和NA的式子表示)
(1)基态镓原子电子排布式为
(2)第一电离能符号为I1,I1(N)
(3)NSF(N=S-F)与SNF(S=N-F)互为同分异构体。
①关于NSF与SNF的说法正确的是
A.二者均含有极性键和非极性键
B.二者均含有σ键与π键
C.二者均为非极性分子
D.二者与SO2均互为等电子体
②NSF发生聚合生成三聚分子A(
 ),SNF发生聚合生成三聚分子B(
),SNF发生聚合生成三聚分子B( ),分子A中σ键与π键数目之比为
),分子A中σ键与π键数目之比为(4)氮化镓是直接隙半导体材料,具有易发光、电光转化效率高的特点。某种立方晶型氮化镓晶胞如图所示。(图中“O”与“●”大小比例关系符合二者原子实际大小比例关系)
①图中“●”表示的原子为
②已知NA为阿伏加 德罗常数的值,晶胞的密度为dg·cm-3。则晶胞的边长为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中②和⑦两元素形成的五原子分子的结构式为_______________________ ;
(2)由③和⑤两元素形成的物质与NaOH溶液反应的离子方程式为_______________________ ;
(3)由元素①和②的原子构成的R离子空间构型为平面正三角形,则该离子符号为________ ;其中心原子的杂化类型为_______________________ ;
(4)下列说法正确的是_______________________ ;
a.电负性②>③ b.③⑥两元素能形成极性分子
c.④⑦两元素形成的化合物中只含离子键 d.⑧⑨⑩三元素最外层电子数均为2
(5)M元素与表中元素⑨既同族又同周期,是一种重要的金属元素,若人体内M元素的含量偏低,则会影响O2在体内的正常运输。已知M2+与CN-溶液反应得到M(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成六配位化合物。
上述沉淀溶解过程的化学方程式为_______________________ 。

请回答下列问题:
(1)表中②和⑦两元素形成的五原子分子的结构式为
(2)由③和⑤两元素形成的物质与NaOH溶液反应的离子方程式为
(3)由元素①和②的原子构成的R离子空间构型为平面正三角形,则该离子符号为
(4)下列说法正确的是
a.电负性②>③ b.③⑥两元素能形成极性分子
c.④⑦两元素形成的化合物中只含离子键 d.⑧⑨⑩三元素最外层电子数均为2
(5)M元素与表中元素⑨既同族又同周期,是一种重要的金属元素,若人体内M元素的含量偏低,则会影响O2在体内的正常运输。已知M2+与CN-溶液反应得到M(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成六配位化合物。
上述沉淀溶解过程的化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】利用 晶体结构测定阿伏加德罗常数(
晶体结构测定阿伏加德罗常数( )。
)。
Ⅰ.精制
粗 中溶有一定量的
中溶有一定量的 ,试剂a为
,试剂a为 、
、 、乙醇混合液,用于除去
、乙醇混合液,用于除去 。
。

(1)从分子结构角度解释 能溶于
能溶于 的原因:
的原因:___________ 。
(2)步骤ii的目的是除去 中的大量乙醇,该步骤利用的分离提纯方法为
中的大量乙醇,该步骤利用的分离提纯方法为___________ 。
(3)步骤iii中, 中的
中的 可以与
可以与 和乙醇形成配位键,其中配原子是
和乙醇形成配位键,其中配原子是________ 。
Ⅱ.测定阿伏加德罗常数
实验1:实验装置如图所示,实验步骤如下。

①准确称量 容量瓶的质量为
容量瓶的质量为 。
。
②将 充分干燥后,转移至上述容量瓶中,准确称量其总重为
充分干燥后,转移至上述容量瓶中,准确称量其总重为 。
。
③将精制后的 由滴定管加入容量瓶至刻度线,消耗
由滴定管加入容量瓶至刻度线,消耗 的体积为
的体积为 。
。
(4)结合实验1中的数据可知:实验1的目的是测定 晶体的
晶体的________ (填物理量名称)。
实验2:利用X射线衍射实验测定 晶体结构。
晶体结构。
 晶体中存在A型和B型两种立方体重复单元(如下图所示),且A、B中存在的粒子种类和数目均相同。
晶体中存在A型和B型两种立方体重复单元(如下图所示),且A、B中存在的粒子种类和数目均相同。

(5)回答下列问题
a.从结构的角度解释A型立方体不是 晶胞的原因:
晶胞的原因:___________ 。
b.通过平移(不能旋转 )A型和B型两种立方体可得到 晶体中粒子排列的周期。用“
晶体中粒子排列的周期。用“ ”在B型立方体中标出
”在B型立方体中标出 的位置
的位置__________ 。
(6)结合实验1和实验2数据,可得
___________  (用代数式表示)。
(用代数式表示)。
 晶体结构测定阿伏加德罗常数(
晶体结构测定阿伏加德罗常数( )。
)。Ⅰ.精制

粗
 中溶有一定量的
中溶有一定量的 ,试剂a为
,试剂a为 、
、 、乙醇混合液,用于除去
、乙醇混合液,用于除去 。
。
(1)从分子结构角度解释
 能溶于
能溶于 的原因:
的原因:(2)步骤ii的目的是除去
 中的大量乙醇,该步骤利用的分离提纯方法为
中的大量乙醇,该步骤利用的分离提纯方法为(3)步骤iii中,
 中的
中的 可以与
可以与 和乙醇形成配位键,其中配原子是
和乙醇形成配位键,其中配原子是Ⅱ.测定阿伏加德罗常数
实验1:实验装置如图所示,实验步骤如下。

①准确称量
 容量瓶的质量为
容量瓶的质量为 。
。②将
 充分干燥后,转移至上述容量瓶中,准确称量其总重为
充分干燥后,转移至上述容量瓶中,准确称量其总重为 。
。③将精制后的
 由滴定管加入容量瓶至刻度线,消耗
由滴定管加入容量瓶至刻度线,消耗 的体积为
的体积为 。
。(4)结合实验1中的数据可知:实验1的目的是测定
 晶体的
晶体的实验2:利用X射线衍射实验测定
 晶体结构。
晶体结构。 晶体中存在A型和B型两种立方体重复单元(如下图所示),且A、B中存在的粒子种类和数目均相同。
晶体中存在A型和B型两种立方体重复单元(如下图所示),且A、B中存在的粒子种类和数目均相同。
(5)回答下列问题
a.从结构的角度解释A型立方体不是
 晶胞的原因:
晶胞的原因:b.通过平移(
 晶体中粒子排列的周期。用“
晶体中粒子排列的周期。用“ ”在B型立方体中标出
”在B型立方体中标出 的位置
的位置(6)结合实验1和实验2数据,可得

 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】我国具有悠久的历史,在春秋时期已经开始冶铁,在西汉就有湿法炼铜( )。
)。
(1)基态铁原子的电子排布式为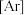
_______ 。
(2)铁氰化钾 是检验
是检验 的重要试剂,在铁氰化钾的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是
的重要试剂,在铁氰化钾的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是_______ ,碳原子的杂化类型是________ 。
(3) 是一种浅黄色液体,熔点
是一种浅黄色液体,熔点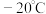 ,沸点103℃,易溶于苯等有机溶剂,不溶于水。
,沸点103℃,易溶于苯等有机溶剂,不溶于水。 是
是_________ 分子(填“极性”或“非极性”)
(4)铜常见化合价为 、
、 价,高温下
价,高温下 比
比 更稳定的原因是
更稳定的原因是__________ 。
(5) 比
比 的熔点高的原因是
的熔点高的原因是_____________ 。
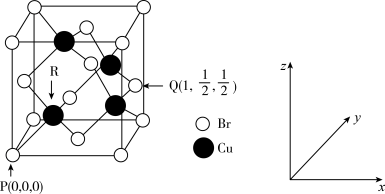
(6)一种铜的溴化物晶胞结构如图所示,由图可知,该晶体的化学式为_____________ ,与每个 紧邻的
紧邻的 有
有___________ 个,由图中的P点和Q点的原子坐标参数,可确定R点的原子坐标参数为_____ 。若 原子与最近的
原子与最近的 原子的核间距为
原子的核间距为 ,则该晶体的密度计算表达式为
,则该晶体的密度计算表达式为
______  。
。
 )。
)。(1)基态铁原子的电子排布式为
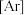
(2)铁氰化钾
 是检验
是检验 的重要试剂,在铁氰化钾的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是
的重要试剂,在铁氰化钾的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是(3)
 是一种浅黄色液体,熔点
是一种浅黄色液体,熔点 ,沸点103℃,易溶于苯等有机溶剂,不溶于水。
,沸点103℃,易溶于苯等有机溶剂,不溶于水。 是
是(4)铜常见化合价为
 、
、 价,高温下
价,高温下 比
比 更稳定的原因是
更稳定的原因是(5)
 比
比 的熔点高的原因是
的熔点高的原因是(6)一种铜的溴化物晶胞结构如图所示,由图可知,该晶体的化学式为
 紧邻的
紧邻的 有
有 原子与最近的
原子与最近的 原子的核间距为
原子的核间距为 ,则该晶体的密度计算表达式为
,则该晶体的密度计算表达式为
 。
。
您最近一年使用:0次
【推荐3】Ⅰ.金属镍在工业上应用广泛,请回答下列问题。
(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是____ (用元素符号表示)。
(2)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____ 。与CO互为等电子体的阴离子是____ (只写一种),CO分子内σ键与π键个数之比为____ 。1mol Ni(CO)n中含σ键为____ mol。
(3)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醛分子内C原子的杂化方式为____ ,甲醇分子内的O-C-H键角____ (填“大于”“等于”或“小于”)甲醛分子内的O-C-H键角。
Ⅱ.(1)已知NH3易溶于水,主要原因是____ 。
(2)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6____ (填“>”“<”或“=”)HIO4。
(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是
(2)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
(3)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醛分子内C原子的杂化方式为
Ⅱ.(1)已知NH3易溶于水,主要原因是
(2)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】KZnF3被认为是良好的光学基质材料,可由K2CO3、ZnF2、NH4HF2制备。回答下列问题:
(1)基态F原子的外围电子轨道表示式_______ 。
(2)K2CO3中阴离子的空间结构为_______ 。
(3)NH4HF2的组成元素的电负性由大到小的顺序为_______ (用元素符号表示);其中N原子的杂化方式为_______ ;HF能形成分子缔合体(HF)n的原因为_______ 。
(4)ZnF2具有金红石型四方结构,KZnF3具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:

①ZnF2和KZnF3晶体(晶胞顶点为K+ )中,Zn的配位数之比为_______ 。
②若NA表示阿伏加德罗常数的值,则ZnF2晶体的密度为_______ g·cm-3(用含a、c、NA的代数式表示)。
(1)基态F原子的外围电子轨道表示式
(2)K2CO3中阴离子的空间结构为
(3)NH4HF2的组成元素的电负性由大到小的顺序为
(4)ZnF2具有金红石型四方结构,KZnF3具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:

①ZnF2和KZnF3晶体(晶胞顶点为K+ )中,Zn的配位数之比为
②若NA表示阿伏加德罗常数的值,则ZnF2晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】氯化钠是自然界中常见的盐,在生产生活中有着广泛的用途。
(1)自然界中的氯化钠
①从原子结构角度解释自然界中氯元素主要以Cl-形式存在的原因:___________ 。
②固态氯化钠通常以晶体形式存在。氯化钠晶胞为立方体,结构如图所示:
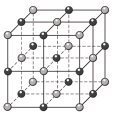
可知每个氯离子周围等距分布着_______ 个钠离子。常温下氯化钠晶体的密度为ρg/cm³,摩尔质量为Mg/mol,则相邻两个Na+之间的距离为_______ cm(用含有ρ和M的代数式表示,阿伏加德罗常数为NA)
③海水晒制的粗盐中常含可溶的硫酸盐杂质。检验精盐中SO42-是否除净的原理是:__________ (用离子方程式表示)
(2)食品加工中的氯化钠
①腌渍蔬菜时,食盐的主要作用是___________ (选填字母序号)。
a.着色剂 b.防腐剂 c.营养强化剂
②动物血制品富含蛋白质。在制作血豆腐的过程中,向新鲜动物血液中加入食盐,蛋白质发生了___________ (填“盐析”或“变性”)。
(3)氯碱工业中的氯化钠
①电解饱和食盐水总反应的化学方程式是___________ 。
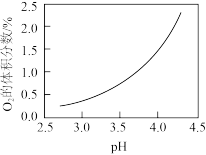
②目前氯碱工业的主流工艺是离子交换膜法。阳极生成的气体中常含有副产物O2,结合下图解释O2含量随阳极区溶液的pH变化的原因:___________ 。
(1)自然界中的氯化钠
①从原子结构角度解释自然界中氯元素主要以Cl-形式存在的原因:
②固态氯化钠通常以晶体形式存在。氯化钠晶胞为立方体,结构如图所示:

可知每个氯离子周围等距分布着
③海水晒制的粗盐中常含可溶的硫酸盐杂质。检验精盐中SO42-是否除净的原理是:
(2)食品加工中的氯化钠
①腌渍蔬菜时,食盐的主要作用是
a.着色剂 b.防腐剂 c.营养强化剂
②动物血制品富含蛋白质。在制作血豆腐的过程中,向新鲜动物血液中加入食盐,蛋白质发生了
(3)氯碱工业中的氯化钠
①电解饱和食盐水总反应的化学方程式是
②目前氯碱工业的主流工艺是离子交换膜法。阳极生成的气体中常含有副产物O2,结合下图解释O2含量随阳极区溶液的pH变化的原因:

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。请填写下列空白。
(1)E元素基态原子的价层电子排布式为__ ,E元素在元素周期表中的位置为___ ,___ 区;
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为___ (填元素符号);
(3)B2A4是重要的基本石油化工原料,B2A4分子中B原子轨道的杂化类型为__ ;B2A4是__ 分子(填“极性”或“非极性”);
(4)BD2是___ 晶体,空间构型为___ ,BD2与金属镁反应的化学方程式为____ ;
(5)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为___ ,乙为___ ;若晶体甲的密度为ρg∙cm-3,以NA表示阿伏加德罗常数的值,则该晶胞的边长a=___ nm。
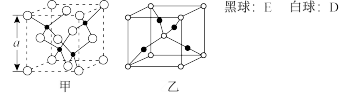
(1)E元素基态原子的价层电子排布式为
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)B2A4是重要的基本石油化工原料,B2A4分子中B原子轨道的杂化类型为
(4)BD2是
(5)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为

您最近一年使用:0次



