在 和
和 的混合溶液中,当
的混合溶液中,当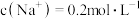 ,
, ,
,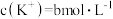 时,
时, 与
与 的关系是( )
的关系是( )
 和
和 的混合溶液中,当
的混合溶液中,当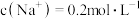 ,
, ,
,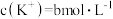 时,
时, 与
与 的关系是( )
的关系是( )A.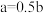 | B.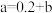 | C. | D.无法计算 |
18-19高一上·四川成都·期中 查看更多[8]
更新时间:2020-09-07 13:41:35
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】常温下,实验Ⅰ和实验Ⅱ中,均有气体产生,下列分析错误的是


A.饱和 溶液中 溶液中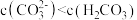 |
B.  溶液中: 溶液中: |
C.Ⅱ中产生白色的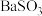 沉淀 沉淀 |
| D.I和Ⅱ中溶液的pH均增大 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】用0.1000mol•L-1NaOH溶液滴定20.00mL一定浓度的一元酸HA溶液,溶液的pH随HA、A—的分布分数δ[如A—的分布分数:δ(A-)= ]和NaOH溶液体积的变化如图所示,下列说法正确的是
]和NaOH溶液体积的变化如图所示,下列说法正确的是

 ]和NaOH溶液体积的变化如图所示,下列说法正确的是
]和NaOH溶液体积的变化如图所示,下列说法正确的是
| A.曲线①代表δ(HA),曲线②代表δ(A—) |
| B.HA溶液的浓度为0.2000mol•L-1 |
| C.HA电离常数的值Ka=1.0×10-5 |
| D.完全反应时,溶液中c(Na+)+ c(H+)= c(HA)+c(A—)+c(OH—) |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐3】已知:NaHSO3溶液呈酸性。常温下,将0.1 mol/L亚硫酸(忽略H2SO3的分解)与0.1 mol/L NaOH溶液等体积混合,下列关于该混合溶液说法不正确 的是
| A.c(Na+) > c(HSO3-) > c(H2SO3) > c(SO32-) |
| B.c(Na+) = c(HSO3-) + c(SO32-) + c(H2SO3) |
| C.c(HSO3-) + c(H2SO3) + c(SO32-) = 0.05 mol/L |
| D.c(Na+) + c(H+) > c(HSO3-) + c(SO32-) + c(OH-) |
您最近半年使用:0次



