钴钼系催化剂主要用于石油炼制等工艺,从废钴钼催化剂(主要含有MoS2、CoS和Al2O3)中回收钴和钼的工艺流程如图:

已知:浸取液中的金属离子主要为MoO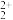 、Co2+、Al3+。
、Co2+、Al3+。
(1)钼酸铵[(NH4)2MoO4]中Mo的化合价为________ ,MoS2在空气中高温焙烧产生两种氧化物:SO2和____________ (填化学式)。
(2)为了加快酸浸速率,可采取的措施为_______________________ (任写一条)。
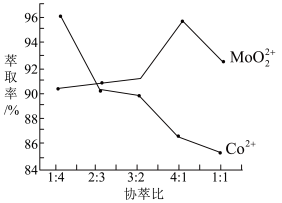
(3)若选择两种不同萃取剂按一定比例(协萃比)协同萃取MoO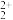 和Co2+,萃取情况如图所示,当协萃比
和Co2+,萃取情况如图所示,当协萃比
_________________ ,更有利于MoO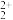 的萃取。
的萃取。
(4)操作Ⅰ的名称为_______________________ 。
(5)向有机相1中滴加氨水,发生反应的离子方程式为_____________________________ 。
(6)Co2+萃取的反应原理为Co2+ +2HR CoR2 +2H+,向有机相2中加入H2SO4能进行反萃取的原因是
CoR2 +2H+,向有机相2中加入H2SO4能进行反萃取的原因是_______________________ (结合平衡移动原理解释)。
(7)Co3O4可用作电极,若选用KOH电解质溶液,通电时可转化为CoOOH,其电极反应式为___________________________ 。

已知:浸取液中的金属离子主要为MoO
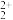 、Co2+、Al3+。
、Co2+、Al3+。(1)钼酸铵[(NH4)2MoO4]中Mo的化合价为
(2)为了加快酸浸速率,可采取的措施为
(3)若选择两种不同萃取剂按一定比例(协萃比)协同萃取MoO
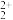 和Co2+,萃取情况如图所示,当协萃比
和Co2+,萃取情况如图所示,当协萃比
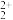 的萃取。
的萃取。
(4)操作Ⅰ的名称为
(5)向有机相1中滴加氨水,发生反应的离子方程式为
(6)Co2+萃取的反应原理为Co2+ +2HR
 CoR2 +2H+,向有机相2中加入H2SO4能进行反萃取的原因是
CoR2 +2H+,向有机相2中加入H2SO4能进行反萃取的原因是(7)Co3O4可用作电极,若选用KOH电解质溶液,通电时可转化为CoOOH,其电极反应式为
更新时间:2020-09-29 20:54:30
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】某兴趣小组以重铬酸钾( )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。
已知:① 溶液存在平衡:
溶液存在平衡: 。
。
②含铬元素的离子在溶液中的颜色: (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。 的正反应是
的正反应是_____ (填“吸热”或“放热”)反应。
(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_____ (填化学式)。
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是______ 。
(4)根据实验Ⅱ中不同现象,可以得出的结论是______ 。
(5)继续实验Ⅲ:______ 。
②第二步溶液变绿色:该反应的离子方程式是_______ 。
 )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。已知:①
 溶液存在平衡:
溶液存在平衡: 。
。②含铬元素的离子在溶液中的颜色:
 (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。
 的正反应是
的正反应是(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是
(4)根据实验Ⅱ中不同现象,可以得出的结论是
(5)继续实验Ⅲ:
实验Ⅲ: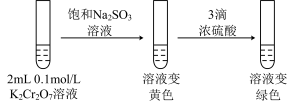
②第二步溶液变绿色:该反应的离子方程式是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】甲烷与硫化氢可通过重整反应制取氢气。现将原料按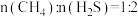 通入反应釜中,保持体系压强为0.1Mpa,研究不同温度对该反应体系的影响。当反应达到平衡时,体系中各组分的物质的量分数x随温度T的变化如图所示:
通入反应釜中,保持体系压强为0.1Mpa,研究不同温度对该反应体系的影响。当反应达到平衡时,体系中各组分的物质的量分数x随温度T的变化如图所示:
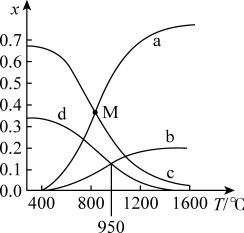
(1)已知该重整反应的另一个产物在常温下为液态,具有恶臭味,写出该物质的结构式:_______ ,此物质在该实验条件下为气态,写出该重整反应的热化学反应方程式:(反应热效应用Q表示)_______ 。
(2)图中表示 、
、 物质的量分数变化的曲线分别是:
物质的量分数变化的曲线分别是:_______ 、_______ 。
(3)反应达平衡的标志是_______(填标号)。
(4)由图可知该反应的Q_______ 0(填“>”、“<”或“=”),判断的理由是_______ 。
(5)M点对应温度下, 的转化率为
的转化率为_______ 。
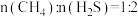 通入反应釜中,保持体系压强为0.1Mpa,研究不同温度对该反应体系的影响。当反应达到平衡时,体系中各组分的物质的量分数x随温度T的变化如图所示:
通入反应釜中,保持体系压强为0.1Mpa,研究不同温度对该反应体系的影响。当反应达到平衡时,体系中各组分的物质的量分数x随温度T的变化如图所示:
(1)已知该重整反应的另一个产物在常温下为液态,具有恶臭味,写出该物质的结构式:
(2)图中表示
 、
、 物质的量分数变化的曲线分别是:
物质的量分数变化的曲线分别是:(3)反应达平衡的标志是_______(填标号)。
A. |
B. 的体积分数不再变化 的体积分数不再变化 |
C. 不再变化 不再变化 |
| D.混合气体的密度不再改变 |
(5)M点对应温度下,
 的转化率为
的转化率为
您最近一年使用:0次
【推荐3】钯催化剂(主要成分为 ,还含少量铁、铜等元素)在使用过程中,
,还含少量铁、铜等元素)在使用过程中, 易被氧化为难溶于酸的
易被氧化为难溶于酸的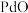 而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
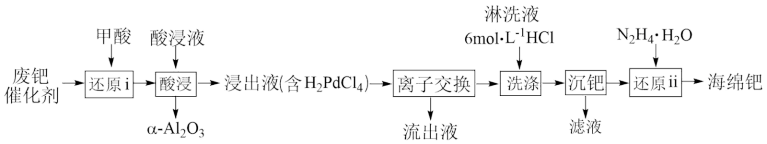
(1)“还原i”加入甲酸的目的是还原_______ (填化学式)。
(2)“酸浸”过程:
①从绿色化学要求出发,酸浸液应选择_______ (填标号)。
A.王水(浓硝酸和浓盐酸按体积比 混合) B.盐酸和
混合) B.盐酸和 C.盐酸和
C.盐酸和
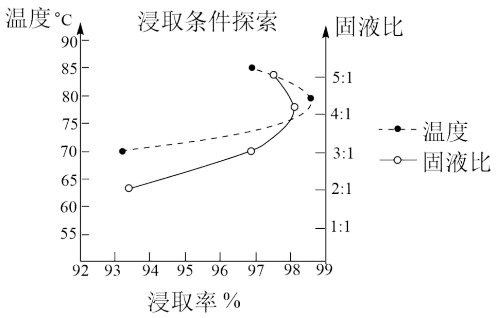
②温度、固液比对浸取率的影响如图,则“酸浸”的最佳条件为_______ 。
(3)“离子交换”和“洗脱”可简单表示为: ,(
,( 为阴离子交换树脂)。
为阴离子交换树脂)。
①“离子交换”流出液中阳离子有 、
、_______ (填离子符号)。
②淋洗液需保持 小于2的原因是
小于2的原因是_______ 。
(4)“沉钯”过程钯元素主要发生如下转化: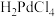 (稀溶液)
(稀溶液) (稀溶液)
(稀溶液) (沉淀)。“沉钯”的目的是
(沉淀)。“沉钯”的目的是_______ 。
(5)“还原ii”中产生无毒无害气体。由 生成海绵钯的化学方程式为
生成海绵钯的化学方程式为_______ 。
(6)该工艺流程中可循环利用的物质有_______ 。
 ,还含少量铁、铜等元素)在使用过程中,
,还含少量铁、铜等元素)在使用过程中, 易被氧化为难溶于酸的
易被氧化为难溶于酸的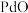 而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
(1)“还原i”加入甲酸的目的是还原
(2)“酸浸”过程:
①从绿色化学要求出发,酸浸液应选择
A.王水(浓硝酸和浓盐酸按体积比
 混合) B.盐酸和
混合) B.盐酸和 C.盐酸和
C.盐酸和
②温度、固液比对浸取率的影响如图,则“酸浸”的最佳条件为

(3)“离子交换”和“洗脱”可简单表示为:
 ,(
,( 为阴离子交换树脂)。
为阴离子交换树脂)。①“离子交换”流出液中阳离子有
 、
、②淋洗液需保持
 小于2的原因是
小于2的原因是(4)“沉钯”过程钯元素主要发生如下转化:
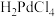 (稀溶液)
(稀溶液) (稀溶液)
(稀溶液) (沉淀)。“沉钯”的目的是
(沉淀)。“沉钯”的目的是(5)“还原ii”中产生无毒无害气体。由
 生成海绵钯的化学方程式为
生成海绵钯的化学方程式为(6)该工艺流程中可循环利用的物质有
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】将CO2还原为HCOOH是实现“碳中和”的有效途径。
(1)利用反应CO2(g)+H2(g) HCOOH(g) ΔH=+14.9 kJ/mol不能实现CO2直接加氢合成HCOOH,原因是
HCOOH(g) ΔH=+14.9 kJ/mol不能实现CO2直接加氢合成HCOOH,原因是___________ 。
(2)CO2通过电解法转化为HCOO-的反应机理如图1所示。Pt电极上覆盖的Nafion膜是一种阳离子交换膜,对浓度不高的HCOO-有较好的阻拦作用,可让H2O自由通过。

①Sn电极上生成HCOO-的电极反应式为___________ 。
②电路中通过的电量与HCOO-产率的关系如图2所示。相同条件下,Pt电极有Nafion膜HCOO-产率明显提高、但电量>1 000 C后又显著下降,可能原因是____________ 。

③电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是___________ 。
(3)CO2电还原可能的反应机理如下图所示。Sn、In、Bi的活性位点对O的连接能力较强,Au、Cu的活性位点对C的连接能力较强,Cu对CO的吸附能力远大于Au,且Cu吸附CO后不易脱离。

若还原产物主要为CH4时,应选择___________ (填“Sn”“Au”或“Cu”)作催化剂,简述分析过程:___________ 。
(1)利用反应CO2(g)+H2(g)
 HCOOH(g) ΔH=+14.9 kJ/mol不能实现CO2直接加氢合成HCOOH,原因是
HCOOH(g) ΔH=+14.9 kJ/mol不能实现CO2直接加氢合成HCOOH,原因是(2)CO2通过电解法转化为HCOO-的反应机理如图1所示。Pt电极上覆盖的Nafion膜是一种阳离子交换膜,对浓度不高的HCOO-有较好的阻拦作用,可让H2O自由通过。

①Sn电极上生成HCOO-的电极反应式为
②电路中通过的电量与HCOO-产率的关系如图2所示。相同条件下,Pt电极有Nafion膜HCOO-产率明显提高、但电量>1 000 C后又显著下降,可能原因是

③电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
(3)CO2电还原可能的反应机理如下图所示。Sn、In、Bi的活性位点对O的连接能力较强,Au、Cu的活性位点对C的连接能力较强,Cu对CO的吸附能力远大于Au,且Cu吸附CO后不易脱离。

若还原产物主要为CH4时,应选择
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】 是一种廉价的碳资源,其综合利用具有重要意义。
是一种廉价的碳资源,其综合利用具有重要意义。
(1)水煤气变换[ ]是工业上获取
]是工业上获取 、
、 的途径之一。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程如图所示,其中吸附在金催化剂表面上的物种用●标注。
的途径之一。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程如图所示,其中吸附在金催化剂表面上的物种用●标注。
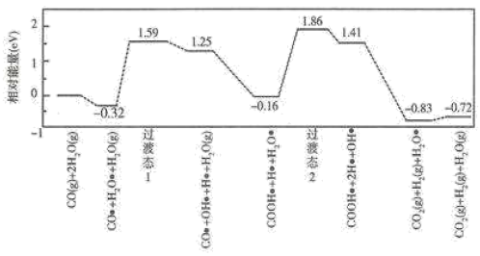
可知水煤气变换的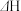
________ 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)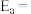
________  ,写出该步骤的化学方程式
,写出该步骤的化学方程式____________________ 。
(2)水煤气变换获取的 、
、 ,经催化反应能合成二甲醚,其过程中主要发生下列反应:
,经催化反应能合成二甲醚,其过程中主要发生下列反应:
反应Ⅰ: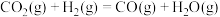
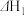
反应Ⅱ: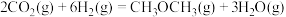
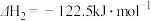
在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图。
的选择性随温度的变化如图。
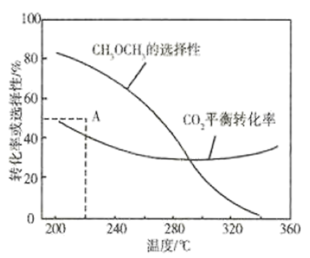
其中: 的选择性
的选择性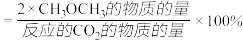
①温度高于300℃, 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是____________________ 。
②220℃时,在催化剂作用下 与
与 反应一段时间后,测得
反应一段时间后,测得 的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高
的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有____________________ 。
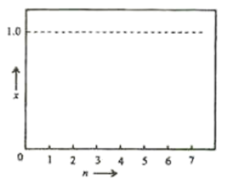
(3)用二氧化碳催化加氢还可用来合成低碳烯烃。反应开始时在0.1MPa条件下,以 的投料比充入体积固定的密闭容器中,发生反应:
的投料比充入体积固定的密闭容器中,发生反应: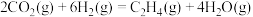 ,不同温度下平衡时的四种气态物质的物质的量百分数如图所示。
,不同温度下平衡时的四种气态物质的物质的量百分数如图所示。
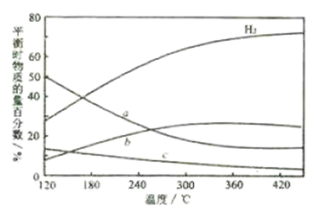
在120℃达到平衡时,二氧化碳的转化率为________ ;若氢气和二氧化碳的物质的量之比为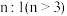 进行投料,温度控制为120℃,相应平衡体系中乙烯的产率为x,在图中绘制x随n(
进行投料,温度控制为120℃,相应平衡体系中乙烯的产率为x,在图中绘制x随n( )变化的示意图(标出曲线的起点坐标)。
)变化的示意图(标出曲线的起点坐标)。____________
(4)采用高温熔融混合碳酸盐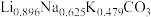 作为电解质,吸收并电解
作为电解质,吸收并电解 制得无定型碳,是二氧化碳的资源化利用的一种新途径。此法的阴极电极反应式为
制得无定型碳,是二氧化碳的资源化利用的一种新途径。此法的阴极电极反应式为____________________ 。
 是一种廉价的碳资源,其综合利用具有重要意义。
是一种廉价的碳资源,其综合利用具有重要意义。(1)水煤气变换[
 ]是工业上获取
]是工业上获取 、
、 的途径之一。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程如图所示,其中吸附在金催化剂表面上的物种用●标注。
的途径之一。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程如图所示,其中吸附在金催化剂表面上的物种用●标注。
可知水煤气变换的
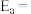
 ,写出该步骤的化学方程式
,写出该步骤的化学方程式(2)水煤气变换获取的
 、
、 ,经催化反应能合成二甲醚,其过程中主要发生下列反应:
,经催化反应能合成二甲醚,其过程中主要发生下列反应:反应Ⅰ:
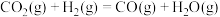
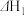
反应Ⅱ:
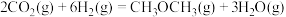
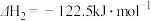
在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图。
的选择性随温度的变化如图。
其中:
 的选择性
的选择性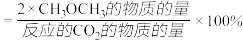
①温度高于300℃,
 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是②220℃时,在催化剂作用下
 与
与 反应一段时间后,测得
反应一段时间后,测得 的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高
的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有(3)用二氧化碳催化加氢还可用来合成低碳烯烃。反应开始时在0.1MPa条件下,以
 的投料比充入体积固定的密闭容器中,发生反应:
的投料比充入体积固定的密闭容器中,发生反应: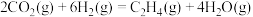 ,不同温度下平衡时的四种气态物质的物质的量百分数如图所示。
,不同温度下平衡时的四种气态物质的物质的量百分数如图所示。
在120℃达到平衡时,二氧化碳的转化率为
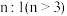 进行投料,温度控制为120℃,相应平衡体系中乙烯的产率为x,在图中绘制x随n(
进行投料,温度控制为120℃,相应平衡体系中乙烯的产率为x,在图中绘制x随n( )变化的示意图(标出曲线的起点坐标)。
)变化的示意图(标出曲线的起点坐标)。
(4)采用高温熔融混合碳酸盐
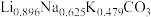 作为电解质,吸收并电解
作为电解质,吸收并电解 制得无定型碳,是二氧化碳的资源化利用的一种新途径。此法的阴极电极反应式为
制得无定型碳,是二氧化碳的资源化利用的一种新途径。此法的阴极电极反应式为
您最近一年使用:0次
【推荐3】 甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。
甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。
(1) 甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力条件下,将按一定比例混合的
甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力条件下,将按一定比例混合的 和
和 通过装有催化剂的反应器可得到甲烷。已知:
通过装有催化剂的反应器可得到甲烷。已知:

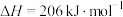 ;
;

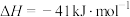 。
。
则反应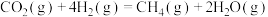 的
的
___________  ,
,
___________ 0(填“>”、“<”或“=”)。
(2)催化剂的选择是 甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得
甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得 转化率和生成
转化率和生成 选择性随温度变化的影响如下图所示。
选择性随温度变化的影响如下图所示。
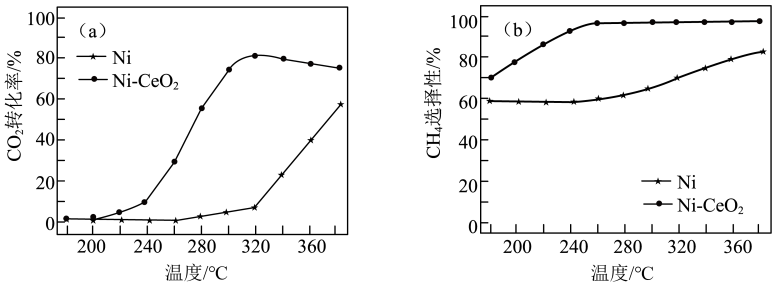
①高于320℃后,以Ni- 为催化剂,
为催化剂, 转化率略有下降,而以Ni为催化剂,
转化率略有下降,而以Ni为催化剂, 转化率却仍在上升,其原因是
转化率却仍在上升,其原因是___________ 。
②对比上述两种催化剂的催化性能,工业上应选择的催化剂是___________ ,使用的合适温度为___________ 。
(3)近年来新兴的生物电催化技术运用微生物电解池也可实现 甲烷化,其工作原理如图所示。
甲烷化,其工作原理如图所示。
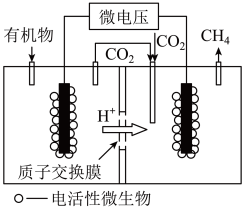
①微生物电解池实现 甲烷化的阴极电极反应式为
甲烷化的阴极电极反应式为___________ 。
②如果处理有机物[ ]产生标准状况下56L的甲烷,则理论上导线中通过的电子的物质的量为
]产生标准状况下56L的甲烷,则理论上导线中通过的电子的物质的量为___________ 。
 甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。
甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。(1)
 甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力条件下,将按一定比例混合的
甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力条件下,将按一定比例混合的 和
和 通过装有催化剂的反应器可得到甲烷。已知:
通过装有催化剂的反应器可得到甲烷。已知:
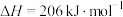 ;
;
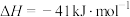 。
。则反应
 的
的
 ,
,
(2)催化剂的选择是
 甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得
甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得 转化率和生成
转化率和生成 选择性随温度变化的影响如下图所示。
选择性随温度变化的影响如下图所示。
①高于320℃后,以Ni-
 为催化剂,
为催化剂, 转化率略有下降,而以Ni为催化剂,
转化率略有下降,而以Ni为催化剂, 转化率却仍在上升,其原因是
转化率却仍在上升,其原因是②对比上述两种催化剂的催化性能,工业上应选择的催化剂是
(3)近年来新兴的生物电催化技术运用微生物电解池也可实现
 甲烷化,其工作原理如图所示。
甲烷化,其工作原理如图所示。
①微生物电解池实现
 甲烷化的阴极电极反应式为
甲烷化的阴极电极反应式为②如果处理有机物[
 ]产生标准状况下56L的甲烷,则理论上导线中通过的电子的物质的量为
]产生标准状况下56L的甲烷,则理论上导线中通过的电子的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】锡烟尘(主要含ZnO、ZnFe2O4、SnO、SnO2、In2O3、In2S3)氧压浸出分离回收金属的工艺流程如下:

已知:常温下,Ksp[In(OH)3]=10-34。
回答下列问题:
(1)金属铟为49号元素,在元素周期表中的位置为_____ 。
(2)“氧压浸出”过程中,In2S3发生氧化还原生成单质S的离子方程式为_____ 。
(3)实验测得氧分压对Sn、In、Zn的浸出率影响如图所示。

写出由Sn(Ⅱ)转化为H2SnO3的离子方程式:_____ ,从平衡移动的角度解释氧分压对Sn的浸出率的影响:_____ ;最佳氧分压为_____ (填序号)MPa。
A.0.4 B.0.6 C.0.7 D.1.0
(4)“萃取”过程中,发生反应In3++3(HA)2=InA3·3HA+3H+。
①“萃取”过程中,使用的硅酸盐仪器为_____ 。
②“萃余液I”中含有的金属离子为_____ 。
(5)“反萃取”后,可先中和再加入Zn粉置换,中和的目的是_____ ;已知常温下,“反萃取”后溶液中In3+的浓度为0.0115g·L-1,则中和时可调节pH的最大值为_____ 。

已知:常温下,Ksp[In(OH)3]=10-34。
回答下列问题:
(1)金属铟为49号元素,在元素周期表中的位置为
(2)“氧压浸出”过程中,In2S3发生氧化还原生成单质S的离子方程式为
(3)实验测得氧分压对Sn、In、Zn的浸出率影响如图所示。

写出由Sn(Ⅱ)转化为H2SnO3的离子方程式:
A.0.4 B.0.6 C.0.7 D.1.0
(4)“萃取”过程中,发生反应In3++3(HA)2=InA3·3HA+3H+。
①“萃取”过程中,使用的硅酸盐仪器为
②“萃余液I”中含有的金属离子为
(5)“反萃取”后,可先中和再加入Zn粉置换,中和的目的是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】CeO2是一种重要的稀土氧化物,可利用氟碳铈矿(主要成分为CeFCO3)来制备。其工艺流程如下:
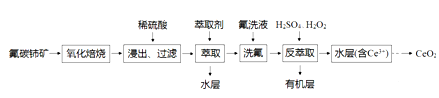
已知:I.Ce4+能与SO42-结合成[CeSO4]2+,与F-结合成[CeFx](4-x)+(0<x<4).
II.在硫酸体系中,Ce4+能被萃取剂萃取二Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是_________________ 。
(2)CeO2不溶于水和碱,微溶于酸,但“浸出”时却能溶解完全,原因是溶液中的_______ (填原子符号,下同)、__________ 、_____________ 促进了CeO2的溶解。
(3)“反萃取”时发生反应的离子方程式为____________________ 。
(4)若缺少“洗氟”这一环节,则所得产品的质量将___________ (填“偏大”“偏小”或“不变”)。

已知:I.Ce4+能与SO42-结合成[CeSO4]2+,与F-结合成[CeFx](4-x)+(0<x<4).
II.在硫酸体系中,Ce4+能被萃取剂萃取二Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是
(2)CeO2不溶于水和碱,微溶于酸,但“浸出”时却能溶解完全,原因是溶液中的
(3)“反萃取”时发生反应的离子方程式为
(4)若缺少“洗氟”这一环节,则所得产品的质量将
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
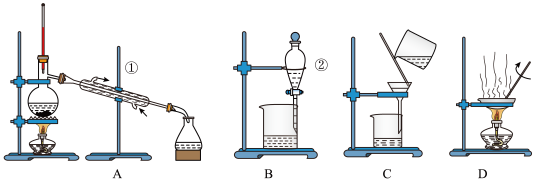
(1)从氯化钾溶液中得到氯化钾固体,选择装置_______ (填上图的字母);除去自来水中的 等杂质,选择装置
等杂质,选择装置_______ (填上图的字母),分离方法的名称_______ 。
(2)分离植物油和水选择装置_______ (填上图的字母),该分离方法的名称为_______ 。
(3)除去氯化钠溶液中的硫酸钡,选择装置_______ (填上图的字母)。
(4)从海水中提取蒸馏水、溴、食盐过程过如图:
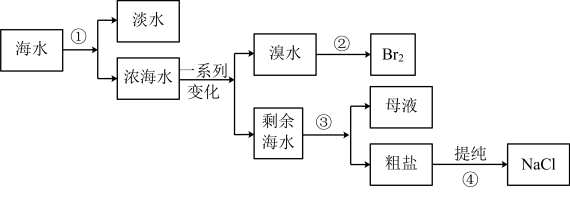
①从海水中获取淡水的方法是选择装置A,A仪器①的名称是_______ ,进水的方向是从_______ (填“上”或“下”)口进水。
②从溴水中获得单质溴时,采用的方法是萃取、_______ (填上图的字母)、蒸馏。下列可选作萃取剂的是_______ 。
A. 酒精 B. 苯 C.
(5)粗盐含有 、
、 、
、 等离子,为除去以上杂质离子,可加入①
等离子,为除去以上杂质离子,可加入① 溶液 ②
溶液 ② 溶液 ③NaOH溶液 ④过滤 ⑤稀盐酸。错误的操作顺序是_______。
溶液 ③NaOH溶液 ④过滤 ⑤稀盐酸。错误的操作顺序是_______。
(6)氯碱工业用离子交换膜法电解饱和食盐水,装置示意图如图。下列说法错误的是
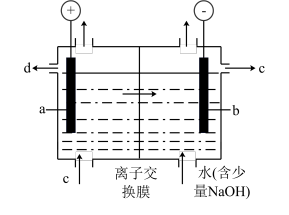
(7)某溶液中含有较大量的 、
、 、
、 等三种阴离子,如果只取一次该溶液就能够将三种阴离子依次检验出来,下列实验操作顺序正确的是_______。
等三种阴离子,如果只取一次该溶液就能够将三种阴离子依次检验出来,下列实验操作顺序正确的是_______。
①滴加过量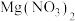 溶液 ②过滤 ③滴加
溶液 ②过滤 ③滴加 溶液 ④加
溶液 ④加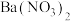 溶液
溶液

(1)从氯化钾溶液中得到氯化钾固体,选择装置
 等杂质,选择装置
等杂质,选择装置(2)分离植物油和水选择装置
(3)除去氯化钠溶液中的硫酸钡,选择装置
(4)从海水中提取蒸馏水、溴、食盐过程过如图:

①从海水中获取淡水的方法是选择装置A,A仪器①的名称是
②从溴水中获得单质溴时,采用的方法是萃取、
A. 酒精 B. 苯 C.

(5)粗盐含有
 、
、 、
、 等离子,为除去以上杂质离子,可加入①
等离子,为除去以上杂质离子,可加入① 溶液 ②
溶液 ② 溶液 ③NaOH溶液 ④过滤 ⑤稀盐酸。错误的操作顺序是_______。
溶液 ③NaOH溶液 ④过滤 ⑤稀盐酸。错误的操作顺序是_______。| A.①②③④⑤ | B.②①③④⑤ | C.③②①④⑤ | D.②③①④⑤ |

| A.a为阳极,发生氧化反应生成氯气 |
B.b极的电极反应式为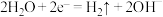 |
| C.检验阳极产物时用湿润的淀粉碘化钾试纸,试纸变蓝 |
| D.通电一段时间后,阴极区pH降低 |
 、
、 、
、 等三种阴离子,如果只取一次该溶液就能够将三种阴离子依次检验出来,下列实验操作顺序正确的是_______。
等三种阴离子,如果只取一次该溶液就能够将三种阴离子依次检验出来,下列实验操作顺序正确的是_______。①滴加过量
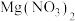 溶液 ②过滤 ③滴加
溶液 ②过滤 ③滴加 溶液 ④加
溶液 ④加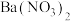 溶液
溶液| A.④②①②③ | B.①②④②③ | C.①②③②④ | D.④②③②① |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】用含铬不锈钢废渣(含SiO2、Cr2O3、Fe2O3、Al2O3等)制取Cr2O3(铬绿)的工艺流程如图所示:

回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是_______ 、_______ 。
(2)Cr2O3、KOH、O2反应生成K2CrO4的化学方程式为_______ 。
(3)“水浸”时,碱熔渣中的KFeO2强烈水解生成的难溶物为_______ (填化学式,下同),“酸化”后过滤所得滤渣的主要成分为_______ 。
(4)常温下,“酸化”时pH不宜过低的原因是_______ ;若此时溶液的 ,则
,则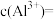
_______ mol/L。{已知:常温下,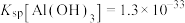 }
}
(5)“还原”时发生反应的离子方程式 为_______ 。
(6)由Cr(OH)3制取铬绿的方法是_______ 。

回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是
(2)Cr2O3、KOH、O2反应生成K2CrO4的化学方程式为
(3)“水浸”时,碱熔渣中的KFeO2强烈水解生成的难溶物为
(4)常温下,“酸化”时pH不宜过低的原因是
 ,则
,则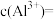
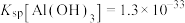 }
}(5)“还原”时发生反应的
(6)由Cr(OH)3制取铬绿的方法是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】钼酸钠晶体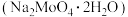 常用于配制金属缓蚀剂。图为利用钼精矿(主要成分是
常用于配制金属缓蚀剂。图为利用钼精矿(主要成分是 ,含少量
,含少量 等)为原料生产钼酸钠晶体的工艺流程图。回答下列问题:
等)为原料生产钼酸钠晶体的工艺流程图。回答下列问题:

(1)为了提高焙烧效率,除增大空气量外还可以采用的措施是___ (写一条即可),写出焙烧时生成 的化学方程式
的化学方程式___ 。
(2)“浸取”时产生的气体A是_______ 。
(3)若“过滤”前加入的沉淀剂为 ,则废渣的成分为
,则废渣的成分为_______ (填化学式)。
(4)“结晶”前需向滤液中加入 固体以除去
固体以除去 。若滤液中
。若滤液中 ,
, ,要使钼元素无损失,
,要使钼元素无损失, 的最大去除率是
的最大去除率是_______ [已知: ,
, ]。
]。
(5)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是___ 。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为___  。
。

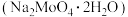 常用于配制金属缓蚀剂。图为利用钼精矿(主要成分是
常用于配制金属缓蚀剂。图为利用钼精矿(主要成分是 ,含少量
,含少量 等)为原料生产钼酸钠晶体的工艺流程图。回答下列问题:
等)为原料生产钼酸钠晶体的工艺流程图。回答下列问题:
(1)为了提高焙烧效率,除增大空气量外还可以采用的措施是
 的化学方程式
的化学方程式(2)“浸取”时产生的气体A是
(3)若“过滤”前加入的沉淀剂为
 ,则废渣的成分为
,则废渣的成分为(4)“结晶”前需向滤液中加入
 固体以除去
固体以除去 。若滤液中
。若滤液中 ,
, ,要使钼元素无损失,
,要使钼元素无损失, 的最大去除率是
的最大去除率是 ,
, ]。
]。(5)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为
 。
。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
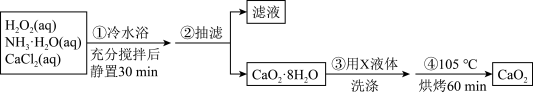
【推荐3】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。
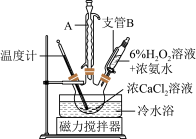
某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图如下:
请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为________________ ;
(2)支管B的作用是__________ ;加入氨水的作用是________________ ;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________ ;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙_____________ 的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
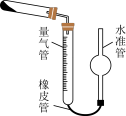
①检查该装置气密性的方法是:____________________ ;
②使用分析天平准确称取0.5000g样品,置于试管中加热使其完全分解,收集到 33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为_________ (保留4位有效数字);
某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图如下:


请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为
(2)支管B的作用是
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
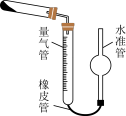
①检查该装置气密性的方法是:
②使用分析天平准确称取0.5000g样品,置于试管中加热使其完全分解,收集到 33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为
您最近一年使用:0次



