已知: pH=-lgc(H+), pOH=-lgc(OH-)。 常温下,向某浓度的盐酸溶液中滴加氢氧化钠溶液,所得溶液pOH和pH变化如图所示。 下列说法正确的是
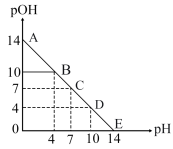

| A.盐酸与NaOH溶液的浓度相等 |
| B.B点和D点水的电离程度相同 |
| C.滴加NaOH溶液改为滴加氨水溶液,该图曲线不变 |
| D.升高温度,滴定过程中pOH+pH>14 |
19-20高三上·福建福州·期末 查看更多[3]
(已下线)福建省福州市2019届高三年上学期期末质量抽测化学试卷重庆市乌江新高考协作体2023-2024学年高二上学期1月期末化学试题云南省大理市下关第一中学2023-2024学年高二下学期开学化学试题
更新时间:2019-01-08 15:12:40
|
相似题推荐
单选题
|
较难
(0.4)
解题方法
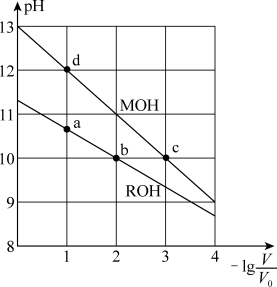
【推荐1】常温下,向体积均为V0、浓度均为0.10 mol·L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随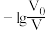 的变化如图所示,
的变化如图所示,
下列叙述正确的是
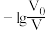 的变化如图所示,
的变化如图所示,
下列叙述正确的是
A.b、c两点的溶液中: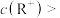 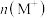 |
| B.MOH的电离程度:c点小于d点 |
| C.溶液中水的的电离程度:b>c>a>d |
D.当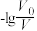 =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则 增大 增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列说法错误的是
A.向KHCO3溶液中加入CH3COONa固体,则c( )增大 )增大 |
B.向NH4Cl溶液中加入少量 固体,则水的电离程度增大 固体,则水的电离程度增大 |
C.向H2S 溶液中滴加 KOH 溶液至中性,则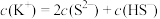 |
D.已知NaHC2O4溶液呈酸性,向 Na2C2O4溶液中滴加H2SO4溶液至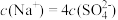 ,则 ,则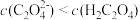 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】常温下,向20mL1mol·L-1CuCl2溶液中滴加2mol·L-1Na2S溶液的滴定曲线如图所示。已知:pCu=-lgc(Cu2+),lg2.5=0.4,常温下Ksp(FeS)=6.3×10-18;Kal(H2S)=1.2×10-7,Ka2(H2S)=7.1×10-15。下列说法中正确的是
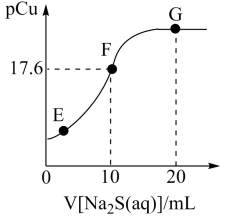

| A.常温下,S2-的水解常数Kh(S2-)约为8.3×10-8 |
| B.E→F→G的过程中,水的电离度一直在减小 |
| C.向1mol·L-1FeSO4(aq)中加入足量CuS固体,产生FeS沉淀 |
| D.25℃时,Cu2++H2S=CuS↓+2H+的K约为1.36×1014 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】常温下,向20mL0.1000mol·L-1NaB溶液中滴加等浓度的弱酸HA溶液,所得混合溶液中lg 与1g
与1g 的关系如图所示。已知Ka(HA)=1.77×10-4。下列说法正确的是
的关系如图所示。已知Ka(HA)=1.77×10-4。下列说法正确的是
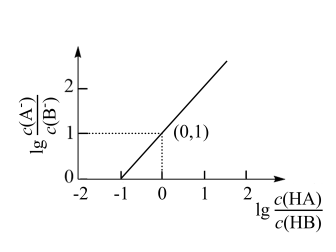
 与1g
与1g 的关系如图所示。已知Ka(HA)=1.77×10-4。下列说法正确的是
的关系如图所示。已知Ka(HA)=1.77×10-4。下列说法正确的是
| A.Ka(HB)>Ka(HA) |
B.pH=4时,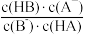 的值比pH=3的大 的值比pH=3的大 |
| C.滴入20mLHA溶液后存在关系:c(A-)>c(HB) |
| D.pH=7时,混合溶液中一定存在关系:c(Na+)=c(B-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】常温下,将 的某一元酸HA溶液与
的某一元酸HA溶液与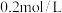 的NaOH溶液等体积混合后
的NaOH溶液等体积混合后 忽略混合前后溶液体积变化
忽略混合前后溶液体积变化 ,则混合后溶液中的下列关系正确的是
,则混合后溶液中的下列关系正确的是
 的某一元酸HA溶液与
的某一元酸HA溶液与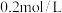 的NaOH溶液等体积混合后
的NaOH溶液等体积混合后 忽略混合前后溶液体积变化
忽略混合前后溶液体积变化 ,则混合后溶液中的下列关系正确的是
,则混合后溶液中的下列关系正确的是
A.可能有 |
B.必定有 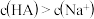 |
C.可能有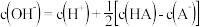 |
D. 可能大于 可能大于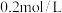 |
您最近一年使用:0次
单选题
|
较难
(0.4)
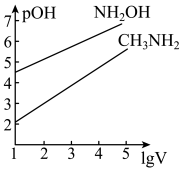
【推荐1】室温,将10mL浓度为 的
的 、
、 两种一元碱溶液分别加水稀释,曲线如图,V是溶液体积(mL),
两种一元碱溶液分别加水稀释,曲线如图,V是溶液体积(mL),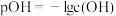 。已知:
。已知: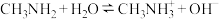 ;
;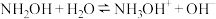 。下列说法正确的是
。下列说法正确的是
 的
的 、
、 两种一元碱溶液分别加水稀释,曲线如图,V是溶液体积(mL),
两种一元碱溶液分别加水稀释,曲线如图,V是溶液体积(mL),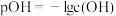 。已知:
。已知: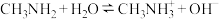 ;
;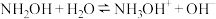 。下列说法正确的是
。下列说法正确的是
A.该温度下, 的数量级为 的数量级为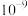 |
B.当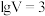 时,水的电离程度: 时,水的电离程度: |
C.用等浓度盐酸分别滴定两种碱溶液至 ,消耗盐酸的体积: ,消耗盐酸的体积: |
D.等浓度的 和 和 两种盐溶液中离子总浓度相等 两种盐溶液中离子总浓度相等 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】下列说法正确的是
| A.将 pH = 4 的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| B.中和 pH 与体积均相同的盐酸和醋酸溶液,消耗 NaOH 的物质的量相同 |
| C.已知 pOH = -lg[c(O H- )],又知体温下正常人的血液 pH=7.35,则血液的 pOH 为 6.65 |
| D.KCN 溶液中有剧毒 HCN 挥发出来,为了减少 HCN 的生成,最佳方法是加入 KOH |
您最近一年使用:0次
单选题
|
较难
(0.4)
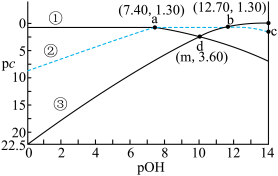
【推荐3】常温下,在含有0.10
 的溶液中,所有含磷元素的微粒pc随pOH的变化关系如图所示。已知
的溶液中,所有含磷元素的微粒pc随pOH的变化关系如图所示。已知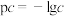 ,
,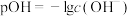 ,下列有关说法中正确的是
,下列有关说法中正确的是

 的溶液中,所有含磷元素的微粒pc随pOH的变化关系如图所示。已知
的溶液中,所有含磷元素的微粒pc随pOH的变化关系如图所示。已知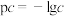 ,
,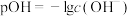 ,下列有关说法中正确的是
,下列有关说法中正确的是
A.曲线①代表 |
B. 溶液显碱性的原因是 溶液显碱性的原因是 的水解程度大于电离 的水解程度大于电离 |
C. 的 的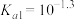 |
D.c点对应的溶液中: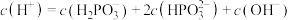 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】25℃时,向
 的弱碱(
的弱碱( )溶液中逐滴加入浓度为
)溶液中逐滴加入浓度为 的盐酸,溶液中
的盐酸,溶液中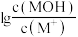 和溶液的pOH[
和溶液的pOH[ ]随中和率的变化关系如图所示。已知:
]随中和率的变化关系如图所示。已知: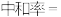
 。下列说法正确的是
。下列说法正确的是


 的弱碱(
的弱碱( )溶液中逐滴加入浓度为
)溶液中逐滴加入浓度为 的盐酸,溶液中
的盐酸,溶液中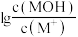 和溶液的pOH[
和溶液的pOH[ ]随中和率的变化关系如图所示。已知:
]随中和率的变化关系如图所示。已知: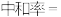
 。下列说法正确的是
。下列说法正确的是
A.a点时, |
B.b点时,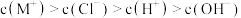 |
C.c点时, |
| D.d点对应的溶液水的电离程度比c点对应的溶液小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列说法正确的是
| A.0.1 mol·L-1pH为4的NaHB溶液中:c (HB-)>c(H2B)>c(B2-) |
B.如下图表示25℃时,用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1 NaOH溶液时,溶液的pH随加入酸体积的变化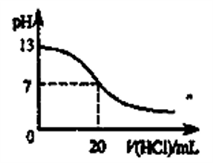 |
| C.在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-) |
D.pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy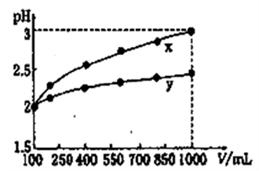 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。苹果酸( ,用
,用 表示)是应用广泛的植物酸味剂,现利用电位滴定法向5.60mL苹果酸溶液滴加0.18mol/LNaOH溶液以测定苹果酸溶液的浓度,滴定曲线如图所示。下列说法正确的是
表示)是应用广泛的植物酸味剂,现利用电位滴定法向5.60mL苹果酸溶液滴加0.18mol/LNaOH溶液以测定苹果酸溶液的浓度,滴定曲线如图所示。下列说法正确的是

 ,用
,用 表示)是应用广泛的植物酸味剂,现利用电位滴定法向5.60mL苹果酸溶液滴加0.18mol/LNaOH溶液以测定苹果酸溶液的浓度,滴定曲线如图所示。下列说法正确的是
表示)是应用广泛的植物酸味剂,现利用电位滴定法向5.60mL苹果酸溶液滴加0.18mol/LNaOH溶液以测定苹果酸溶液的浓度,滴定曲线如图所示。下列说法正确的是
| A.该滴定过程可选用甲基橙作指示剂 |
B.a点存在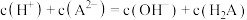 |
C.b点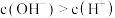 |
| D.若a、b两点横坐标分别为2.90、5.80,则苹果酸的浓度约为0.047mol/L |
您最近一年使用:0次




