常温下,将某一元酸 HA 和 NaOH 溶液等体积混合,两种溶液的浓度和混合后所得溶液的 pH 如下表,请回答:
(1) 不考虑其它组的实验结果,单从甲组情况分析,如何用 a (混合溶液的 pH)来说明HA 是强酸还是弱酸_____ 。
(2)不考虑其它组的实验结果,单从乙组情况分析,c 是否一定等于 0.2_____ (选填“是” 或“否”),混合液中离子浓度 c(A−)与 c(Na+)的大小关系是_____ 。
(3)丙组实验结果分析,HA 是_____ 酸(选填“强”或“弱”).该混合溶液中离子浓度 由大到小的顺序是_____ 。
(4)丁组实验所得混合溶液中由水电离出的c(OH−) =_____ mol · L−1,写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+) − c(A−) =_________ mol · L−1 ,c(OH−) − c(HA) =________ mol · L−1。
| 实验编号 | HA物质的量浓度 (mol·L-1) | NaOH物质的量浓度 (mol·L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(1) 不考虑其它组的实验结果,单从甲组情况分析,如何用 a (混合溶液的 pH)来说明HA 是强酸还是弱酸
(2)不考虑其它组的实验结果,单从乙组情况分析,c 是否一定等于 0.2
(3)丙组实验结果分析,HA 是
(4)丁组实验所得混合溶液中由水电离出的c(OH−) =
更新时间:2020-10-16 15:37:44
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】I.已知25℃,H2CO3电离平衡常数Ka1=4.0×10-7,Ka2=5.0×10-11,回答下列问题:
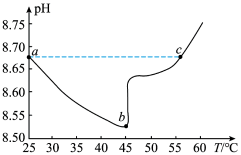
(1)如图为某实验测得0.1mol/LNaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法正确的是___________(填标号)。
(2)若定义pOH=-lgc(OH-),则25℃时0.01mol/LNa2CO3溶液的pOH为_______ (已知lg2=0.30)
(3)常温下,用NaOH溶液吸收CO2得到pH=8的混合溶液,则吸收过程中水的电离平衡______ (填“向左”“向右”或“不")移动。试计算所得溶液中c(H2CO3):c( )=
)=_______ 。
Ⅱ.0.010mol/L的一元酸HA溶液中HA、A-的物质的量分数δ(X)随pH变化如图所示。HA对应的电离平衡常数为Ka,由图确定下列数据:
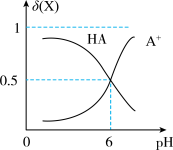
(4)K=___________ 。
(5)若将0.20mol/LNaA溶液和cmol/L盐酸等体积混合,若所得溶液为中性,则c=________ (结果保留两位小数)。
(1)如图为某实验测得0.1mol/LNaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法正确的是___________(填标号)。

| A.a点溶液的c(OH-)比c点溶液的小 |
| B.a点时,Kw<Ka1(H2CO3)·K2(H2CO3) |
C.b点溶液中,c(Na+)+c(H+)=c( )+2c( )+2c( )+c(OH-) )+c(OH-) |
D.ab段,pH减小说明升温抑制了 的水解 的水解 |
(3)常温下,用NaOH溶液吸收CO2得到pH=8的混合溶液,则吸收过程中水的电离平衡
 )=
)=Ⅱ.0.010mol/L的一元酸HA溶液中HA、A-的物质的量分数δ(X)随pH变化如图所示。HA对应的电离平衡常数为Ka,由图确定下列数据:

(4)K=
(5)若将0.20mol/LNaA溶液和cmol/L盐酸等体积混合,若所得溶液为中性,则c=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)向0.01 mol/L的NH4Cl溶液中分别加入少量的KOH固体、浓盐酸、FeCl3固体、Na2CO3固体,使NH4+水解平衡移动的方向分别为_____ 、_____ 、_____ 、____ (填“右”“左”或“不移动”)
(2)写出Na2CO3溶液中的三大守恒规律
电荷守恒:_____________________ ;
物料守恒:_____________________ ;
质子守恒:_____________________ 。
(2)写出Na2CO3溶液中的三大守恒规律
电荷守恒:
物料守恒:
质子守恒:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】草酸( )常用作还原剂和漂白剂,在25℃时为无色透明结晶,电离常数
)常用作还原剂和漂白剂,在25℃时为无色透明结晶,电离常数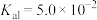 ,
,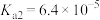 。
。
(1)某科研小组欲配制 溶液。
溶液。
①需要用托盘天平称量草酸晶体( )的质量是
)的质量是______ g。
②配制过程中,下列仪器中未用到的是______ (填仪器名称)。

(2)取100mL配制的草酸溶液,向其中逐渐加入NaOH固体,所得溶液中含碳微粒的浓度随溶液pH的变化如图所示(假设溶液体积变化忽略不计)。

①图中曲线Ⅱ表示的含碳微粒是______ (填微粒符号)。
②25℃, 的水解平衡常数
的水解平衡常数
______
③pH=7时,若溶液中 ,
, ,则溶液中
,则溶液中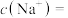
______  (用含x、y的代数式表示)。
(用含x、y的代数式表示)。
④M点溶液的pH为______ ( )。
)。
 )常用作还原剂和漂白剂,在25℃时为无色透明结晶,电离常数
)常用作还原剂和漂白剂,在25℃时为无色透明结晶,电离常数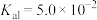 ,
,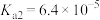 。
。(1)某科研小组欲配制
 溶液。
溶液。①需要用托盘天平称量草酸晶体(
 )的质量是
)的质量是②配制过程中,下列仪器中未用到的是

(2)取100mL配制的草酸溶液,向其中逐渐加入NaOH固体,所得溶液中含碳微粒的浓度随溶液pH的变化如图所示(假设溶液体积变化忽略不计)。

①图中曲线Ⅱ表示的含碳微粒是
②25℃,
 的水解平衡常数
的水解平衡常数
③pH=7时,若溶液中
 ,
, ,则溶液中
,则溶液中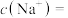
 (用含x、y的代数式表示)。
(用含x、y的代数式表示)。④M点溶液的pH为
 )。
)。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】已知在0.1 mol/L的NaHSO3溶液中有关微粒浓度由大到小的顺序为:
c(Na+)>c(HSO )>c(
)>c( )>c(H2SO3)。
)>c(H2SO3)。
(1)则该溶液中c(H+)________ c(OH-)(填“<”、“>”或“=”),简述理由(用离子方程式和必要的文字说明)_____________________________________ 。
(2)现向NaHSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是________ ;写出该反应的离子方程式______________ 。
c(Na+)>c(HSO
 )>c(
)>c( )>c(H2SO3)。
)>c(H2SO3)。(1)则该溶液中c(H+)
(2)现向NaHSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O +H2O
+H2O 2HCrO4
2HCrO4 2CrO
2CrO +2H+
+2H+
(1)在强碱溶液中,铬元素的主要存在形式为_______ (填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O )/c(CrO
)/c(CrO )将
)将_______ (填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH 、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH )>c(H+)>c(OH-) ②c(Cl-)>c(NH
)>c(H+)>c(OH-) ②c(Cl-)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(NH )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH )>c(OH-)
)>c(OH-)
(2)若溶液中只溶解了一种溶质,则该溶质是_______ ,上述四种离子浓度的大小顺序为_______ (选填序号)。
(3)若上述关系中③是正确的,则溶液中的溶质为_______ ;
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______ c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(5)你认为往废水中投入_______(填字母序号),沉淀效果最好。
(6)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______ 。
Cr2O
 +H2O
+H2O 2HCrO4
2HCrO4 2CrO
2CrO +2H+
+2H+(1)在强碱溶液中,铬元素的主要存在形式为
 )/c(CrO
)/c(CrO )将
)将Ⅱ.已知某溶液中只存在OH-、H+、NH
 、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:①c(Cl-)>c(NH
 )>c(H+)>c(OH-) ②c(Cl-)>c(NH
)>c(H+)>c(OH-) ②c(Cl-)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)③c(NH
 )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH )>c(OH-)
)>c(OH-)(2)若溶液中只溶解了一种溶质,则该溶质是
(3)若上述关系中③是正确的,则溶液中的溶质为
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
III.重金属离子对河流造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】现有室温下浓度均为1×10-3 mol·L-1的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液。回答下列问题:
(1)上述6种溶液中,水电离出的c(H+)最大的是_______ ,最小的是_______ 。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③_______ ⑥(填“>”“<”或“=”),溶液中的离子浓度由大到小的顺序为_______ 。
(3)将等体积的①、⑤混合,则溶液的pH_______ 7(填“>”“<”或“=”),用离子方程式说明其原因: _______ 。
(1)上述6种溶液中,水电离出的c(H+)最大的是
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③
(3)将等体积的①、⑤混合,则溶液的pH
您最近一年使用:0次



