Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O +H2O
+H2O 2HCrO4
2HCrO4 2CrO
2CrO +2H+
+2H+
(1)在强碱溶液中,铬元素的主要存在形式为_______ (填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O )/c(CrO
)/c(CrO )将
)将_______ (填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH 、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH )>c(H+)>c(OH-) ②c(Cl-)>c(NH
)>c(H+)>c(OH-) ②c(Cl-)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(NH )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH )>c(OH-)
)>c(OH-)
(2)若溶液中只溶解了一种溶质,则该溶质是_______ ,上述四种离子浓度的大小顺序为_______ (选填序号)。
(3)若上述关系中③是正确的,则溶液中的溶质为_______ ;
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______ c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(5)你认为往废水中投入_______(填字母序号),沉淀效果最好。
(6)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______ 。
Cr2O
 +H2O
+H2O 2HCrO4
2HCrO4 2CrO
2CrO +2H+
+2H+(1)在强碱溶液中,铬元素的主要存在形式为
 )/c(CrO
)/c(CrO )将
)将Ⅱ.已知某溶液中只存在OH-、H+、NH
 、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:①c(Cl-)>c(NH
 )>c(H+)>c(OH-) ②c(Cl-)>c(NH
)>c(H+)>c(OH-) ②c(Cl-)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)③c(NH
 )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH )>c(OH-)
)>c(OH-)(2)若溶液中只溶解了一种溶质,则该溶质是
(3)若上述关系中③是正确的,则溶液中的溶质为
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
III.重金属离子对河流造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
更新时间:2023-01-04 13:56:45
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】解答以下问题
(1)除去CuCl2溶液中的Fe3+,可以选择下列______ (填字母)调节溶液的pH值。
A.Cu B.CuO C.Cu(OH)2 D.CuCO3 E.Cu2(OH)2CO3
(2)已知室温时,Na2CO3溶液的水解常数Kh=2×10-4,当溶液中c(HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=______ 。
(3)25℃时,CH3COONH4溶液呈中性,则溶液中水电离出的H+浓度为______ ,溶液中离子浓度大小关系为______ 。
(1)除去CuCl2溶液中的Fe3+,可以选择下列
A.Cu B.CuO C.Cu(OH)2 D.CuCO3 E.Cu2(OH)2CO3
(2)已知室温时,Na2CO3溶液的水解常数Kh=2×10-4,当溶液中c(HCO
 ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=(3)25℃时,CH3COONH4溶液呈中性,则溶液中水电离出的H+浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】常温下,向浓度为0.1mol·L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
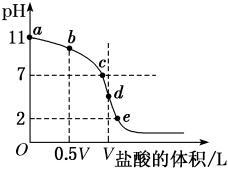
(1)该温度时NH3·H2O的电离常数K约为_______________ ;
(2)比较b、c、d三点时的溶液中,由水电离出的OH- 浓度大小顺序为______________ ;
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是___________ (填字母,下同);
A. c(H+)·c(OH-) B.
C. c(NH4+)·c(OH- ) D.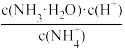
(4)根据以上滴定曲线,下列说法正确的是__________ ;
A.点b所示溶液中:c( )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c( )
)
C.点d所示溶液中:c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c( )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=____________ ,d点之后若继续加入盐酸至图象中的e点(此时不考虑 水解的影响,忽略混合时液体积变化),则e点对应的横坐标为
水解的影响,忽略混合时液体积变化),则e点对应的横坐标为__________ 。

(1)该温度时NH3·H2O的电离常数K约为
(2)比较b、c、d三点时的溶液中,由水电离出的OH- 浓度大小顺序为_
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是
A. c(H+)·c(OH-) B.

C. c(NH4+)·c(OH- ) D.
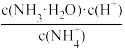
(4)根据以上滴定曲线,下列说法正确的是
A.点b所示溶液中:c(
 )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(
 )
)C.点d所示溶液中:c(Cl-)>c(H+)>c(
 )>c(OH-)
)>c(OH-)D.滴定过程中可能有:c(NH3·H2O)>c(
 )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)(5)滴定过程中所用盐酸的pH=
 水解的影响,忽略混合时液体积变化),则e点对应的横坐标为
水解的影响,忽略混合时液体积变化),则e点对应的横坐标为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问题。
(1)一定温度下,向1L0.1mol·L-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向___________ (填“正”或“逆”)反应方向移动;水的电离程度将___________ (填“增大”“减小”或“不变”)。
(2)99℃时,Kw=1.0×10-12,该温度下测得0.1mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为___________ 。
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气___________ 。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1mol·L-1H2A溶液与0.2mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为___________ 。
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是___________ (填字母)。
a、 、
、 b、
b、 、
、 c、
c、 、
、 d、H2SO3、
d、H2SO3、
②常温下,NaHSO3溶液显___________ 性(填“酸”“碱”或“中”),溶液中离子浓度从大到小的排列顺序是___________ 。
(1)一定温度下,向1L0.1mol·L-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向
(2)99℃时,Kw=1.0×10-12,该温度下测得0.1mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1mol·L-1H2A溶液与0.2mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是
a、
 、
、 b、
b、 、
、 c、
c、 、
、 d、H2SO3、
d、H2SO3、
②常温下,NaHSO3溶液显
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)常温下,向100mL0.01mol•L-1HA的溶液中逐滴加入0.02mol•L-1MOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。

①常温下,0.01mol•L-1HA溶液中由水电离出的c(H+)=______ mol•L-1。
②常温下一定浓度的MA稀溶液的pH=a,则a__ 7(填“>”、“<”或“=”),用离子方程式表示其原因为_______________________________________ ;
③X点时,溶液中c(H+)、c(M+)、c(A—)由大到小的顺序是___________________ ;
④K点时,溶液中c(H+)+c(M+)—c(OH—)=____ mol•L-1。
⑵20℃时,在c(H2C2O4)+c(HC2O4—)+c(C2O42—)=0.100mol•L—1的H2C2O4、NaOH混合溶液中,H2C2O4、HC2O4-、C2O42-的物质的量分数δ随溶液pH变化的关系如图所示。

①Q点:c(H2C2O4)______ c(HC2O4—)(填“>”、“<”或“=”)
②该温度下HC2O4-的电离常数K=___________________ 。
(1)常温下,向100mL0.01mol•L-1HA的溶液中逐滴加入0.02mol•L-1MOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。

①常温下,0.01mol•L-1HA溶液中由水电离出的c(H+)=
②常温下一定浓度的MA稀溶液的pH=a,则a
③X点时,溶液中c(H+)、c(M+)、c(A—)由大到小的顺序是
④K点时,溶液中c(H+)+c(M+)—c(OH—)=
⑵20℃时,在c(H2C2O4)+c(HC2O4—)+c(C2O42—)=0.100mol•L—1的H2C2O4、NaOH混合溶液中,H2C2O4、HC2O4-、C2O42-的物质的量分数δ随溶液pH变化的关系如图所示。

①Q点:c(H2C2O4)
②该温度下HC2O4-的电离常数K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)常温时,将浓度为m mol•L﹣1的CH3COOH溶液和n mol•L﹣1 NaOH溶液等体积混合,混合后溶液的pH=7,m与n的大小关系是m____ n(填“>”、“<”或“=”,下同);若将pH=2的CH3COOH溶液和pH=12的NaOH溶液等体积混合,混合溶液的pH______ 7。
(2)消防用的泡沫灭火器内装的药品是硫酸铝溶液和碳酸氢钠溶液,用离子方程式表示二者混合时发生的反应_________________ .
(3)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V1和碱溶液体积V2的关系为_________ .
(4)常温时Ksp[Cu(OH)2]=2.2×10﹣20,将Cu(OH)2溶于2.2mol/L CuCl2溶液中形成平衡溶液的pH为____ .
(5)物质的量浓度相同的下列溶液①(NH4)2CO3②(NH4)2SO4③NH4HCO3④NH4HSO4⑤NH4Cl⑥NH3•H2O,c(NH4+)由小到大的排列顺序是___________ (填序号)。
(2)消防用的泡沫灭火器内装的药品是硫酸铝溶液和碳酸氢钠溶液,用离子方程式表示二者混合时发生的反应
(3)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V1和碱溶液体积V2的关系为
(4)常温时Ksp[Cu(OH)2]=2.2×10﹣20,将Cu(OH)2溶于2.2mol/L CuCl2溶液中形成平衡溶液的pH为
(5)物质的量浓度相同的下列溶液①(NH4)2CO3②(NH4)2SO4③NH4HCO3④NH4HSO4⑤NH4Cl⑥NH3•H2O,c(NH4+)由小到大的排列顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)0.020 mol·L−1的HCN(aq)与0.020 mol·L−1 NaCN(aq)等体积混合,已知该混合溶液中c(Na+)>c(CN−),用“>”“<”“=”符号填空。
①溶液中c(OH−)________ c(H+)。
②溶液中c(HCN)________ c(CN−)。
(2)已知某溶液中存在OH−、H+、NH4+、Cl−四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
A.c(Cl−)>c(NH4+)>c(H+)>c(OH−)
B.c(Cl−)>c(NH4+)>c(OH−)>c(H+)
C.c(NH4+)>c(Cl−)>c(OH−)>c(H+)
D.c(Cl−)>c(H+)>c(NH4+)>c(OH−)
填写下列空白:
①若溶液中只溶解了一种溶质,则该溶质是__________________________ ,上述四种离子浓度的大小顺序为________ (填序号)。
②若上述关系中C是正确的,则溶液中的溶质为__________________ ;若上述关系中D是正确的,则溶液中的溶质为____________________ 。
③若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________ c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH−)的关系为c(H+)________ c(OH−)。
①溶液中c(OH−)
②溶液中c(HCN)
(2)已知某溶液中存在OH−、H+、NH4+、Cl−四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
A.c(Cl−)>c(NH4+)>c(H+)>c(OH−)
B.c(Cl−)>c(NH4+)>c(OH−)>c(H+)
C.c(NH4+)>c(Cl−)>c(OH−)>c(H+)
D.c(Cl−)>c(H+)>c(NH4+)>c(OH−)
填写下列空白:
①若溶液中只溶解了一种溶质,则该溶质是
②若上述关系中C是正确的,则溶液中的溶质为
③若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】已知常温下,AgBr的Ksp=4.9×10﹣13 mol2•L﹣2、AgI的Ksp=8.3×10﹣17mol2•L﹣2。
(1)现向含有AgI的饱和溶液中:
①加入AgNO3固体,则c(I﹣)_______ (填“变大”“变小”或“不变”,下同)。
②若改加更多的AgI固体,则c(Ag+)_______ 。
③若改加AgBr固体,则c(I﹣)_______ ,c(Ag+)_______ 。
(2)现向含有NaBr、KI均为0.002mol•L﹣1的溶液中加入等体积、浓度为4×10﹣3mol•L﹣1的AgNO3溶液,则产生的沉淀是_______ (填化学式);若向其中再加入适量的NaI固体,则可发生沉淀转化的总反应的离子方程式为_______ 。
(1)现向含有AgI的饱和溶液中:
①加入AgNO3固体,则c(I﹣)
②若改加更多的AgI固体,则c(Ag+)
③若改加AgBr固体,则c(I﹣)
(2)现向含有NaBr、KI均为0.002mol•L﹣1的溶液中加入等体积、浓度为4×10﹣3mol•L﹣1的AgNO3溶液,则产生的沉淀是
您最近一年使用:0次
【推荐2】已知难溶电解质在水溶液中存在溶解平衡MmAn(s) mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。
mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料(25℃):
他们的实验步骤如下:
①往100mL0.1mol·L-1的CaCl2溶液中加入0.1mol·L-1的Na2SO4溶液100mL立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO33g,搅拌,静置后弃去上层清液。
③再加入蒸馏水搅拌,静置后再弃去上层清液。
④___________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越__ (填“大”或“小”)。
(2)写出第②步发生反应的化学方程式__ 。
(3)设计第③步的目的是什么__ 。
(4)请补充第④步操作及发生的现象__ 。
(5)请写出该转化在实际生活、生产中的一个应用__ 。
 mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。
mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料(25℃):
| 难浴电解质 | CaCO3 | CaSO4 | MgCO3 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 9.1×10-6 | 6.8×10-6 | 1.8×10-11 |
他们的实验步骤如下:
①往100mL0.1mol·L-1的CaCl2溶液中加入0.1mol·L-1的Na2SO4溶液100mL立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO33g,搅拌,静置后弃去上层清液。
③再加入蒸馏水搅拌,静置后再弃去上层清液。
④___________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越
(2)写出第②步发生反应的化学方程式
(3)设计第③步的目的是什么
(4)请补充第④步操作及发生的现象
(5)请写出该转化在实际生活、生产中的一个应用
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)常温下,0.1 mol/L的醋酸溶液加水稀释后,下列说法正确的是_____ 。
A. 溶液中导电粒子的数目减少
B. 醋酸的电离程度增大,c(H+)亦增大
C. 溶液中 不变
不变
(2)常温下若溶液由pH=3的HCl溶液V1 mL与pH=11的NaOH溶液V2 mL混合使pH等于7,则V1_____ V2(填>、<或 =)。溶液中离子浓度大小顺序为_____ 。
(3)常温下,浓度均为0.1 mol/L的下列五种溶液的pH如表所示:
①根据表中数据,浓度均为0.01 mol/L的下列四种酸的溶液pH最小的是_____
A HCN B HClO C H2CO3 D CH3COOH
②根据以上数据,判断下列反应可以成立的是________
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(4)几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,(填离子符号)_____ 先沉淀。
A. 溶液中导电粒子的数目减少
B. 醋酸的电离程度增大,c(H+)亦增大
C. 溶液中
 不变
不变 (2)常温下若溶液由pH=3的HCl溶液V1 mL与pH=11的NaOH溶液V2 mL混合使pH等于7,则V1
(3)常温下,浓度均为0.1 mol/L的下列五种溶液的pH如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,浓度均为0.01 mol/L的下列四种酸的溶液pH最小的是
A HCN B HClO C H2CO3 D CH3COOH
②根据以上数据,判断下列反应可以成立的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(4)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,(填离子符号)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:

已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图

(1)向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、Al3+完全沉淀,则pH的范围为___________ 。(保留到小数点后一位。已知:完全沉淀后离子浓度低于1×10-5mol·L-1)
(2)常温下,已知Ksp[Mg(OH)2]=3.2×10-11,Ksp[Fe(OH)3]=2.7×10-39,若将足量的Mg(OH)2和Fe(OH)3分别投入水中均得到其相应的悬浊液,所得溶液中金属阳离子的浓度分别为_______ mol·L-1、______ mol·L-1。

已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图

(1)向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、Al3+完全沉淀,则pH的范围为
(2)常温下,已知Ksp[Mg(OH)2]=3.2×10-11,Ksp[Fe(OH)3]=2.7×10-39,若将足量的Mg(OH)2和Fe(OH)3分别投入水中均得到其相应的悬浊液,所得溶液中金属阳离子的浓度分别为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr-Fe-Al-Mg的深度利用和Na+内循环。工艺流程如图:

回答下列问题:
工序④溶液中的铝元素恰好完全转化为沉淀的pH为_______ 。(通常认为溶液中离子浓度小于10-5mol•L-1为沉淀完全;A1(OH)3+OH- Al(OH)
Al(OH) :K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
:K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)

回答下列问题:
工序④溶液中的铝元素恰好完全转化为沉淀的pH为
 Al(OH)
Al(OH) :K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
:K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
您最近一年使用:0次




