醋酸溶液中存在电离平衡 CH3COOH H++ CH3COO-,下列叙述不正确的是( )
H++ CH3COO-,下列叙述不正确的是( )
 H++ CH3COO-,下列叙述不正确的是( )
H++ CH3COO-,下列叙述不正确的是( )| A.升高温度,平衡正向移动,醋酸的电离常数 Ka 值增大 |
| B.0.10 mol·L-1 的 CH3 COOH 溶液中加水稀释,溶液中 c(H+)减小 |
| C.CH3COOH 溶液中加少量的 CH3COONa 固体,平衡逆向移动 |
| D.25℃时,欲使醋酸的电离常数 Ka 和电离程度都减小,可加入少量冰醋酸 |
更新时间:2020-11-12 17:46:34
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】用水稀释0.1mol·L1 氨水时,溶液中随着水量的增加而增大的是
A.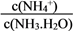 | B.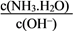 | C.c(H+)×c(OH-) | D.c(OH-) |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】已知:常温下,一元弱碱BOH的电离平衡常数Kb=1.0×10−9。在100mL0.1 mol∙L−1BOH溶液中加入等体积的水稀释,下列叙述正确的是
| A.稀释前,溶液的pH≈9 |
B.稀释后,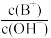 变大 变大 |
| C.稀释后BOH的电离度增大,溶液的pH也增大 |
| D.稀释前后溶液中均存在c(BOH)>c(B+)>c(OH-) |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐3】室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法错误的是( )
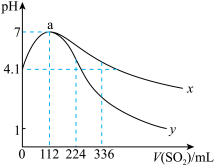

| A.a点水的电离程度最大 |
| B.该温度下H2S的Ka1≈10-7.2 |
| C.曲线y代表继续通入SO2气体后溶液pH的变化 |
D.a点之后,随SO2气体的通入, 的值始终减小 的值始终减小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】醋酸溶液中存在电离平衡 CH3COOH CH3COO- + H+,下列叙述不正确的是
CH3COO- + H+,下列叙述不正确的是
 CH3COO- + H+,下列叙述不正确的是
CH3COO- + H+,下列叙述不正确的是| A.升高温度,平衡正向移动,醋酸的电离常数Ka增大 |
| B.CH3COOH溶液加少量的CH3COONa固体,平衡逆向移动 |
| C.室温下,欲使0.1 mol/L醋酸溶液的电离度α增大,可加入少量冰醋酸 |
| D.0.10 mol/L的CH3COOH 溶液加水稀释,溶液中c(CH3COOH)/c(CH3COO-)减小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】室温下,往0.1 mol·L-1的氨水中滴入酚酞溶液时,溶液将呈现粉红色。现采取下列措施,溶液红色会变深的是
| A.往溶液中滴入稀硫酸 | B.往溶液中加入NH4Cl晶体 |
| C.把溶液加热至沸腾 | D.往溶液中加入NaOH固体 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】25℃时,下列有关电解质溶液的说法正确的是( )
A.加水稀释0.1mol/L氨水,溶液中c(H+)·c(OH-)和 均不变 均不变 |
| B.配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸 |
C.向盐酸中滴加氨水至溶液呈中性,所得溶液中c(NH )=c(Cl-) )=c(Cl-) |
| D.向CH3COOH溶液中加入少量CH3COONa固体,溶液的pH降低 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】一定温度下,已知0.1 mol/L的氨水溶液中存在电离平衡:NH3·H2O NH
NH +OH-,对于该平衡,下列叙述正确的是
+OH-,对于该平衡,下列叙述正确的是
 NH
NH +OH-,对于该平衡,下列叙述正确的是
+OH-,对于该平衡,下列叙述正确的是| A.加入水时,平衡向逆反应方向移动 |
| B.对氨水溶液加强热,平衡向正反应方向移动 |
| C.0.1 mol/L的氨水溶液的pH小于1 mol/L的氨水溶液的pH |
| D.加入少量NH4Cl固体,平衡向正反应方向移动 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】将HF溶液加水稀释后,下列说法中不正确的是
| A.HF的电离程度增大 | B.溶液的pH值增大 |
| C.c(OH-)增大 | D.HF的电离常数增大 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】在已达到电离平衡的0.1 mol/L的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是( )
| A.加少量盐酸 |
| B.加热 |
| C.加少量醋酸钠晶体 |
| D.加少量NaOH晶体 |
您最近一年使用:0次

 )增大
)增大 增大
增大 溶液中
溶液中 减小,
减小,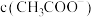 增大的是
增大的是



