25 ℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO 的酸性由强到弱的顺序为_____ 。
(2)同浓度的 CH3COO-、HCO 、CO
、CO 、ClO-结合 H+的能力由强到弱的顺序为
、ClO-结合 H+的能力由强到弱的顺序为_____ 。
(3)将少量 CO2 气体通入 NaClO 溶液中,写出反应的离子方程式:_____ 。
(4)常温下 0.1 mol·L-1 的 CH3COOH 溶液在加水稀释过程中,填写下列表达式中的数据 变化情况(填“变大”“变小”或“不变”)。
①
_____________________________________
②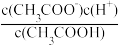
_____________________________________
③
_____________________________________
| 化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO 的酸性由强到弱的顺序为
(2)同浓度的 CH3COO-、HCO
 、CO
、CO 、ClO-结合 H+的能力由强到弱的顺序为
、ClO-结合 H+的能力由强到弱的顺序为(3)将少量 CO2 气体通入 NaClO 溶液中,写出反应的离子方程式:
(4)常温下 0.1 mol·L-1 的 CH3COOH 溶液在加水稀释过程中,填写下列表达式中的数据 变化情况(填“变大”“变小”或“不变”)。
①

②
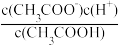
③

更新时间:2020-11-20 21:53:35
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】Ⅰ.已知常温下几种酸的电离常数(见表格),完成下列问题:
(1)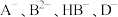 四种离子结合H+的能力最强的是
四种离子结合H+的能力最强的是___________ 。
(2)NaD溶液中加入少量H2B,反应的离子方程式为___________ 。
(3)在某体系中,H+与A-离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中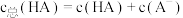 ,当达到平衡时,
,当达到平衡时,

①溶液Ⅱ中 为
为___________ 。
②溶液Ⅰ中HA的电离度[ ]
]___________ (用分数表示)。
③溶液Ⅰ和Ⅱ中的c(A-)之比约为___________ 。
Ⅱ.K2Cr2O7溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)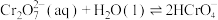
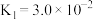 (25℃)
(25℃)
(ⅱ)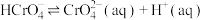
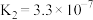 (25℃)
(25℃)
(4) 的平衡常数为
的平衡常数为___________ (用K1和K2表示)。
(5)下列有关K2Cr2O7溶液的说法正确的有___________
(6)25℃时,0.1 mol/LK2Cr2O7溶液中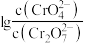 随pH的变化关系如图。当pH=9.00时,设
随pH的变化关系如图。当pH=9.00时,设 、
、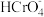 与
与 的平衡浓度分别为a、b、c mol/L,则a、b、c间的关系式为
的平衡浓度分别为a、b、c mol/L,则a、b、c间的关系式为___________ =0.20 mol/L;计算溶液中 的平衡浓度
的平衡浓度___________ (结果保留两位有效数字)。

| HA |  | HD |
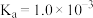 | 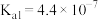 、 、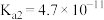 | 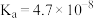 |
(1)
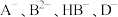 四种离子结合H+的能力最强的是
四种离子结合H+的能力最强的是(2)NaD溶液中加入少量H2B,反应的离子方程式为
(3)在某体系中,H+与A-离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中
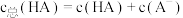 ,当达到平衡时,
,当达到平衡时, 
①溶液Ⅱ中
 为
为②溶液Ⅰ中HA的电离度[
 ]
]③溶液Ⅰ和Ⅱ中的c(A-)之比约为
Ⅱ.K2Cr2O7溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)
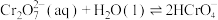
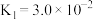 (25℃)
(25℃)(ⅱ)
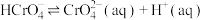
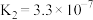 (25℃)
(25℃)(4)
 的平衡常数为
的平衡常数为(5)下列有关K2Cr2O7溶液的说法正确的有___________
| A.加入少量硫酸,溶液的黄色加深,pH不变 |
| B.加入少量水稀释,ⅰ和ⅱ均正向移动,溶液中离子总数增加 |
| C.加入少量NaOH溶液,反应(i)的平衡正向移动 |
D.加入少量K2Cr2O7固体,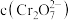 增大,平衡时 增大,平衡时 与 与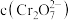 的比值变小 的比值变小 |
(6)25℃时,0.1 mol/LK2Cr2O7溶液中
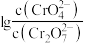 随pH的变化关系如图。当pH=9.00时,设
随pH的变化关系如图。当pH=9.00时,设 、
、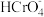 与
与 的平衡浓度分别为a、b、c mol/L,则a、b、c间的关系式为
的平衡浓度分别为a、b、c mol/L,则a、b、c间的关系式为 的平衡浓度
的平衡浓度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氮是空气中含量最多的元素,在自然界中存在十分广泛,在生物体内亦有较大作用,是组成氨基酸的基本元素之一。请回答下列问题。
(1)用CO可将汽车尾气中的NO还原为N2,反应为2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-akJ·mol-1,K=m。已知:N2(g)+O2(g)
N2(g)+2CO2(g) ΔH=-akJ·mol-1,K=m。已知:N2(g)+O2(g) 2NO(g) ΔH1=+bkJ·mol-1,K1=n,则CO(g)+
2NO(g) ΔH1=+bkJ·mol-1,K1=n,则CO(g)+ O2(g)
O2(g) CO2(g) ΔH2=
CO2(g) ΔH2=____ kJ·mol-1(用含a、b的代数式表示),K2=____ (用含m、n的代数式表示)。
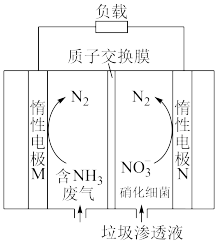
(2)“绿水青山就是金山银山”。现利用如图所示装置对工业废气、垃圾渗透液进行综合治理并实现发电。M极是____ 极,正极的电极反应式为____ 。
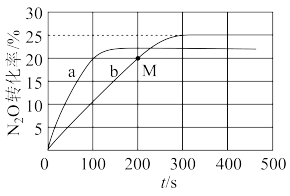
(3)N2O可以被CO还原:N2O(g)+CO(g) N2(g)+CO2(g)。在体积均为1L的恒容密闭容器A(500℃,恒温)、B(起始500℃,绝热)中分别加入0.1molN2O、0.4molCO和相同的催化剂。实验测得A、B中N2O的转化率随时间的变化关系如图所示。A中N2O的转化率随时间的变化关系是图中的b曲线,M点:v正
N2(g)+CO2(g)。在体积均为1L的恒容密闭容器A(500℃,恒温)、B(起始500℃,绝热)中分别加入0.1molN2O、0.4molCO和相同的催化剂。实验测得A、B中N2O的转化率随时间的变化关系如图所示。A中N2O的转化率随时间的变化关系是图中的b曲线,M点:v正____ v逆(填“>”“<”或“=”),A中反应的平衡常数为____ (用分数表示),平衡常数:B____ A(填“大于”“小于”或“等于”)。
(4)实验室中可用NaOH溶液吸收多余的NO2:2NO2+2NaOH=NaNO3+NaNO2+H2O。常温下,用含0.14molNaOH的水溶液吸收NO2,恰好完全反应得1L溶液,测得该溶液的pH=8,则HNO2的电离常数为____ 。
(1)用CO可将汽车尾气中的NO还原为N2,反应为2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH=-akJ·mol-1,K=m。已知:N2(g)+O2(g)
N2(g)+2CO2(g) ΔH=-akJ·mol-1,K=m。已知:N2(g)+O2(g) 2NO(g) ΔH1=+bkJ·mol-1,K1=n,则CO(g)+
2NO(g) ΔH1=+bkJ·mol-1,K1=n,则CO(g)+ O2(g)
O2(g) CO2(g) ΔH2=
CO2(g) ΔH2=(2)“绿水青山就是金山银山”。现利用如图所示装置对工业废气、垃圾渗透液进行综合治理并实现发电。M极是

(3)N2O可以被CO还原:N2O(g)+CO(g)
 N2(g)+CO2(g)。在体积均为1L的恒容密闭容器A(500℃,恒温)、B(起始500℃,绝热)中分别加入0.1molN2O、0.4molCO和相同的催化剂。实验测得A、B中N2O的转化率随时间的变化关系如图所示。A中N2O的转化率随时间的变化关系是图中的b曲线,M点:v正
N2(g)+CO2(g)。在体积均为1L的恒容密闭容器A(500℃,恒温)、B(起始500℃,绝热)中分别加入0.1molN2O、0.4molCO和相同的催化剂。实验测得A、B中N2O的转化率随时间的变化关系如图所示。A中N2O的转化率随时间的变化关系是图中的b曲线,M点:v正
(4)实验室中可用NaOH溶液吸收多余的NO2:2NO2+2NaOH=NaNO3+NaNO2+H2O。常温下,用含0.14molNaOH的水溶液吸收NO2,恰好完全反应得1L溶液,测得该溶液的pH=8,则HNO2的电离常数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】水体中的六价铬[Cr(Ⅵ)]对生态环境和人体健康威胁很大。工业废水中Cr(Ⅵ)常用还原沉淀法、微生物法等进行处理。
(1)“还原沉淀法”常用Na2SO3、FeSO4等处理Cr(Ⅵ)得到Cr(Ⅲ)。已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、 Cr2O 和CrO
和CrO )的物质的量分数随pH的关系如图1所示。
)的物质的量分数随pH的关系如图1所示。
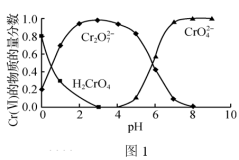
①某含Cr(Ⅵ)废水的pH约为3,写出用Na2SO3处理该废水的离子方程式:_______ [已知pH=3时,Cr(Ⅲ)以Cr3+形式存在]。
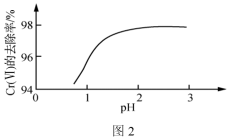
②其他条件相同,用Na2SO3处理不同pH的含Cr(Ⅵ)废水,反应相同时间,Cr(Ⅵ)的去除率与pH的关系如图2所示。已知酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低的原因是_______ 。
(2)“微生物法”处理含Cr(Ⅵ)废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水。
①硫酸盐还原菌能将水中的SO 转化为S2–,S2–与CrO
转化为S2–,S2–与CrO 可反应生成Cr2S3和S两种沉淀。写出S2–与CrO
可反应生成Cr2S3和S两种沉淀。写出S2–与CrO 反应的离子方程式:
反应的离子方程式:_______ 。
②用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在30℃左右,温度过高,Cr(Ⅵ)的去除率低的原因是_______ 。
③硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图3所示。已知溶液中的S2–会完全转化为FeS,则Fe腐蚀后生成FeS和Fe(OH)2的物质的量之比为_______ 。

(1)“还原沉淀法”常用Na2SO3、FeSO4等处理Cr(Ⅵ)得到Cr(Ⅲ)。已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、 Cr2O
 和CrO
和CrO )的物质的量分数随pH的关系如图1所示。
)的物质的量分数随pH的关系如图1所示。
①某含Cr(Ⅵ)废水的pH约为3,写出用Na2SO3处理该废水的离子方程式:
②其他条件相同,用Na2SO3处理不同pH的含Cr(Ⅵ)废水,反应相同时间,Cr(Ⅵ)的去除率与pH的关系如图2所示。已知酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低的原因是

(2)“微生物法”处理含Cr(Ⅵ)废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水。
①硫酸盐还原菌能将水中的SO
 转化为S2–,S2–与CrO
转化为S2–,S2–与CrO 可反应生成Cr2S3和S两种沉淀。写出S2–与CrO
可反应生成Cr2S3和S两种沉淀。写出S2–与CrO 反应的离子方程式:
反应的离子方程式:②用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在30℃左右,温度过高,Cr(Ⅵ)的去除率低的原因是
③硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图3所示。已知溶液中的S2–会完全转化为FeS,则Fe腐蚀后生成FeS和Fe(OH)2的物质的量之比为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】请回答以下问题
(1)某温度时,测得pH=11的Ba(OH)2溶液浓度是0.005mol·L-1。
①该温度下水的离子积常数Kw=________ 。
②在此温度下,将pH=12的Ba(OH)2溶液Va L与pH=2的硫酸Vb L混合。若所得混合液为中性,则Va∶Vb=________ 。
(2)25 ℃时,部分物质的电离平衡常数如下表所示。请回答下列问题:
①下列说法正确的是__________
A.25 ℃时,向CH3COOH溶液中加入适量的NaOH溶液,CH3COOH的电离程度增大,电离平衡常数不变
B.0.1mol•L-1 CH3COOH溶液加水稀释,稀释后的溶液中水的电离程度减小
C.0.1mol•L-1 HClO溶液和0.1mol•L-1 NaClO溶液等体积混合呈溶液碱性
D.碳酸氢钠溶液中阴阳离子数目相等
② 同浓度的CH3COO-、HCO 、CO32-、ClO-结合H+的能力由强到弱的顺序为
、CO32-、ClO-结合H+的能力由强到弱的顺序为___
③ 25 ℃时,某CH3COOH和CH3COOK混合溶液呈中性,则该混合溶液中: =
=________
(3)煤燃烧排放的烟气含有SO2和NO,采用碱性的NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10−3mol·L−1。反应10min后溶液中离子浓度的分析结果如下表。
①写出NaClO2溶液脱硝过程中主要反应 的离子方程式______ 。
②如果采用Ca(ClO)2替代NaClO2,其脱硫效果会更好。试从化学平衡原理分析,Ca(ClO)2相比NaClO2具有的优点是________ 。
(1)某温度时,测得pH=11的Ba(OH)2溶液浓度是0.005mol·L-1。
①该温度下水的离子积常数Kw=
②在此温度下,将pH=12的Ba(OH)2溶液Va L与pH=2的硫酸Vb L混合。若所得混合液为中性,则Va∶Vb=
(2)25 ℃时,部分物质的电离平衡常数如下表所示。请回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10—5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①下列说法正确的是
A.25 ℃时,向CH3COOH溶液中加入适量的NaOH溶液,CH3COOH的电离程度增大,电离平衡常数不变
B.0.1mol•L-1 CH3COOH溶液加水稀释,稀释后的溶液中水的电离程度减小
C.0.1mol•L-1 HClO溶液和0.1mol•L-1 NaClO溶液等体积混合呈溶液碱性
D.碳酸氢钠溶液中阴阳离子数目相等
② 同浓度的CH3COO-、HCO
 、CO32-、ClO-结合H+的能力由强到弱的顺序为
、CO32-、ClO-结合H+的能力由强到弱的顺序为③ 25 ℃时,某CH3COOH和CH3COOK混合溶液呈中性,则该混合溶液中:
 =
=(3)煤燃烧排放的烟气含有SO2和NO,采用碱性的NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10−3mol·L−1。反应10min后溶液中离子浓度的分析结果如下表。
| 离子 | SO42− | SO32− | NO3− | NO2− | Cl− |
| c/(mol·L−1) | 8.35×10−4 | 6.87×10−6 | 1.5×10−4 | 1.2×10−5 | 3.4×10−3 |
①写出NaClO2溶液脱硝过程中
②如果采用Ca(ClO)2替代NaClO2,其脱硫效果会更好。试从化学平衡原理分析,Ca(ClO)2相比NaClO2具有的优点是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】I.完成下列问题
(1)已知在室温的条件下,pH均为5的 溶液和
溶液和 溶液,回答下列问题:各取5mL上述溶液,分别升温至50℃后,pH较小的是
溶液,回答下列问题:各取5mL上述溶液,分别升温至50℃后,pH较小的是_______ 溶液:取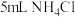 溶液,加水稀释至50mL,
溶液,加水稀释至50mL,
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2) 是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8-10滴
是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8-10滴 ,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。若将
,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。若将 溶液直接蒸干得不到无水
溶液直接蒸干得不到无水 ,用
,用 与
与 混合共热,则可得到无水
混合共热,则可得到无水 ,其原因是
,其原因是_______ 。(用简要的文字回答)
II.25℃时,有浓度均为 的下列4种溶液:
的下列4种溶液:
①NaCN溶液 ②NaOH溶液 ③ 溶液 ④
溶液 ④ 溶液
溶液
(3)这4种溶液pH由大到小的顺序是_______ (填序号)。
(4)向NaCN溶液中通入少量 ,则发生反应的离子方程式为
,则发生反应的离子方程式为_______ 。
(5)测得HCN和NaCN的混合溶液的 ,则
,则 约为
约为_____ (保留1位有效数字)。
(6) 和
和 混合溶液中,若溶液
混合溶液中,若溶液 ,则溶液中
,则溶液中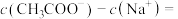
_______  (填精确值)。
(填精确值)。
(1)已知在室温的条件下,pH均为5的
 溶液和
溶液和 溶液,回答下列问题:各取5mL上述溶液,分别升温至50℃后,pH较小的是
溶液,回答下列问题:各取5mL上述溶液,分别升温至50℃后,pH较小的是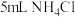 溶液,加水稀释至50mL,
溶液,加水稀释至50mL,
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)
 是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8-10滴
是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8-10滴 ,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。若将
,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。若将 溶液直接蒸干得不到无水
溶液直接蒸干得不到无水 ,用
,用 与
与 混合共热,则可得到无水
混合共热,则可得到无水 ,其原因是
,其原因是II.25℃时,有浓度均为
 的下列4种溶液:
的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③
 溶液 ④
溶液 ④ 溶液
溶液| HCN |  |  |
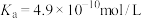 | 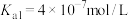 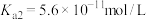 | 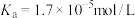 |
(4)向NaCN溶液中通入少量
 ,则发生反应的离子方程式为
,则发生反应的离子方程式为(5)测得HCN和NaCN的混合溶液的
 ,则
,则 约为
约为(6)
 和
和 混合溶液中,若溶液
混合溶液中,若溶液 ,则溶液中
,则溶液中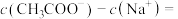
 (填精确值)。
(填精确值)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】已知 Ka、Kb、Kw、Kh、Ksp 分别表示弱酸的电离平衡常数、弱碱的电离平衡常数,水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。 通过查阅资料获得温度为 25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5, Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11已知:Kh 是盐的水解平衡常数,在CH3COONa 溶液中存在CH3COO-+H2O ⇌ CH3COOH+OH-,则 Kh=[c(CH3COOH)c(OH-)]/c(CH3COO-)
(1)有关上述常数的说法正确的是___________ 。
a.它们都能反映一定条件下对应变化进行的程度
b.所有弱电解质的电离常数和难溶电解质的 Ksp 都随温度的升高而增大
c.常温下,CH3COOH 在水中的 Ka 大于在饱和 CH3COONa 溶液中的 Ka
d.一定温度下,在 CH3COONa 溶液中,Kw=Ka·Kh
(2)25℃时,1.0 mol·L-1HF 溶液的pH约等于___________ (已知lg2≈0.3,忽略电离对 c(HF)的影响)。将浓度相等的 HF 与 NaF 溶液等体积混合,判断溶液呈___________ (填“酸”、“碱”或“中”)性,并 结合有关数据解释原因:___________ 。
(3)已知 CH3COONH4 溶液为中性,又知 CH3COOH 溶液加到 Na2CO3 溶液中有气体放出,现有 25℃时等浓度的四种溶液:A.NH4Cl,B.NH4SCN,C.CH3COONH4,D.NH4HCO3。
①试推断 NH4HCO3 溶液的 pH___________ 7(填“>”、“<”或“=”);
②将四种溶液按 NH 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:___________ (填序号)。
(4)为探究 Mg(OH)2 在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+ 2CH3COOH(aq) ⇌ Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在 25℃时的平衡常数 K=___________ ,并据此推断 Mg(OH)2___________ (填“能”或“不能”)溶解于醋酸。(已知 1.83≈5.8)
(1)有关上述常数的说法正确的是
a.它们都能反映一定条件下对应变化进行的程度
b.所有弱电解质的电离常数和难溶电解质的 Ksp 都随温度的升高而增大
c.常温下,CH3COOH 在水中的 Ka 大于在饱和 CH3COONa 溶液中的 Ka
d.一定温度下,在 CH3COONa 溶液中,Kw=Ka·Kh
(2)25℃时,1.0 mol·L-1HF 溶液的pH约等于
(3)已知 CH3COONH4 溶液为中性,又知 CH3COOH 溶液加到 Na2CO3 溶液中有气体放出,现有 25℃时等浓度的四种溶液:A.NH4Cl,B.NH4SCN,C.CH3COONH4,D.NH4HCO3。
①试推断 NH4HCO3 溶液的 pH
②将四种溶液按 NH
 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:(4)为探究 Mg(OH)2 在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+ 2CH3COOH(aq) ⇌ Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在 25℃时的平衡常数 K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】下表是几种弱电解质的电离平衡常数(25℃)
回答下列问题:
(1)由上表分析,若①CH3COOH② ③HA④
③HA④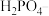 均可看作酸,则它们酸性由强到弱的顺序为
均可看作酸,则它们酸性由强到弱的顺序为___________ (填序号)。
(2)试写出H2CO3与NH3·H2O等物质的量混合所得盐的电离方程式:___________ ;试写出HA与Na3PO4反应的离子方程式:_______ 。
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中: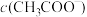
___________ 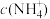 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(4)25℃时,向10mL0.01mol/LHA溶液中滴加VmL0.01mol/L氨水,混合溶液中粒子浓度关系正确的是_____。
(5)已知BaSO4的溶解度随温度升高而增大。如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
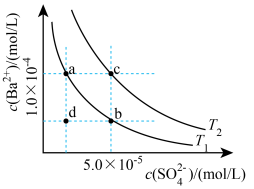
①T1_______ T2(填>、=、<)。
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法错误的是_______ 。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
| 电解质 | 电离方程式 | 平衡常数K |
 |  | 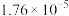 |
 |   | 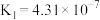 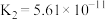 |
 |  | 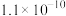 |
 | 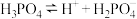   |   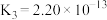 |
 | 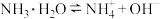 | 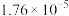 |
(1)由上表分析,若①CH3COOH②
 ③HA④
③HA④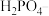 均可看作酸,则它们酸性由强到弱的顺序为
均可看作酸,则它们酸性由强到弱的顺序为(2)试写出H2CO3与NH3·H2O等物质的量混合所得盐的电离方程式:
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:
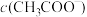
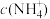 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(4)25℃时,向10mL0.01mol/LHA溶液中滴加VmL0.01mol/L氨水,混合溶液中粒子浓度关系正确的是_____。
| A.若混合液pH>7,则V≥10 |
B.若混合液pH<7,则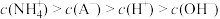 |
| C.V=10时,混合液中水电离程度大于10mL0.01mol/LHA溶液中水的电离程度 |
D.V=5时, |
(5)已知BaSO4的溶解度随温度升高而增大。如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

①T1
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法错误的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】次鳞酸 )是一种精细化工产品。
)是一种精细化工产品。
(1) 溶液中的含鳞微粒只有
溶液中的含鳞微粒只有 和
和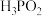 ,则该溶液量
,则该溶液量_______ 性(填“酸”“碱”或“中”),原因是_______ (用离子方程式解释); 为
为_______ (填“正盐”或“酸式盐”),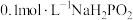 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为_______ 。
(2) 时,将相同物质的量浓度的
时,将相同物质的量浓度的 溶液和盐酸分别加水稀释至相同的倍数,此时
溶液和盐酸分别加水稀释至相同的倍数,此时 溶液的
溶液的
_______ (填“大于”“小于”或“等于”)盐酸的 。
。
(3)常温下, 溶液中
溶液中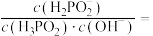
_______ [用含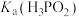 和
和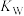 的代数式表示]。
的代数式表示]。
 )是一种精细化工产品。
)是一种精细化工产品。(1)
 溶液中的含鳞微粒只有
溶液中的含鳞微粒只有 和
和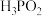 ,则该溶液量
,则该溶液量 为
为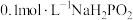 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为(2)
 时,将相同物质的量浓度的
时,将相同物质的量浓度的 溶液和盐酸分别加水稀释至相同的倍数,此时
溶液和盐酸分别加水稀释至相同的倍数,此时 溶液的
溶液的
 。
。(3)常温下,
 溶液中
溶液中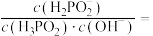
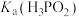 和
和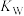 的代数式表示]。
的代数式表示]。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
①常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是____ 。
②将过量H2S通入Na2CO3溶液,反应的离子方程式是____ 。
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X) 随pH的变化如图所示。则H2A的电离平衡常数K2=____ 。

(3)常温下,用0.100mol·L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图2所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH ) +c(NH3·H2O)+c(NH3)(忽略溶液体积的变化)。
) +c(NH3·H2O)+c(NH3)(忽略溶液体积的变化)。

①该氨水物质的量浓度为____ 。
②a、b、c、d四个点,水的电离程度最大的是____ 。
③b点所示的溶液中c(NH3·H2O)____ c(Cl-)(填“大于”“等于”或“小于”)
④若所得溶液中的c(NH )>c(OH—),则下列说法正确的是
)>c(OH—),则下列说法正确的是____ ;
A.溶液一定呈酸性 B.溶液一定呈碱性
C.溶液一定呈中性 D.溶液可能呈酸性、中性或碱性
(1)已知部分弱酸的电离常数如下表:
化学式 | HF | H2CO3 | H2S |
电离平衡常数K (25℃) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是
②将过量H2S通入Na2CO3溶液,反应的离子方程式是
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X) 随pH的变化如图所示。则H2A的电离平衡常数K2=

(3)常温下,用0.100mol·L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图2所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH
 ) +c(NH3·H2O)+c(NH3)(忽略溶液体积的变化)。
) +c(NH3·H2O)+c(NH3)(忽略溶液体积的变化)。
①该氨水物质的量浓度为
②a、b、c、d四个点,水的电离程度最大的是
③b点所示的溶液中c(NH3·H2O)
④若所得溶液中的c(NH
 )>c(OH—),则下列说法正确的是
)>c(OH—),则下列说法正确的是A.溶液一定呈酸性 B.溶液一定呈碱性
C.溶液一定呈中性 D.溶液可能呈酸性、中性或碱性
您最近一年使用:0次



