常温下,向100 mL 0.1 mol·L-1 H2A溶液中滴加0.1 mol·L-1 NaOH溶液,测得混合溶液中pc(H2A)、pc(HA-)、pc(A2-)随pH的变化曲线如图所示[已知:X代表H2A、HA-、A2-,pc(X)=-lgc(X)]。下列说法正确的是


| A.曲线III代表pc(H2A)与溶液pH的变化关系 |
| B.H2A的电离常数Ka1=1×10-5 |
| C.水的电离程度:c>b>a |
| D.b点对应的溶液中,c(H2A)+c(HA-)+c(A2-)=0.1 mol·L-1 |
更新时间:2021-01-06 17:02:18
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】电位滴定法是根据滴定过程中电极电位变化来判断滴定终点的一种滴定分析方法,滴定终点时电极电位发生突变。常温下,利用盐酸滴定某溶液中磷酸钠的含量,其电位滴定曲线与pH曲线如图所示。下列说法不正确的是
已知:磷酸Ka1=6.9×10-3、Ka2=6.2×10-8、Ka3=4.8×10-13
已知:磷酸Ka1=6.9×10-3、Ka2=6.2×10-8、Ka3=4.8×10-13

| A.a点对应的溶液呈弱碱性 |
| B.水的电离程度:a点小于b点 |
C.b点对应的溶液中存在:c(H+)+c(H3PO4)=c(OH-)+( )+2c( )+2c( ) ) |
D.c点对应的溶液中存在:c(Cl-)>c(H3PO4)>c(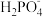 )>c( )>c( ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,Ka(HCOOH)=1.77×10−4,Ka(CH3COOH)=1.75×10−5,Kb(NH3·H2O) =1.76×10−5,下列说法正确的是
| A.浓度均为0.1 mol·L−1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者 |
| B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 |
| C.0.2 mol·L−1 HCOOH与0.1 mol·L−1 NaOH 等体积混合后的溶液中:c(HCOO−) + c(OH−) = c(HCOOH) + c(H+) |
| D.0.2 mol·L−1 CH3COONa 与 0.1 mol·L−1盐酸等体积混合后的溶液中(pH<7):c(Cl− ) > c(CH3COO−) > c(CH3COOH) > c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下)。其中正确的是
①pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位
②1 L 0.50 mol·L-1 NH4Cl 溶液与2 L 0.25 mol·L-1 NH4Cl 溶液含NH4+ 物质的量前者大
③pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
④pH=4、浓度均为0.1mol·L-1 的CH3COOH、CH3COONa混合溶液中:
c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10) mol/L
①pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位
②1 L 0.50 mol·L-1 NH4Cl 溶液与2 L 0.25 mol·L-1 NH4Cl 溶液含NH4+ 物质的量前者大
③pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
④pH=4、浓度均为0.1mol·L-1 的CH3COOH、CH3COONa混合溶液中:
c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10) mol/L
| A.①② | B.②③ | C.①③ | D.②④ |
您最近一年使用:0次



