乙炔可用于照明、焊接及切割金属,也是制备乙醛、醋酸、苯、合成橡胶、合成纤维等的基本原料。甲烷催化裂解是工业上制备乙炔的方法之一、回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-885kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H2=-2600kJ/mol
2H2(g)+O2(g)=2H2O(l)△H3=-572kJ/mol
则2CH4(g)=C2H2(g)+3H2(g)△H=_______ kJ/mol
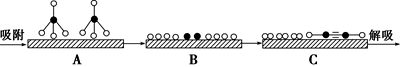
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用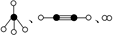 和
和 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最高的是
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最高的是_____ (填标号),其理由是_____
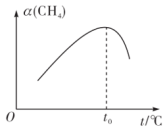
②在恒容密闭容器中充入amol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(to℃)的关系如图所示,to℃后CH4的转化率突减的原因可能是_______
(3)甲烷分解体系中几种气体的平衡分压(p/Pa)与温度(t/℃)的关系如图所示。
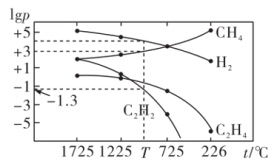
①在某温度下,向VL恒容密闭容器中充入0.12molCH4,只发生反应2CH4(g)⇌C2H4(g)+2H2(g),达到平衡时,测得p(H2)=p(CH4)。CH4的平衡转化率为_______ (结果保留两位有效数字)。
②在图3中,T℃时,化学反应2CH4(g)⇌C2H2(g)+3H2(g)的压强平衡常数Kp=_______ Pa2。
(4)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g) +3H2O(g)⇌CO(g)+3H2(g) ∆H=+203kJ·mol-1
①该反应的逆反应速率表达式为;v逆=k·c(CO)·c3(H2),k为速率常数,在某温度下,测得实验数据如表:
由上述数据可得该温度下,上述反应的逆反应速率常数k为_______ L3·mol-3·min-1。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-885kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H2=-2600kJ/mol
2H2(g)+O2(g)=2H2O(l)△H3=-572kJ/mol
则2CH4(g)=C2H2(g)+3H2(g)△H=
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用
 和
和 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最高的是
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最高的是
②在恒容密闭容器中充入amol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(to℃)的关系如图所示,to℃后CH4的转化率突减的原因可能是

(3)甲烷分解体系中几种气体的平衡分压(p/Pa)与温度(t/℃)的关系如图所示。

①在某温度下,向VL恒容密闭容器中充入0.12molCH4,只发生反应2CH4(g)⇌C2H4(g)+2H2(g),达到平衡时,测得p(H2)=p(CH4)。CH4的平衡转化率为
②在图3中,T℃时,化学反应2CH4(g)⇌C2H2(g)+3H2(g)的压强平衡常数Kp=
(4)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g) +3H2O(g)⇌CO(g)+3H2(g) ∆H=+203kJ·mol-1
①该反应的逆反应速率表达式为;v逆=k·c(CO)·c3(H2),k为速率常数,在某温度下,测得实验数据如表:
c(CO)(mol·L-1) | c(H2)(mol·L-1) | v逆(mol·L-1·min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,上述反应的逆反应速率常数k为
更新时间:2020-12-30 10:54:12
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
【推荐1】铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2) 为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S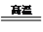 6Cu+SO2↑ 该反应的氧化剂是
6Cu+SO2↑ 该反应的氧化剂是________ ,验证反应产生的气体是SO2的方法是___________ 。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃~60℃的两个原因除了加快反应速率外,还有___________ 。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuC1沉淀,写出生成CuCl的离子方程式______________ 。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:
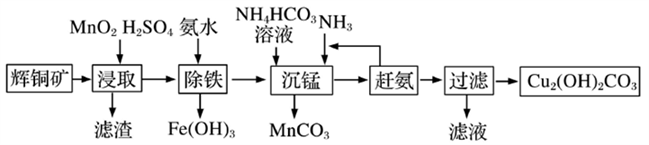
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________ 。
②浸取过程中得到一种单质,写出浸取时主要反应的化学方程式___________ 。
③写出“沉锰”反应时离子方程式___________ 。
④“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________ mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
(1)工业上以黄铜矿(CuFeS2) 为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S
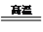 6Cu+SO2↑ 该反应的氧化剂是
6Cu+SO2↑ 该反应的氧化剂是(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃~60℃的两个原因除了加快反应速率外,还有
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:

①辉铜矿在浸取前要富集与粉碎,粉碎的好处是
②浸取过程中得到一种单质,写出浸取时主要反应的化学方程式
③写出“沉锰”反应时离子方程式
④“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
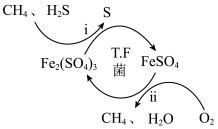
(1)过程i的离子反应方程式为_______________________ 。
(2)已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
在转化脱硫中,请在上表中选择最佳pH范围是_______ <pH<_______ ,这样选择的原因是:____ 。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
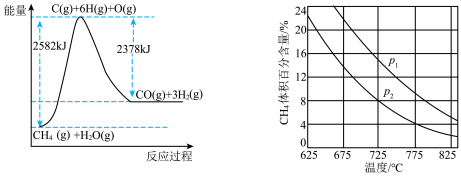
(3)①该过程的热化学方程式是___________ 。
②比较压强P1和p2的大小关系:P1________ P2(选填“>”“<”或“=”)。
③在一定温度和一定压强下的体积可变的密闭容器中充入1mol CH4和1mol的水蒸气充分反应达平衡后,测得起始时混合气的密度是平衡时混合气密度的1.4倍,若此时容器的体积为2L,则该反应的平衡常数为______________ (结果保留2位有效数字)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程如示意图
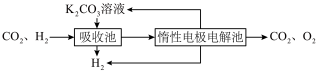
(4)①吸收池中发生反应的离子方程式是______________ 。
②结合电极反应式,简述K2CO3溶液的再生原理:_____ 。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。

(1)过程i的离子反应方程式为
(2)已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
| pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
| Fe2+的氧化速/g·L-1·h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在上表中选择最佳pH范围是
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。

(3)①该过程的热化学方程式是
②比较压强P1和p2的大小关系:P1
③在一定温度和一定压强下的体积可变的密闭容器中充入1mol CH4和1mol的水蒸气充分反应达平衡后,测得起始时混合气的密度是平衡时混合气密度的1.4倍,若此时容器的体积为2L,则该反应的平衡常数为
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程如示意图

(4)①吸收池中发生反应的离子方程式是
②结合电极反应式,简述K2CO3溶液的再生原理:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)目前工业上有一种方法是用CO和H2在230℃,催化剂条件下转化生成甲醇蒸汽和水蒸气。图一表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图。写出该反应的热化学方程式__________________________________________ 。
(2)“亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图二所示。
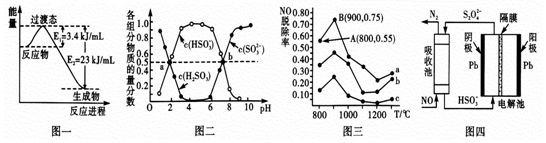
请写出a点时n(HSO3-):n(H2SO3)=_____ ,b点时溶液pH=7,则n(NH4+):n(HSO3-)=_____ 。
(3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO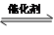 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
① 请写出N2的电子式________ 。
② 曲线c对应NH3与NO的物质的量之比是______ 。
③ 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____ mg/(m3·s)。
(4)间接电化学法可除NO。其原理如图四所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性,加入HSO3-,出来S2O42-):____________________________________ 。
(1)目前工业上有一种方法是用CO和H2在230℃,催化剂条件下转化生成甲醇蒸汽和水蒸气。图一表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图。写出该反应的热化学方程式
(2)“亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图二所示。

请写出a点时n(HSO3-):n(H2SO3)=
(3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO
 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:① 请写出N2的电子式
② 曲线c对应NH3与NO的物质的量之比是
③ 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为
(4)间接电化学法可除NO。其原理如图四所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性,加入HSO3-,出来S2O42-):
您最近一年使用:0次
【推荐1】近两年来,碳中和连续成为两会期间最受关注的议题之一, 的回收和利用对于改善环境,实现绿色发展至关重要。
的回收和利用对于改善环境,实现绿色发展至关重要。
(1) 甲烷化反应最早由化学家PaulSabatier提出。已知:
甲烷化反应最早由化学家PaulSabatier提出。已知:
反应Ⅰ.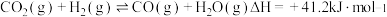
反应Ⅱ.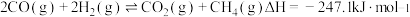
① 的结构式为
的结构式为_______ 。
② 甲烷化反应是
甲烷化反应是_______ (填“吸热”或“放热”)反应。
③反应Ⅰ的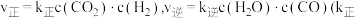 和
和 为速率常数,与温度、催化剂有关)。若平衡后升高温度,则
为速率常数,与温度、催化剂有关)。若平衡后升高温度,则
_______ (填“增大”、“不变”或“减小”)。
(2)一定条件下, 与
与 反应可合成乙烯:
反应可合成乙烯: 。该反应分两步进行:
。该反应分两步进行:
ⅰ.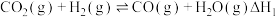
ⅱ.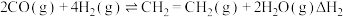
 ,压强恒定为
,压强恒定为 时,将
时,将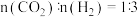 的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示。
的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示。
 的平衡转化率为
的平衡转化率为_______ ,反应ⅰ的平衡常数
_______ ( 是以分压表示的平衡常数,分压
是以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。
(3)一种以 和甲醇为原料,利用
和甲醇为原料,利用 和
和 纳米片
纳米片 作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。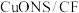 为
为_______ 极,电解过程中阴极的电极反应式为_______ 。
②设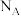 为阿伏加德罗常数的值,当电路中转移
为阿伏加德罗常数的值,当电路中转移 电子时,装置中生成
电子时,装置中生成 和
和 的数目共为
的数目共为_______ 。
 的回收和利用对于改善环境,实现绿色发展至关重要。
的回收和利用对于改善环境,实现绿色发展至关重要。(1)
 甲烷化反应最早由化学家PaulSabatier提出。已知:
甲烷化反应最早由化学家PaulSabatier提出。已知:反应Ⅰ.
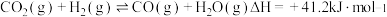
反应Ⅱ.
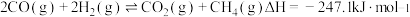
①
 的结构式为
的结构式为②
 甲烷化反应是
甲烷化反应是③反应Ⅰ的
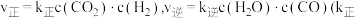 和
和 为速率常数,与温度、催化剂有关)。若平衡后升高温度,则
为速率常数,与温度、催化剂有关)。若平衡后升高温度,则
(2)一定条件下,
 与
与 反应可合成乙烯:
反应可合成乙烯: 。该反应分两步进行:
。该反应分两步进行:ⅰ.
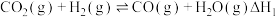
ⅱ.
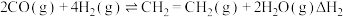
 ,压强恒定为
,压强恒定为 时,将
时,将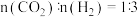 的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示。
的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示。| 组分 |  |  |  |
物质的量分数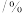 | 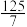 | 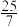 | 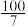 |
 的平衡转化率为
的平衡转化率为
 是以分压表示的平衡常数,分压
是以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。(3)一种以
 和甲醇为原料,利用
和甲醇为原料,利用 和
和 纳米片
纳米片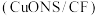 作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。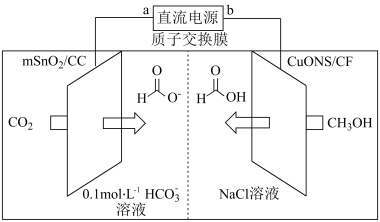
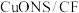 为
为②设
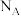 为阿伏加德罗常数的值,当电路中转移
为阿伏加德罗常数的值,当电路中转移 电子时,装置中生成
电子时,装置中生成 和
和 的数目共为
的数目共为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)。
已知①常压下反应的能量变化如图所示。
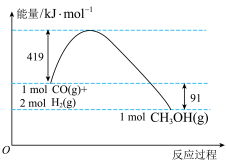
②CO(g)+1/2O2(g)=CO2(g)ΔH=-280 kJ/mol;
H2(g)+1/2O2(g)=H2O(l) ΔH=-284 kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式___________________ 。
(2)在____ (填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
(3)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如图所示。
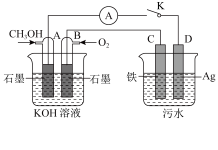
①写出甲池的A极电极反应式:__________________________ 。
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的_______ 。
A.H2SO4 B.BaSO4 C.Na2SO4 D.NaOH E.CH3CH2OH
(4)图是甲醇燃料电池工作的示意图,其中A.B.D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A.B两极上产生的气体体积相同。
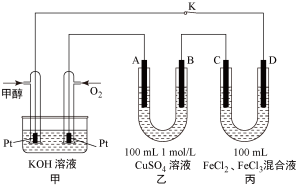
①乙中A极析出的气体在标准状况下的体积为________ 。
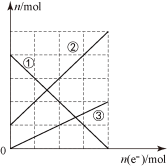
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则图中②线表示的是________ 离子的变化。
已知①常压下反应的能量变化如图所示。

②CO(g)+1/2O2(g)=CO2(g)ΔH=-280 kJ/mol;
H2(g)+1/2O2(g)=H2O(l) ΔH=-284 kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式
(2)在
(3)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如图所示。

甲 乙
①写出甲池的A极电极反应式:
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的
A.H2SO4 B.BaSO4 C.Na2SO4 D.NaOH E.CH3CH2OH
(4)图是甲醇燃料电池工作的示意图,其中A.B.D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A.B两极上产生的气体体积相同。

①乙中A极析出的气体在标准状况下的体积为
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则图中②线表示的是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】关于水煤气变换反应CO(g)+H2O(g)⇌CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
①H2O+*⇌H2O*②H2O*+*⇌OH*+H*③OH*+*⇌O*+H*④2H*+*⇌H2+2*⑤CO+*⇌CO*⑥CO*+O*⇌CO2*+*⑦CO2*⇌CO2+*
其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
表1WGS反应中可能基元反应步骤的活化能数值(单位:kJ·mol-1)
注:表中X(111)表示不同金属的同一晶面,110与111表示不同晶面。
(1)分析表中数据,该机理中基元反应的正反应活化能最大的是__ (填序号)。
(2)由表中数据可计算Au(111)催化WGS反应的焓变△H=__ kJ·mol-1。
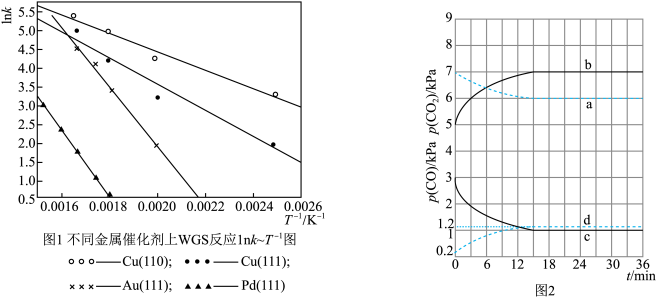
(3)WGS反应的速率表达式:V正=k正·c(CO)·c(H2O),V逆=k逆·c(CO2)·c(H2)(k正、k逆为化学反应速率常数,只与温度有关)。图1是反应速率常数的自然对数与温度倒数的关系图象。由图1可判断550K~600K温度范围内,四种催化剂中活性最差的是___ 。(填选项)
A.Cu(110) B.Cu(111) C.Au(111) D.Pd(111)
(4)已知T1时WGS反应的KP=18。温度分别为T2、T3(已知T1>T2>T3)时WGS反应中CO和CO2分压随时间变化关系如图2所示,催化剂为Au(111),实验初始时体系中的p(CO)和p(H2O)相等,p(CO2)和p(H2)相等。则T2时,表示p(CO2)的曲线是__ ;T3时WGS反应的KP为__ 。
①H2O+*⇌H2O*②H2O*+*⇌OH*+H*③OH*+*⇌O*+H*④2H*+*⇌H2+2*⑤CO+*⇌CO*⑥CO*+O*⇌CO2*+*⑦CO2*⇌CO2+*
其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
表1WGS反应中可能基元反应步骤的活化能数值(单位:kJ·mol-1)
| 基元反应 | 正反应(Ef) | 逆反应(Et) | ||||||
| Cu(110) | Cu(111) | Pd(111) | Au(111) | Cu(110) | Cu(111) | Pd(111) | Au(111) | |
| ① | 0 | 0 | 0 | 0 | 58 | 58 | 42 | 67 |
| ② | 96 | 109 | 108 | 150 | 24 | 8 | 0 | 0 |
| ③ | 58 | 67 | 63 | 71 | 96 | 88 | 92 | 67 |
| ④ | 80 | 63 | 92 | 74 | 21 | 29 | 8 | 25 |
| ⑤ | 0 | 0 | 0 | 0 | 50 | 50 | 142 | 42 |
| ⑥ | 45 | 46 | 100 | 37 | 96 | 117 | 142 | 203 |
| ⑦ | 21 | 21 | 17 | 17 | 0 | 0 | 0 | 0 |
(1)分析表中数据,该机理中基元反应的正反应活化能最大的是
(2)由表中数据可计算Au(111)催化WGS反应的焓变△H=

(3)WGS反应的速率表达式:V正=k正·c(CO)·c(H2O),V逆=k逆·c(CO2)·c(H2)(k正、k逆为化学反应速率常数,只与温度有关)。图1是反应速率常数的自然对数与温度倒数的关系图象。由图1可判断550K~600K温度范围内,四种催化剂中活性最差的是
A.Cu(110) B.Cu(111) C.Au(111) D.Pd(111)
(4)已知T1时WGS反应的KP=18。温度分别为T2、T3(已知T1>T2>T3)时WGS反应中CO和CO2分压随时间变化关系如图2所示,催化剂为Au(111),实验初始时体系中的p(CO)和p(H2O)相等,p(CO2)和p(H2)相等。则T2时,表示p(CO2)的曲线是
您最近一年使用:0次
【推荐1】研究氮氧化物转化的机理,对环境保护具有重要意义。回答下列问题:
(1) 还原处理N2O的原理为
还原处理N2O的原理为
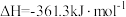 。
。
已知在Fe+催化作用下,该反应分两步进行:
I.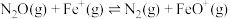
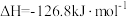 ;
;
Ⅱ. ……。
写出Ⅱ的热化学方程式_______ 。
(2)处理汽车尾气的原理为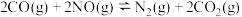
 。将体积比为
。将体积比为 的NO和
的NO和 混合气体以相同流速通过两种不同的催化剂I、Ⅱ,发生上述反应,相同时间内尾气脱氮率(即NO转化率)如图1所示。
混合气体以相同流速通过两种不同的催化剂I、Ⅱ,发生上述反应,相同时间内尾气脱氮率(即NO转化率)如图1所示。
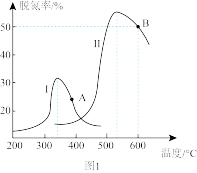
①A点_______ (填“是”或“不是”)对应温度下的平衡脱氮率,原因是_______ 。
②若B点时反应已达平衡,体系压强为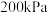 ,则该温度下
,则该温度下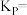
_______  。
。
(3)以铁为还原剂,Cu、Pd为催化剂去除水体中硝态氮的过程如图2所示。
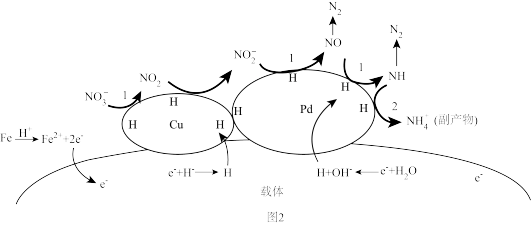
①总反应的离子方程式为_______ 。
②为减少副产物 的产生可采取的措施是
的产生可采取的措施是_______ 。
③下列关于Cu、Pd催化剂的说法正确的是_______ (填标号)。
a.Cu、Pd可加快反应中电子的转移 b.Cu、Pd吸附作用可促进活性H的产生
c.Cu、Pd直接参与该反应 d.吸附 的能力Cu大于Pd
的能力Cu大于Pd
(1)
 还原处理N2O的原理为
还原处理N2O的原理为
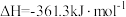 。
。已知在Fe+催化作用下,该反应分两步进行:
I.
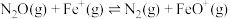
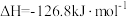 ;
;Ⅱ. ……。
写出Ⅱ的热化学方程式
(2)处理汽车尾气的原理为
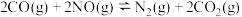
 。将体积比为
。将体积比为 的NO和
的NO和 混合气体以相同流速通过两种不同的催化剂I、Ⅱ,发生上述反应,相同时间内尾气脱氮率(即NO转化率)如图1所示。
混合气体以相同流速通过两种不同的催化剂I、Ⅱ,发生上述反应,相同时间内尾气脱氮率(即NO转化率)如图1所示。
①A点
②若B点时反应已达平衡,体系压强为
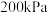 ,则该温度下
,则该温度下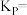
 。
。(3)以铁为还原剂,Cu、Pd为催化剂去除水体中硝态氮的过程如图2所示。

①总反应的离子方程式为
②为减少副产物
 的产生可采取的措施是
的产生可采取的措施是③下列关于Cu、Pd催化剂的说法正确的是
a.Cu、Pd可加快反应中电子的转移 b.Cu、Pd吸附作用可促进活性H的产生
c.Cu、Pd直接参与该反应 d.吸附
 的能力Cu大于Pd
的能力Cu大于Pd
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】二氧化氯(ClO2)具有强氧化性,是优良的饮用水消毒剂。ClO2常温下为黄绿色气体,熔点-59℃,沸点11℃,极易溶于水且不与水反应,浓的ClO2受热时易爆炸。我国广泛使用的方法是用干燥的Cl2与NaClO2固体反应制取ClO2,实验室模拟制备ClO2装置如图所示:
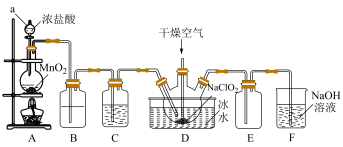
(1)仪器a的名称是:___________ ,装置A中反应的离子方程式为:___________ 。
(2)装置B中盛装的试剂是___________ ,装置C中试剂的作用是:___________ 。
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②___________ 。
(4)装置E为ClO2的收集装置,应将其置于___________ 水浴中(填“热”或“冰”)。
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:___________ 。
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若___________ (填“实验现象”),则假设1成立。

(1)仪器a的名称是:
(2)装置B中盛装的试剂是
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②
(4)装置E为ClO2的收集装置,应将其置于
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以纯铜屑为原料制取的流程如下:
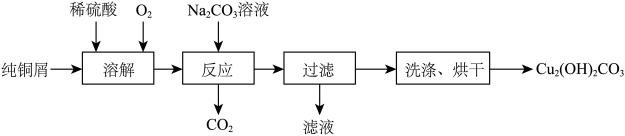
(1)“溶解”步骤反应的离子方程式为_______ .温度宜控制在50℃左右,若高于50℃,溶液中O2溶解量减少、Cu的转化率降低,若低于50℃ ,_____
(2)“反应”步骤生成Cu2(OH)2CO3的化学方程式为_________ 。反应后溶液中铜元素残留量受pH和反应时间的影响如图所示:
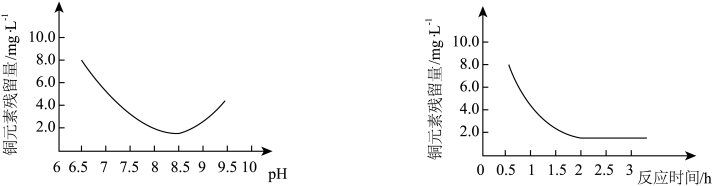
判断反应的最佳条件: pH为___ 、反应时间为____ h。
(3)检验Cu2(OH)2CO3洗涤是否完全的方法是____________________
(4) Cu2(OH)2CO3也可以表示为CuCO3·Cu(OH)2。 查阅文献,上述反应条件下还可能生成少量CuCO3·Cu(OH)2。为测定产品的纯度[产品中Cu2(OH)2CO3的质量分数],取10.97g干燥样品,400℃左右加热,测得固体质量随时间变化关系如图所示。

已知: 8.00g固体为黑色纯净物。
有关物质的摩尔质量如表:
请计算产品的纯度(写出计算过程,结果保留3位有效数字)。______

(1)“溶解”步骤反应的离子方程式为
(2)“反应”步骤生成Cu2(OH)2CO3的化学方程式为

判断反应的最佳条件: pH为
(3)检验Cu2(OH)2CO3洗涤是否完全的方法是
(4) Cu2(OH)2CO3也可以表示为CuCO3·Cu(OH)2。 查阅文献,上述反应条件下还可能生成少量CuCO3·Cu(OH)2。为测定产品的纯度[产品中Cu2(OH)2CO3的质量分数],取10.97g干燥样品,400℃左右加热,测得固体质量随时间变化关系如图所示。

已知: 8.00g固体为黑色纯净物。
有关物质的摩尔质量如表:
| 物质 | CuCO3·Cu(OH)2 | CuCO3·2Cu(OH)2 | CuO |
| 摩尔质量/g·mol-1 | 222 | 320 | 80 |
请计算产品的纯度(写出计算过程,结果保留3位有效数字)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】工业所需氢气大部分由化学法制得,制取出过程中不可避免的会产生副产物CO、CO2、H2S等,CO选择性催化甲烷化技术可实现CO转化为CH4和H2O以达到净化氢气的目的。富氢气氛中CO和CO2甲烷化反应:
CO(g)+3H2(g) CH4(g)+H2O(g)△H=-206.2kJ•mol-1
CH4(g)+H2O(g)△H=-206.2kJ•mol-1
CO2(g)+4H2(g) CH4(g)+2H2O(g)△H=-165.0kJ•mol-1
CH4(g)+2H2O(g)△H=-165.0kJ•mol-1
回答下列问题:
(1)CO的转化率(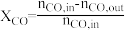 )及H2对CO的选择性(
)及H2对CO的选择性(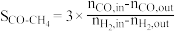 )是衡量工艺优劣的重要指标。其中nco,in及
)是衡量工艺优劣的重要指标。其中nco,in及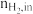 分别为反应器入口CO、H2物质的量;nco,out及
分别为反应器入口CO、H2物质的量;nco,out及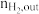 分别为反应器出口CO、H2的物质的量。
分别为反应器出口CO、H2的物质的量。
①以一定流速将富氢(含CO和CO2通过反应器 ,温度低于250℃时,在Ni-ZrO2-SiO2催化剂表面CO和CO2甲烷化速率均随温度升高而增大,则该温度范围内XCO将________ (填“增大”“减小”或“无法判断”)。
②温度高于270℃反应CO2速率迅速增加,此时H2对CO的选择性开始________ (填“升高”“下降”或“不变”)。
(2)恒温恒容条件下H2S发生分解反应,2H2S(g) 2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol。
2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol。
①则初始时H2S的分压为________ 。
②该反应的Kp=________ (Kp表示分压平衡常数,分压=总压×物质的量分数)。
(3)甲烷化过程中H2S会使催化剂中毒,下是图3个H2S在催化剂表面逐步解离的能量变化图:
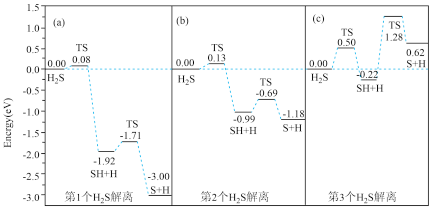
注:TS表示过渡状态
①(c)图中H2S的解离分为________ 步,决定分解速率快慢的是第________ 步.
②(b)图SH解离为硫原子和氢原子的反应热为________ eV.
③Prodhomme研究发现H2S的解离难易与硫原子在催化剂表面吸附的多少有一定关系,观察上图预测该关系为________ 。
CO(g)+3H2(g)
 CH4(g)+H2O(g)△H=-206.2kJ•mol-1
CH4(g)+H2O(g)△H=-206.2kJ•mol-1CO2(g)+4H2(g)
 CH4(g)+2H2O(g)△H=-165.0kJ•mol-1
CH4(g)+2H2O(g)△H=-165.0kJ•mol-1回答下列问题:
(1)CO的转化率(
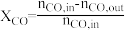 )及H2对CO的选择性(
)及H2对CO的选择性(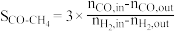 )是衡量工艺优劣的重要指标。其中nco,in及
)是衡量工艺优劣的重要指标。其中nco,in及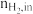 分别为反应器入口CO、H2物质的量;nco,out及
分别为反应器入口CO、H2物质的量;nco,out及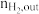 分别为反应器出口CO、H2的物质的量。
分别为反应器出口CO、H2的物质的量。①以一定流速将富氢(含CO和CO2通过反应器 ,温度低于250℃时,在Ni-ZrO2-SiO2催化剂表面CO和CO2甲烷化速率均随温度升高而增大,则该温度范围内XCO将
②温度高于270℃反应CO2速率迅速增加,此时H2对CO的选择性开始
(2)恒温恒容条件下H2S发生分解反应,2H2S(g)
 2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol。
2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol。①则初始时H2S的分压为
②该反应的Kp=
(3)甲烷化过程中H2S会使催化剂中毒,下是图3个H2S在催化剂表面逐步解离的能量变化图:

注:TS表示过渡状态
①(c)图中H2S的解离分为
②(b)图SH解离为硫原子和氢原子的反应热为
③Prodhomme研究发现H2S的解离难易与硫原子在催化剂表面吸附的多少有一定关系,观察上图预测该关系为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】工业上可采用丙烯氨氧化法制丙烯脂,回答下列问题:
I.丙烯的制备反应方程式为C3H8(g)=C3H6(g)+H2(g)。
已知:部分共价键的键能如下:
(1)制备丙烯反应的△H=__ 。该反应在__ (“高温”或“低温”)下有利于自发进行。
(2)提高丙烯产率可以选择__ (填序号)。
A.升温 B.减小压强 C.充入H2(恒容) D.加入催化剂
(3)已知:CO2(g)+H2(g)=CO(g)+H2O(g) ∆H=-41kJ·mol-1,工业上选择向反应体系中加入CO2,提高丙烷的转化率,从化学平衡原理角度说明原因:__ 。
II.利用丙烯制备丙烯腈,反应方程式如下:2C3H6(g)+2NH3(g)+3O2(g) 2CH2=CHCN(g)+6H2O(l) ∆H=-1294kJ·mol-1。
2CH2=CHCN(g)+6H2O(l) ∆H=-1294kJ·mol-1。
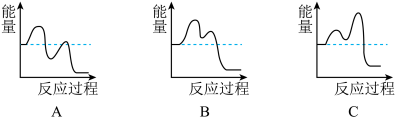
(4)主要的反应机理如下:
CH3-CH=CH2→[CH2 CH
CH CH2]+H 慢 ∆H>0
CH2]+H 慢 ∆H>0
[CH2 CH
CH CH2]+[NH]→CH2=CH-CN+3H 快
CH2]+[NH]→CH2=CH-CN+3H 快
如图能表示反应历程的是__ (填序号)。.
(5)一定温度下,IL恒容密闭容器中充人等物质的量的C3H6、NH3、O2制备丙烯腈,c(C3H6)与v正随时间变化的数据如下表:
①判断t4时刻反应是否已经达到平衡状态并说明理由:__ 。
②列式并计算制备丙烯腈反应的平衡常数K=__ (mol·L-1)-5。
③已知:正反应速率v正=kca(C3H6),根据表中数据,a=__ 。
I.丙烯的制备反应方程式为C3H8(g)=C3H6(g)+H2(g)。
已知:部分共价键的键能如下:
| 共价键 | C—H | C—C | C H H | H—H |
键能(kJ mol-1) mol-1) | 414 | 346 | 602 | 436 |
(2)提高丙烯产率可以选择
A.升温 B.减小压强 C.充入H2(恒容) D.加入催化剂
(3)已知:CO2(g)+H2(g)=CO(g)+H2O(g) ∆H=-41kJ·mol-1,工业上选择向反应体系中加入CO2,提高丙烷的转化率,从化学平衡原理角度说明原因:
II.利用丙烯制备丙烯腈,反应方程式如下:2C3H6(g)+2NH3(g)+3O2(g)
 2CH2=CHCN(g)+6H2O(l) ∆H=-1294kJ·mol-1。
2CH2=CHCN(g)+6H2O(l) ∆H=-1294kJ·mol-1。(4)主要的反应机理如下:
CH3-CH=CH2→[CH2
 CH
CH CH2]+H 慢 ∆H>0
CH2]+H 慢 ∆H>0[CH2
 CH
CH CH2]+[NH]→CH2=CH-CN+3H 快
CH2]+[NH]→CH2=CH-CN+3H 快如图能表示反应历程的是

(5)一定温度下,IL恒容密闭容器中充人等物质的量的C3H6、NH3、O2制备丙烯腈,c(C3H6)与v正随时间变化的数据如下表:
| 时间 | 0 | t1 | t2 | t3 | t4 | t5 |
c(C3H6)/(mol L-1) L-1) | 1.00 | 0.70 | 0.55 | 0.45 | 0.40 | 0.40 |
| v正 | k | 0.70k | 0.55k | 0.45k | 0.40k | 0.4k |
②列式并计算制备丙烯腈反应的平衡常数K=
③已知:正反应速率v正=kca(C3H6),根据表中数据,a=
您最近一年使用:0次
【推荐3】燃煤烟气中SO2和NOx是大气污染物的主要来源,脱硫脱硝技术是烟气治理技术的研究热点。
(1)尿素/H2O2溶液脱硫脱硝。尿素[CO(NH2)2]是一种强还原制,具有弱碱性。60°C时在一定浓度的尿素/ H2O溶液中通入含有SO2和NO的烟气。烟气中有毒气体被一定程度吸收。
①尿素/H2O2溶液对SO2具有很高的去除效率,写出尿素和H2O2溶液吸收SO2,生成硫酸铵和CO2的化学方程式为_________________________________________ 。
②尿素/H2O2溶液对NO的吸收去除效果不如SO2吸收去除效果,原因是____________________________ 。
③脱硝时H2O2能将NO氧化为NO2及HNO3等,促进2HNO3+CO(NH2)2=2N2↑+CO2↑+ 3H2O等氧化还原反应的发生。尿素/H2O2溶液脱硫脱硝一般控制温度为50°C~ 70°C,过高的温度会导致NO去除率降低的原因是______________________________________________________________ 。
(2)V2O5/炭基材料(活性炭、活性焦、活炭纤维)也可以脱硫脱硝。单一炭基材料脱硫原理是:SO2在炭表面被吸附,吸附态SO2被炭表面的含氧官能团催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫时,通过红外光谱发现,脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,该脱硫反应过程可描述为_____________________________________________ 。
②V2O5/炭基材料脱硫脱硝时,控制一定气体流量和温度,考察了烟气中O2的存在对V2O5/炭基材料催化剂脱硫脱硝活性的影响,结果如图所示:
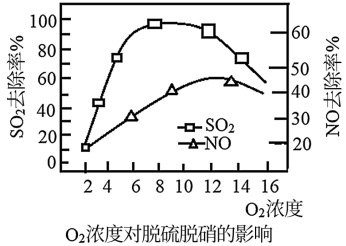
当氧气浓度过高时,去除效率下降,其可能原因是___________________ 。
(1)尿素/H2O2溶液脱硫脱硝。尿素[CO(NH2)2]是一种强还原制,具有弱碱性。60°C时在一定浓度的尿素/ H2O溶液中通入含有SO2和NO的烟气。烟气中有毒气体被一定程度吸收。
①尿素/H2O2溶液对SO2具有很高的去除效率,写出尿素和H2O2溶液吸收SO2,生成硫酸铵和CO2的化学方程式为
②尿素/H2O2溶液对NO的吸收去除效果不如SO2吸收去除效果,原因是
③脱硝时H2O2能将NO氧化为NO2及HNO3等,促进2HNO3+CO(NH2)2=2N2↑+CO2↑+ 3H2O等氧化还原反应的发生。尿素/H2O2溶液脱硫脱硝一般控制温度为50°C~ 70°C,过高的温度会导致NO去除率降低的原因是
(2)V2O5/炭基材料(活性炭、活性焦、活炭纤维)也可以脱硫脱硝。单一炭基材料脱硫原理是:SO2在炭表面被吸附,吸附态SO2被炭表面的含氧官能团催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫时,通过红外光谱发现,脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,该脱硫反应过程可描述为
②V2O5/炭基材料脱硫脱硝时,控制一定气体流量和温度,考察了烟气中O2的存在对V2O5/炭基材料催化剂脱硫脱硝活性的影响,结果如图所示:

当氧气浓度过高时,去除效率下降,其可能原因是
您最近一年使用:0次



