工业级氯化钙(CaCl2)通常用作道路的融雪除冰和干燥剂,主要利用纯碱工业废液生产。完成下列填空:
(1)氯原子的核外电子排布式_______ ;氯化钙的电子式_______ ; 比较构成CaCl2 的微粒半径大小(用微粒符号表示)_______ 。
(2)纯碱生产的工业方法有多种,其中废液含有大量氯化钙的是_______ 制碱法。
(3)向饱和NaHCO3溶液中滴加少量CaCl2溶液,产生大量白色沉淀和少量气体,用平衡知识解释产生沉淀的原因_______ 。
(4)氯化钙不能干燥NH3,因为CaCl2(s)+8NH3(g)⇌CaCl2·8NH3(s)+Q(Q>0),该反应的平衡常数K=_______ ;向2 L装有CaCl2的密闭容器中,通入2 mol NH3,反应10分钟,固体增重17 g,则 0~10分钟内,NH3的平均反应速率ʋ =_______ ;若要将已 吸收NH3的CaCl2重新恢复吸收NH3的能力,写出一种可采取的措施_______ 。
(1)氯原子的核外电子排布式
(2)纯碱生产的工业方法有多种,其中废液含有大量氯化钙的是
(3)向饱和NaHCO3溶液中滴加少量CaCl2溶液,产生大量白色沉淀和少量气体,用平衡知识解释产生沉淀的原因
(4)氯化钙不能干燥NH3,因为CaCl2(s)+8NH3(g)⇌CaCl2·8NH3(s)+Q(Q>0),该反应的平衡常数K=
2021·上海徐汇·一模 查看更多[1]
更新时间:2021-01-19 21:38:24
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】CO和H2在工业上常作为重要的化工原料,其混合气称为合成气。工业上CH4—H2O催化重整是目前大规模制取合成气的重要方法,其原理为:
反应Ⅰ:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+210 kJ/mol
反应Ⅱ:CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=﹣41 kJ/mol
(1)CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H3=____ kJ/mol。
(2)反应Ⅰ达到平衡的标志是_____ 。
A.恒温恒容情况下,压强不再改变 B.v正(CO)=3v逆(H2)
C.平均相对分子质量不再改变 D.恒温恒容情况下,气体密度不再改变
(3)若容器容积不变,不考虑反应Ⅰ,对反应Ⅱ下列措施可增加CO转化率的是____ 。
A.升高温度 B.将CO2从体系分离
C.充入He,使体系总压强增大 D.按原投料比加倍投料
(4)将1 mol CH4(g)和1 mol H2O(g)加入恒温恒压的密闭容器中(温度298 K、压强100 kPa),发生反应Ⅰ,不考虑反应Ⅱ的发生,该反应中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),其中k正、k逆为速率常数,p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=___ (以k正、k逆表示)。若该条件下k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=__ kPa·s-1(保留两位有效数字)。
反应Ⅰ:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+210 kJ/mol
反应Ⅱ:CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=﹣41 kJ/mol
(1)CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H3=
(2)反应Ⅰ达到平衡的标志是
A.恒温恒容情况下,压强不再改变 B.v正(CO)=3v逆(H2)
C.平均相对分子质量不再改变 D.恒温恒容情况下,气体密度不再改变
(3)若容器容积不变,不考虑反应Ⅰ,对反应Ⅱ下列措施可增加CO转化率的是
A.升高温度 B.将CO2从体系分离
C.充入He,使体系总压强增大 D.按原投料比加倍投料
(4)将1 mol CH4(g)和1 mol H2O(g)加入恒温恒压的密闭容器中(温度298 K、压强100 kPa),发生反应Ⅰ,不考虑反应Ⅱ的发生,该反应中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),其中k正、k逆为速率常数,p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】页岩气是从页岩层中开采的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) = CO(g)+3H2(g) ΔH1。已知:CH4、H2、CO的燃烧热(ΔH)分别为-a kJ·mol-1、-b kJ·mol-1、-c kJ·mol-1;H2O(l)=H2O(g) ΔH=+d kJ·mol-1。
则ΔH1=______________ (用含字母a、b、c、d的代数式表示)kJ·mol-1。
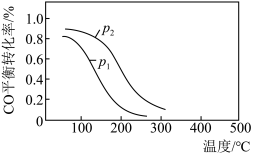
(2)用合成气生成甲醇的反应为CO(g)+2H2(g) CH3OH(g) ΔH2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:
CH3OH(g) ΔH2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:
200 ℃时n(H2)随时间的变化如下表所示:
①ΔH2____ (填“>”“<”或“=”)0。
②写出两条可同时提高反应速率和CO转化率的措施:_____ 。
③下列说法正确的是____ (填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强:p1<p2
④0~3 min内用CH3OH表示的反应速率v(CH3OH)=____ mol·L-1·min-1。
⑤200 ℃时,该反应的平衡常数K=____ 。向上述200 ℃达到平衡的恒容密闭容器中再加入2 mol CO、4 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____ (填“正向”“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下充入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为____ 。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) = CO(g)+3H2(g) ΔH1。已知:CH4、H2、CO的燃烧热(ΔH)分别为-a kJ·mol-1、-b kJ·mol-1、-c kJ·mol-1;H2O(l)=H2O(g) ΔH=+d kJ·mol-1。
则ΔH1=
(2)用合成气生成甲醇的反应为CO(g)+2H2(g)
 CH3OH(g) ΔH2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:
CH3OH(g) ΔH2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:
200 ℃时n(H2)随时间的变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
②写出两条可同时提高反应速率和CO转化率的措施:
③下列说法正确的是
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强:p1<p2
④0~3 min内用CH3OH表示的反应速率v(CH3OH)=
⑤200 ℃时,该反应的平衡常数K=
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下充入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】科学家利用太阳能分解水生成的氢气与煤化工厂产生的CO2、CO反应生成甲醇。
已知:①CO(g)+2H2(g)=CH3OH(l) ΔH1=-128.1kJ/mol
②CO(g)+ O2(g)=CO2(g) ΔH2=-283.0kJ/mol
O2(g)=CO2(g) ΔH2=-283.0kJ/mol
③CH3OH(1)+O2(g)=CO(g)+2H2O(1) ΔH3=-443.5kJ/mol
④H2(g)+ O2(g)=H2O(g) ΔH4=-241.8kJ/mol
O2(g)=H2O(g) ΔH4=-241.8kJ/mol
回答下列问题:
(1)CH3OH(1)完全燃烧生成CO2(g)和H2O(1)的热化学方程式为_____ 。
(2)CO2(g)+3H2(g)=CH3OH(1)+H2O(g) K=_____ (填表达式)。
(3)关于反应CO(g)+2H2(g)=CH3OH(1),下列说法错误的是_____ (填标号)。
(4)某温度下,向容积为1L的恒容密闭容器中充入0.5molCO2(g)与1.0molH2(g),发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),在第5min时达到化学平衡状态,此时CH3OH(g)的物质的量分数为25%。在第10min、20min时分别改变反应条件,CH3OH(g)的浓度在不同条件下的变化状况如图所示。
CH3OH(g)+H2O(g),在第5min时达到化学平衡状态,此时CH3OH(g)的物质的量分数为25%。在第10min、20min时分别改变反应条件,CH3OH(g)的浓度在不同条件下的变化状况如图所示。
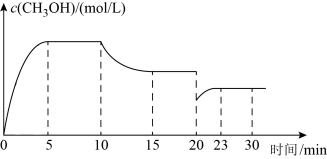
①0~5min,v(CO2)=_____ mol/(L•min)。
②该温度下,化学平衡常数K=_____ 。
③20min时改变的反应条件可能是_____ 。
(5)某温度下,在恒容密闭容器中,发生反应CH3OH(1)+O2(g) CO(g)+2H2O(1),下列选项中能判断反应已经达到平衡状态的是
CO(g)+2H2O(1),下列选项中能判断反应已经达到平衡状态的是_____ 。
已知:①CO(g)+2H2(g)=CH3OH(l) ΔH1=-128.1kJ/mol
②CO(g)+
 O2(g)=CO2(g) ΔH2=-283.0kJ/mol
O2(g)=CO2(g) ΔH2=-283.0kJ/mol③CH3OH(1)+O2(g)=CO(g)+2H2O(1) ΔH3=-443.5kJ/mol
④H2(g)+
 O2(g)=H2O(g) ΔH4=-241.8kJ/mol
O2(g)=H2O(g) ΔH4=-241.8kJ/mol回答下列问题:
(1)CH3OH(1)完全燃烧生成CO2(g)和H2O(1)的热化学方程式为
(2)CO2(g)+3H2(g)=CH3OH(1)+H2O(g) K=
(3)关于反应CO(g)+2H2(g)=CH3OH(1),下列说法错误的是
| A.该反应在低温下能自发进行 |
| B.降低温度,反应速率减小,平衡常数增大 |
| C.使用合适的催化剂,可以增大CO的平衡转化率 |
| D.增大压强,ΔH也增大 |
 CH3OH(g)+H2O(g),在第5min时达到化学平衡状态,此时CH3OH(g)的物质的量分数为25%。在第10min、20min时分别改变反应条件,CH3OH(g)的浓度在不同条件下的变化状况如图所示。
CH3OH(g)+H2O(g),在第5min时达到化学平衡状态,此时CH3OH(g)的物质的量分数为25%。在第10min、20min时分别改变反应条件,CH3OH(g)的浓度在不同条件下的变化状况如图所示。
①0~5min,v(CO2)=
②该温度下,化学平衡常数K=
③20min时改变的反应条件可能是
(5)某温度下,在恒容密闭容器中,发生反应CH3OH(1)+O2(g)
 CO(g)+2H2O(1),下列选项中能判断反应已经达到平衡状态的是
CO(g)+2H2O(1),下列选项中能判断反应已经达到平衡状态的是| A.混合气体的密度不变 | B.混合气体的平均相对分子质量不变 |
| C.CO与H2O的物质的量之比为1:2 | D.v正(O2)=2v逆(H2O) |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】部分弱酸的电离平衡常数如表:

(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1
NaHCO3溶液的pH由大到小的关系为_____________________________________ 。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO 、CO
、CO 、HSO
、HSO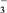 、HCO
、HCO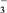 浓度由大到小的顺序为
浓度由大到小的顺序为___________________________________ 。
(3)下列离子方程式正确的是________ (填字母)。
a.2ClO-+H2O+CO2===2HClO+CO b.2HCOOH+CO
b.2HCOOH+CO ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-===2HCOOH+SO d.Cl2+H2O+2CO
d.Cl2+H2O+2CO ===2HCO
===2HCO +Cl-+ClO-
+Cl-+ClO-
(4)某温度(T ℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示.
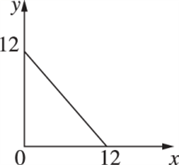
① 此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_____ 。
②在此温度下,0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
按丁方式混合后,所得溶液显________ (填“酸”“碱”或“中”)性.写出按乙方式混合后,反应的离子方程式:__________________________ 。按甲方式混合后,所得溶液的pH为________ 。

(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1
NaHCO3溶液的pH由大到小的关系为
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO
 、CO
、CO 、HSO
、HSO 、HCO
、HCO 浓度由大到小的顺序为
浓度由大到小的顺序为(3)下列离子方程式正确的是
a.2ClO-+H2O+CO2===2HClO+CO
 b.2HCOOH+CO
b.2HCOOH+CO ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑c.H2SO3+2HCOO-===2HCOOH+SO
 d.Cl2+H2O+2CO
d.Cl2+H2O+2CO ===2HCO
===2HCO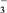 +Cl-+ClO-
+Cl-+ClO-(4)某温度(T ℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示.

① 此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为
②在此温度下,0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 | |
| 0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1 mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】I、电解质在水溶液中的行为影响了电解质溶液的性质(以下讨论均在常温时)。
(1)0.1
 溶液的pH=3
溶液的pH=3
① 的电离度
的电离度___________ (用百分比表示)。
②该溶液中由水电离出的 浓度是
浓度是___________  。
。
③计算 的电离平衡常数
的电离平衡常数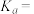
___________ 。
Ⅱ、某铬盐厂净化含Cr(VI)废水并提取Cr2O3的一种工艺流程如图所示。

已知:Ksp[Cr(OH)3]=6.0×10-29
(2)步骤I中,发生的反应为2H++2

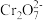 +H2O,随着酸的浓度增大B中
+H2O,随着酸的浓度增大B中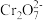 的浓度会
的浓度会___________ (“增大”或“减小”)。
(3)当清液中Cr3+的浓度6×10-5mol·L-1时,可认为已达铬的排放标准。此时清液的pH=___________ 。
(4)已知NaHSO3溶液显酸性,则溶液中c(H2SO3)___________ c( )浓度大小关系为(填“>”“<”)
)浓度大小关系为(填“>”“<”)
(1)0.1

 溶液的pH=3
溶液的pH=3①
 的电离度
的电离度②该溶液中由水电离出的
 浓度是
浓度是 。
。③计算
 的电离平衡常数
的电离平衡常数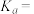
Ⅱ、某铬盐厂净化含Cr(VI)废水并提取Cr2O3的一种工艺流程如图所示。

已知:Ksp[Cr(OH)3]=6.0×10-29
(2)步骤I中,发生的反应为2H++2


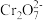 +H2O,随着酸的浓度增大B中
+H2O,随着酸的浓度增大B中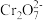 的浓度会
的浓度会(3)当清液中Cr3+的浓度6×10-5mol·L-1时,可认为已达铬的排放标准。此时清液的pH=
(4)已知NaHSO3溶液显酸性,则溶液中c(H2SO3)
 )浓度大小关系为(填“>”“<”)
)浓度大小关系为(填“>”“<”)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
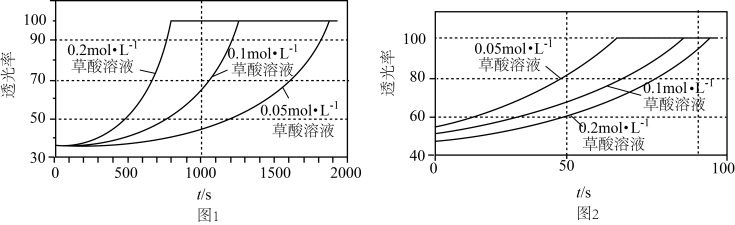
【推荐3】某研究小组为了验证反应物浓度对反应速率的影响,在室温下向2mL0.001mol·L-1KMnO4溶液中分别加入不同浓度的草酸溶液2mL,实验结果如图1;若上述实验中使用的是含20%硫酸的0.001mol·L-1KMnO4溶液,实验结果如图2。回答有关问题:
已知:草酸与高锰酸钾反应的过程可能为:Mn(VII)(VII表示价态,下同) Mn(VI)
Mn(VI) Mn(IV)
Mn(IV) Mn(III)
Mn(III)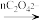 Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2
Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2
(1)实验时发生总反应的离子方程式为___ 。
(2)由题可知,Mn(II)的作用是___ ;由图2可知,在当前实验条件下,增大草酸的浓度,褪色时间___ (填“变大”、“变小”或“不变”)。
(3)对比图1和图2,该小组同学推测酸化有利于提高该反应的速率。为了验证该推测,设计了系列实验,记录如下(均在室温下进行):
①请完成此实验设计:V5=___ ,V6=___ 。
②设计A号试管实验的目的是___ 。
(4)已知25℃时草酸的电离常数为K1=5.0×10-2,K2=5.4×10-5。
①写出H2C2O4与少量的KOH溶液反应的离子方程式:___ 。
②已知25℃时CH3COOH的电离常数为K=1.75×10-5,则等浓度的草酸溶液和醋酸溶液中,pH较小的是___ 。

已知:草酸与高锰酸钾反应的过程可能为:Mn(VII)(VII表示价态,下同)
 Mn(VI)
Mn(VI) Mn(IV)
Mn(IV) Mn(III)
Mn(III)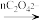 Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2
Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2(1)实验时发生总反应的离子方程式为
(2)由题可知,Mn(II)的作用是
(3)对比图1和图2,该小组同学推测酸化有利于提高该反应的速率。为了验证该推测,设计了系列实验,记录如下(均在室温下进行):
| 试管编号 | 0.01mol•L-1KMnO4溶液/mL | 0.2mol•L-1 H2C2O4溶液/mL | 蒸馏水/mL | 2.0mol•L-1H2SO4溶液/mL |
| A | 4.0 | 2.0 | 2.0 | 0 |
| B | V1 | V2 | 1.5 | V3 |
| C | V4 | 2.0 | V5 | 1.0 |
| D | V6 | 2.0 | 0 | 2.0 |
①请完成此实验设计:V5=
②设计A号试管实验的目的是
(4)已知25℃时草酸的电离常数为K1=5.0×10-2,K2=5.4×10-5。
①写出H2C2O4与少量的KOH溶液反应的离子方程式:
②已知25℃时CH3COOH的电离常数为K=1.75×10-5,则等浓度的草酸溶液和醋酸溶液中,pH较小的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】现有常温下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________ 。
(2)丙溶液中存在的电离平衡为___________ , __________ (用电离平衡方程式表示)。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________ (填序号)。
①n(H+)②c(H+) ③c(CH3COO-)④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___________ 。
(5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:

甲溶液滴定丙溶液的曲线是________ (填“图1”或“图2”)曲线。
(1)甲溶液的pH=
(2)丙溶液中存在的电离平衡为
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是
①n(H+)②c(H+) ③c(CH3COO-)④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为
(5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:

甲溶液滴定丙溶液的曲线是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】草酸亚铁晶体(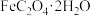 )是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料。在实验室可由绿矾(
)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料。在实验室可由绿矾(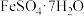 )和草酸(
)和草酸( )为原料进行制备,基本流程如图:
)为原料进行制备,基本流程如图:

(1)“溶解”时,用稀硫酸而不用蒸馏水溶解,其原因是_______ 。
(2)“沉淀”时,若溶液 过小,将会导致
过小,将会导致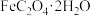 产率降低,其原因是
产率降低,其原因是_______ 。【 ,
, 】
】
(3)测定草酸亚铁晶体纯度的步骤如下:
步骤Ⅰ:称取 所制得的样品溶于稀
所制得的样品溶于稀 中,配成
中,配成 溶液;
溶液;
步骤Ⅱ:取上述溶液 ,用
,用 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 (
( 或
或 被氧化为
被氧化为 ,
, 被氧化为
被氧化为 ,其余杂质不参加反应)。
,其余杂质不参加反应)。
①若样品中混有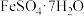 ,则
,则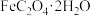 的质量分数的测定结果将
的质量分数的测定结果将_______ (填“偏高”、“偏低”或“无影响”)。
②计算该样品中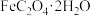 的质量分数。
的质量分数。_______ (写出计算过程,已知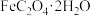 相对分子质量为180)
相对分子质量为180)
(4)以硫铁矿烧渣(主要成分为 、
、 、
、 )为原料,先制备绿矾,再合成草酸亚铁晶体。请结合如图所示的绿矾溶解度曲线,补充完整由疏铁矿烧渣制备
)为原料,先制备绿矾,再合成草酸亚铁晶体。请结合如图所示的绿矾溶解度曲线,补充完整由疏铁矿烧渣制备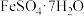 晶体的实验步骤:向一定量烧渣中加入足量的稀硫酸充分反应,过滤,
晶体的实验步骤:向一定量烧渣中加入足量的稀硫酸充分反应,过滤,_______ ,得到 溶液,再滴加稀硫酸酸化,
溶液,再滴加稀硫酸酸化,_______ ,过滤,少量冰水洗涤,低温干燥,得到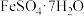 晶体。
晶体。
【已知 时
时 沉淀完全;
沉淀完全; 时
时 开始沉淀。实验中必须使用的试剂:铁粉、
开始沉淀。实验中必须使用的试剂:铁粉、 溶液】
溶液】

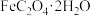 )是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料。在实验室可由绿矾(
)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料。在实验室可由绿矾(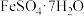 )和草酸(
)和草酸( )为原料进行制备,基本流程如图:
)为原料进行制备,基本流程如图:
(1)“溶解”时,用稀硫酸而不用蒸馏水溶解,其原因是
(2)“沉淀”时,若溶液
 过小,将会导致
过小,将会导致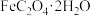 产率降低,其原因是
产率降低,其原因是 ,
, 】
】(3)测定草酸亚铁晶体纯度的步骤如下:
步骤Ⅰ:称取
 所制得的样品溶于稀
所制得的样品溶于稀 中,配成
中,配成 溶液;
溶液;步骤Ⅱ:取上述溶液
 ,用
,用 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 (
( 或
或 被氧化为
被氧化为 ,
, 被氧化为
被氧化为 ,其余杂质不参加反应)。
,其余杂质不参加反应)。①若样品中混有
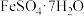 ,则
,则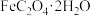 的质量分数的测定结果将
的质量分数的测定结果将②计算该样品中
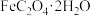 的质量分数。
的质量分数。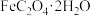 相对分子质量为180)
相对分子质量为180) (4)以硫铁矿烧渣(主要成分为
 、
、 、
、 )为原料,先制备绿矾,再合成草酸亚铁晶体。请结合如图所示的绿矾溶解度曲线,补充完整由疏铁矿烧渣制备
)为原料,先制备绿矾,再合成草酸亚铁晶体。请结合如图所示的绿矾溶解度曲线,补充完整由疏铁矿烧渣制备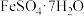 晶体的实验步骤:向一定量烧渣中加入足量的稀硫酸充分反应,过滤,
晶体的实验步骤:向一定量烧渣中加入足量的稀硫酸充分反应,过滤, 溶液,再滴加稀硫酸酸化,
溶液,再滴加稀硫酸酸化,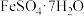 晶体。
晶体。【已知
 时
时 沉淀完全;
沉淀完全; 时
时 开始沉淀。实验中必须使用的试剂:铁粉、
开始沉淀。实验中必须使用的试剂:铁粉、 溶液】
溶液】
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】光合作用是自然界最重要的过程之一,其总反应一般表示为6CO2 + 6H2O→C6H12O6 + 6O2,实际反应分多步进行,其中,水的氧化过程是一个重要环节,此过程在光系统II(简称PSII)中发生,使水氧化的活性中心是含有4个锰原子的配位簇(称为锰氧族)。初始状态的锰氧簇(S0) 在光照下依次失去电子变为S1、S2、S3 和S4, S4氧化H2O生成O2.该过程简示如下:
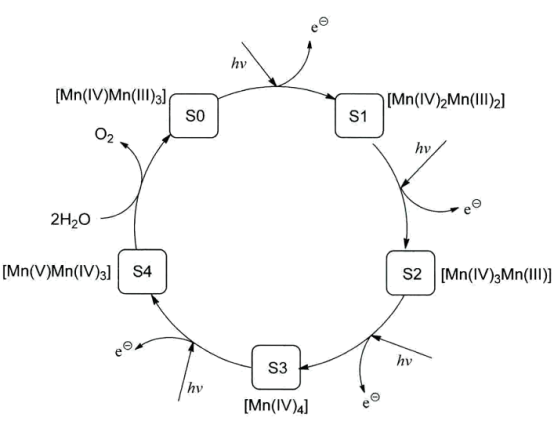
(1)光合作用中,水的氧化是几个电子转移的过程___________ ?
(2) 25°C, 标态下,下列电极反应的电极电势分别为:
a) MnO +4H++e-
+4H++e- MnO2+ 2H2O E
MnO2+ 2H2O E =2.90V
=2.90V
b) MnO2+4H++e- Mn3+ + 2H2O E
Mn3+ + 2H2O E =0.95V
=0.95V
c) O2+4H+ +4e- 2H2O E
2H2O E = 1.23V
= 1.23V
计算上述反应在中性条件下的电极电势___________ 。假定MnO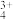 和Mn3+的浓度均为0.10 mol·L-1,氧分压等于其在空气中的分压。回答此条件下MnO
和Mn3+的浓度均为0.10 mol·L-1,氧分压等于其在空气中的分压。回答此条件下MnO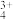 和MnO2能否氧化水
和MnO2能否氧化水___________ 。
(3)在模拟锰氧簇的人工光合作用研究中,研究者注意到如下Mn(III)/Mn(II)体系(25°C);
d) Mn3++e- Mn2+ E
Mn2+ E = 1.51V
= 1.51V
e)在[H2P2O ]=0.40 mol· L-1, [Mn(H2P2O7)
]=0.40 mol· L-1, [Mn(H2P2O7)  ]=[Mn(H2P2O7)
]=[Mn(H2P2O7)  ]的溶液中:Mn(H2P2O7)
]的溶液中:Mn(H2P2O7)  +2H+ +e-
+2H+ +e-  Mn(H2P2O7)
Mn(H2P2O7)  + H4P2O7 E=1.15V
+ H4P2O7 E=1.15V
①计算e)中的半反应的标准电极电势___________ 。
(H4P2O7的酸解离常数: Ka1=1.2 × 10-1,Ka2=7.9 × 10-3, Ka3=2.0×10-7, Ka4=4.5 ×10-10)
②计算Mn(H2P2O7) 和Mn(H2P2O7)
和Mn(H2P2O7)  的稳定常数之比
的稳定常数之比___________ 。

(1)光合作用中,水的氧化是几个电子转移的过程
(2) 25°C, 标态下,下列电极反应的电极电势分别为:
a) MnO
 +4H++e-
+4H++e- MnO2+ 2H2O E
MnO2+ 2H2O E =2.90V
=2.90Vb) MnO2+4H++e-
 Mn3+ + 2H2O E
Mn3+ + 2H2O E =0.95V
=0.95Vc) O2+4H+ +4e-
 2H2O E
2H2O E = 1.23V
= 1.23V计算上述反应在中性条件下的电极电势
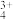 和Mn3+的浓度均为0.10 mol·L-1,氧分压等于其在空气中的分压。回答此条件下MnO
和Mn3+的浓度均为0.10 mol·L-1,氧分压等于其在空气中的分压。回答此条件下MnO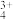 和MnO2能否氧化水
和MnO2能否氧化水(3)在模拟锰氧簇的人工光合作用研究中,研究者注意到如下Mn(III)/Mn(II)体系(25°C);
d) Mn3++e-
 Mn2+ E
Mn2+ E = 1.51V
= 1.51Ve)在[H2P2O
 ]=0.40 mol· L-1, [Mn(H2P2O7)
]=0.40 mol· L-1, [Mn(H2P2O7)  ]=[Mn(H2P2O7)
]=[Mn(H2P2O7)  ]的溶液中:Mn(H2P2O7)
]的溶液中:Mn(H2P2O7)  +2H+ +e-
+2H+ +e-  Mn(H2P2O7)
Mn(H2P2O7)  + H4P2O7 E=1.15V
+ H4P2O7 E=1.15V①计算e)中的半反应的标准电极电势
(H4P2O7的酸解离常数: Ka1=1.2 × 10-1,Ka2=7.9 × 10-3, Ka3=2.0×10-7, Ka4=4.5 ×10-10)
②计算Mn(H2P2O7)
 和Mn(H2P2O7)
和Mn(H2P2O7)  的稳定常数之比
的稳定常数之比
您最近一年使用:0次
【推荐1】在短周期主族元素中:
(1)属于非金属元素但又具有一定的金属性,可作半导体材料的是________ (填元素名称)。
(2)铝是活泼的金属元素,单质铝由于___________ ,而具有良好的抗腐蚀能力,美国化学家发现铝的“原子群”(如Al13、Al14、Al37)各具有与某种元素相似的化学性质,并符合元素周期律中的某些规律。例如:Al13与卤素具有相似的化学性质,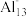 离子具有惰性气体元素的性质,可推测Al14的化学性质与
离子具有惰性气体元素的性质,可推测Al14的化学性质与________ 族元素相似。
(3)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子。
①写出甲元素的电子排布式____________ ,乙元素的原子结构示意图________________ 。
②甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于____________ 晶体,其化学式为_______________ 。
(1)属于非金属元素但又具有一定的金属性,可作半导体材料的是
(2)铝是活泼的金属元素,单质铝由于
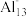 离子具有惰性气体元素的性质,可推测Al14的化学性质与
离子具有惰性气体元素的性质,可推测Al14的化学性质与(3)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子。
①写出甲元素的电子排布式
②甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于
您最近一年使用:0次
【推荐2】W、X、Y、Z、N是短周期元素,它们的核电荷数依次增大。
(1)W单质的化学式为_______ ,Z元素原子核外有_________ 个原子轨道填充了电子。
(2)Y、Z和N三种元素第一电离能由大到小的顺序为____________ (填元素符号),写出Y3+在过量氨水中反应的离子方程式 ____________ 。
(3)用电子式表示X与W构成的化合物的形成过程________ 。
(4)Z元素原子共有________ 种不同运动状态的电子。
| 元素 | 元素性质或原子结构 |
| W | 单质在氯气中燃烧,产生苍白色火焰 |
| X | 在Y的上一周期,原子核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 元素的离子半径在该周期中最小 |
| Z | 原子核外p能级上的电子总数比s能级上的电子总数多2 |
| N | 最外层电子数比次外层电子数少1 |
(1)W单质的化学式为
(2)Y、Z和N三种元素第一电离能由大到小的顺序为
(3)用电子式表示X与W构成的化合物的形成过程
(4)Z元素原子共有
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】已知元素X和Y的核电荷数都小于18,最外层电子数分别为n和(m-5),次外层分别有(n+2)个和m个电子。甲和乙分别为元素X、Y的最高价氧化物的水化物。
(1)元素名称X为____________________ ,Y为____________________ 。
(2)甲的化学式是____________________ ,乙的化学式是____________________ 。
(3)甲与乙反应的离子方程式是___________________ 。
(1)元素名称X为
(2)甲的化学式是
(3)甲与乙反应的离子方程式是
您最近一年使用:0次



