页岩气是从页岩层中开采的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) = CO(g)+3H2(g) ΔH1。已知:CH4、H2、CO的燃烧热(ΔH)分别为-a kJ·mol-1、-b kJ·mol-1、-c kJ·mol-1;H2O(l)=H2O(g) ΔH=+d kJ·mol-1。
则ΔH1=______________ (用含字母a、b、c、d的代数式表示)kJ·mol-1。
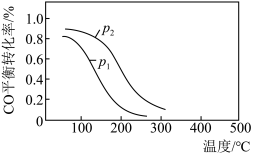
(2)用合成气生成甲醇的反应为CO(g)+2H2(g) CH3OH(g) ΔH2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:
CH3OH(g) ΔH2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:
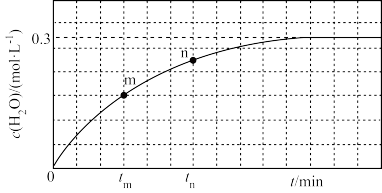
200 ℃时n(H2)随时间的变化如下表所示:
①ΔH2____ (填“>”“<”或“=”)0。
②写出两条可同时提高反应速率和CO转化率的措施:_____ 。
③下列说法正确的是____ (填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强:p1<p2
④0~3 min内用CH3OH表示的反应速率v(CH3OH)=____ mol·L-1·min-1。
⑤200 ℃时,该反应的平衡常数K=____ 。向上述200 ℃达到平衡的恒容密闭容器中再加入2 mol CO、4 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____ (填“正向”“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下充入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为____ 。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) = CO(g)+3H2(g) ΔH1。已知:CH4、H2、CO的燃烧热(ΔH)分别为-a kJ·mol-1、-b kJ·mol-1、-c kJ·mol-1;H2O(l)=H2O(g) ΔH=+d kJ·mol-1。
则ΔH1=
(2)用合成气生成甲醇的反应为CO(g)+2H2(g)
 CH3OH(g) ΔH2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:
CH3OH(g) ΔH2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:
200 ℃时n(H2)随时间的变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
②写出两条可同时提高反应速率和CO转化率的措施:
③下列说法正确的是
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强:p1<p2
④0~3 min内用CH3OH表示的反应速率v(CH3OH)=
⑤200 ℃时,该反应的平衡常数K=
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下充入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为
更新时间:2018-03-19 08:57:07
|
相似题推荐
【推荐1】氮及其化合物在科研及生产中均有重要的应用。
(1) 转化为
转化为 是工业制取硝酸的重要一步,一定条件下,
是工业制取硝酸的重要一步,一定条件下, 与
与 发生催化氧化反应时,可发生不同反应:
发生催化氧化反应时,可发生不同反应:
反应Ⅰ: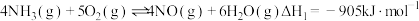
反应Ⅱ: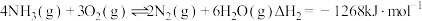
①该条件下, 与
与 反应生成
反应生成 的热化学方程式为
的热化学方程式为_______ .
②一定条件下的密闭容器中发生反应Ⅰ,平衡时混合物中 的物质的量分数在不同温度(
的物质的量分数在不同温度( 、
、 、
、 )随压强的变化如图所示。
)随压强的变化如图所示。
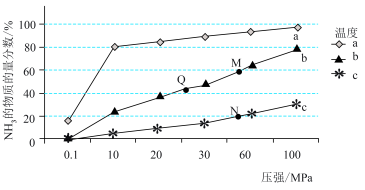
则曲线 对应的温度是
对应的温度是_______ ,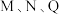 点平衡常数
点平衡常数 的大小关系是
的大小关系是_______ 。
(2)已知: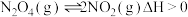 ,将
,将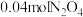 气体充入
气体充入 的恒容密闭容器中,控制反应温度为
的恒容密闭容器中,控制反应温度为 ,
, 随
随 (时间)变化曲线如图。
(时间)变化曲线如图。

①下列各项中能说明该反应已达到化学平衡状态的是_______ 。
A.容器内压强不变 B.
C.混合气体的颜色不变 D.混合气体的密度不变
② 时刻反应达到平衡,若
时刻反应达到平衡,若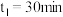 ,计算
,计算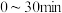 内的平均反应速率
内的平均反应速率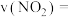
_______ ,此时 的转化率为
的转化率为_______ 。
③反应温度 时,画出
时,画出 时段,
时段, 随
随 变化曲线。保持其他条件不变,改变反应温度为
变化曲线。保持其他条件不变,改变反应温度为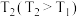 ,再次画出
,再次画出 时段,
时段, 随
随 变化趋势的曲线
变化趋势的曲线____ 。(在答题卡方框中完成 )
(1)
 转化为
转化为 是工业制取硝酸的重要一步,一定条件下,
是工业制取硝酸的重要一步,一定条件下, 与
与 发生催化氧化反应时,可发生不同反应:
发生催化氧化反应时,可发生不同反应:反应Ⅰ:
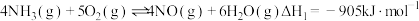
反应Ⅱ:
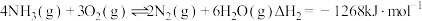
①该条件下,
 与
与 反应生成
反应生成 的热化学方程式为
的热化学方程式为②一定条件下的密闭容器中发生反应Ⅰ,平衡时混合物中
 的物质的量分数在不同温度(
的物质的量分数在不同温度( 、
、 、
、 )随压强的变化如图所示。
)随压强的变化如图所示。
则曲线
 对应的温度是
对应的温度是 点平衡常数
点平衡常数 的大小关系是
的大小关系是(2)已知:
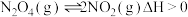 ,将
,将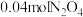 气体充入
气体充入 的恒容密闭容器中,控制反应温度为
的恒容密闭容器中,控制反应温度为 ,
, 随
随 (时间)变化曲线如图。
(时间)变化曲线如图。
①下列各项中能说明该反应已达到化学平衡状态的是
A.容器内压强不变 B.

C.混合气体的颜色不变 D.混合气体的密度不变
②
 时刻反应达到平衡,若
时刻反应达到平衡,若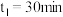 ,计算
,计算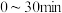 内的平均反应速率
内的平均反应速率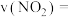
 的转化率为
的转化率为③反应温度
 时,画出
时,画出 时段,
时段, 随
随 变化曲线。保持其他条件不变,改变反应温度为
变化曲线。保持其他条件不变,改变反应温度为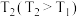 ,再次画出
,再次画出 时段,
时段, 随
随 变化趋势的曲线
变化趋势的曲线
您最近一年使用:0次
【推荐2】硫酸工业和合成氨工业是衡量一个国家工业发展水平的重要指标,下图是硫酸工业和合成氨工业联合生产示意图:

回答下列问题:
(1)已知:
4Fe(s)+3O2(g)=2Fe2O3(s) ∆H=akJ/mol
SO2 (g)=S(s)+O2(g) ∆H=bkJ/mol
Fe(s)+2S(s)=Fe2S(s) ∆H=ckJ/mol
沸腾炉中主要反应的热化学方程式为____ 。
(2)如果生产过程中H2的总转化率为90%,FeS2的总转化率为95%,氨与硫酸生成硫酸铵的转化率为100%,则最初FeS2和H2的物质的量之比为___ 。
(3)在一定条件下,分别向体积相同的恒容密闭容器甲,乙、丙中通入一定量的N2、H2或 NH3,发生反应:N2(g)+3H2(g)⇌2NH3 (g),相关数据如下:
①乙中NH3的转化率为___ ,丙中x的取值范围为___ 。
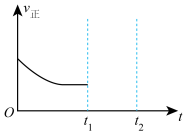
②在t1时升高甲容器的温度,至t2时再次达到平衡,测得t2时混合气体的平均摩尔质量比tl时小。请在图中画出tl~t2时间段正反应速率的变化示意图______________ 。
(4)尾气中含有SO2,直接排放会造成环境污染,可用Fe2(SO4)3溶液吸收。某科研团队对pH、c(Fe3+)、温度等因素对SO2最高吸收率的影响进行研究,结果如图:
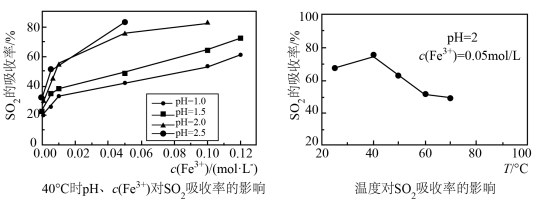
40℃时SO2的最高吸收率随pH、c(Fe3+)的增大而__ ,其原因是___ ;温度高于 40℃后,SO2的最高吸收率随温度的升高而减小,其原因是____ 。

回答下列问题:
(1)已知:
4Fe(s)+3O2(g)=2Fe2O3(s) ∆H=akJ/mol
SO2 (g)=S(s)+O2(g) ∆H=bkJ/mol
Fe(s)+2S(s)=Fe2S(s) ∆H=ckJ/mol
沸腾炉中主要反应的热化学方程式为
(2)如果生产过程中H2的总转化率为90%,FeS2的总转化率为95%,氨与硫酸生成硫酸铵的转化率为100%,则最初FeS2和H2的物质的量之比为
(3)在一定条件下,分别向体积相同的恒容密闭容器甲,乙、丙中通入一定量的N2、H2或 NH3,发生反应:N2(g)+3H2(g)⇌2NH3 (g),相关数据如下:
| 容器 | 甲 | 乙 | 丙 |
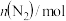 | 1 | 0 | 2 |
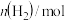 | 3 | 0 | 6 |
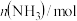 | 0 | 2 | 0 |
平衡时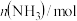 | 0.8 | x |
②在t1时升高甲容器的温度,至t2时再次达到平衡,测得t2时混合气体的平均摩尔质量比tl时小。请在图中画出tl~t2时间段正反应速率的变化示意图

(4)尾气中含有SO2,直接排放会造成环境污染,可用Fe2(SO4)3溶液吸收。某科研团队对pH、c(Fe3+)、温度等因素对SO2最高吸收率的影响进行研究,结果如图:

40℃时SO2的最高吸收率随pH、c(Fe3+)的增大而
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、 H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I: 4NO(g)+4CH3OH(g)+O2(g) 4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
反应 II: 2CO(g)+2CH3ONO(g) CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
反应 III: CH3OOCCOOCH3(1)+4H2(g) HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
(1)请写出煤基合成气[n(CO): n(H2)= 1:2]与氧气间接合成乙二醇(HOCH2CH2OH)的总热化学方程式:________________________________________ ,该反应在较低温条件下能自发进行,则ΔH______ 0 (填“>”、“<”或“=”)。
(2)一定温度下,在 2 L 的密闭容器中投入物质的量均为 0.4mol的CO 和 CH3ONO发生反应 II,10min 达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是________ 。
a. 混合气体总物质的量不再变化
b. 混合气体的密度不再变化
c. 单位时间内生成 CO 和 NO 的物质的量相等
d. CO 和 CH3ONO 的浓度比不再变化
②若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时 NO的体积分数与原平衡时相比______ (填“增大”“相等”“减小”或“不能确定”)。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________ (填字母)。
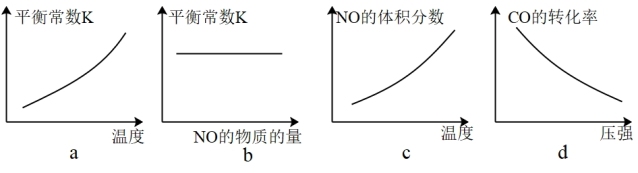
④反应达平衡后向2 L恒容密闭容器中再加入 0.4mol的CO 和 0.4mol NO,化学平衡向________ (填“正反应”、“逆反应”或“平衡不移动”)方向移动。
反应 I: 4NO(g)+4CH3OH(g)+O2(g)
 4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1反应 II: 2CO(g)+2CH3ONO(g)
 CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1反应 III: CH3OOCCOOCH3(1)+4H2(g)
 HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1(1)请写出煤基合成气[n(CO): n(H2)= 1:2]与氧气间接合成乙二醇(HOCH2CH2OH)的总热化学方程式:
(2)一定温度下,在 2 L 的密闭容器中投入物质的量均为 0.4mol的CO 和 CH3ONO发生反应 II,10min 达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是
a. 混合气体总物质的量不再变化
b. 混合气体的密度不再变化
c. 单位时间内生成 CO 和 NO 的物质的量相等
d. CO 和 CH3ONO 的浓度比不再变化
②若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时 NO的体积分数与原平衡时相比
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是

④反应达平衡后向2 L恒容密闭容器中再加入 0.4mol的CO 和 0.4mol NO,化学平衡向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】海洋资源的开发利用具有广阔的前景。
I.海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了如下实验:
海带 海带灰
海带灰 含有I-的溶液
含有I-的溶液 含I2的溶液
含I2的溶液 纯净的I2
纯净的I2
请回答下列问题:
(1)“灼烧”前先将海带用酒精浸润,其目的是___________ 。
(2)“过滤”时除了烧杯外还需使用的玻璃仪器有___________ 。
(3)①从环保角度考虑,“氧化”时最适合加入的氧化剂是___________ (填标号)。
A.氯气 B.硝酸 C.H2O2
②若使用上述选中的氧化剂在酸性条件下氧化,则发生反应的离子方程式为___________ 。
II.硫一碘循环分解水制氢主要涉及下列反应过程:①SO2+2H2O+I2=H2SO4+2HI;②2HI H2+I2;③2H2SO4=2SO2+O2+2H2O
H2+I2;③2H2SO4=2SO2+O2+2H2O
(4)整个过程中作为催化剂的是___________ (填化学式)。
(5)一定温度下,向1L的恒容密闭容器中加入1molHI(g)发生反应②,已知H2的物质的量随时间的变化如图所示,则在0~2min内的平均反应速率v(HI)=___________ mol·L-1·min-1。

(6)实验室用锌粒和稀硫酸制H2,为了增大反应速率下列措施不可行的是___________ (填标号)。
a.加入浓硝酸
b.加热
c.把锌粒换成锌粉
d.用98.3%的浓硫酸代替稀硫酸
(7)氢气可用于制燃料电池,某种氢氧燃料电池是用固体金属氧化物(可传导O2-)作电解质,两极上的电极反应式分别为A极:2H2+2O2--4e-=2H2O;B极:O2+4e-=2O2-。则A极是该氢氧燃料电池的___________ (填“正极”或“负极”),电子从该极___________ (填“流入”或“流出”)。
I.海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了如下实验:
海带
 海带灰
海带灰 含有I-的溶液
含有I-的溶液 含I2的溶液
含I2的溶液 纯净的I2
纯净的I2请回答下列问题:
(1)“灼烧”前先将海带用酒精浸润,其目的是
(2)“过滤”时除了烧杯外还需使用的玻璃仪器有
(3)①从环保角度考虑,“氧化”时最适合加入的氧化剂是
A.氯气 B.硝酸 C.H2O2
②若使用上述选中的氧化剂在酸性条件下氧化,则发生反应的离子方程式为
II.硫一碘循环分解水制氢主要涉及下列反应过程:①SO2+2H2O+I2=H2SO4+2HI;②2HI
 H2+I2;③2H2SO4=2SO2+O2+2H2O
H2+I2;③2H2SO4=2SO2+O2+2H2O(4)整个过程中作为催化剂的是
(5)一定温度下,向1L的恒容密闭容器中加入1molHI(g)发生反应②,已知H2的物质的量随时间的变化如图所示,则在0~2min内的平均反应速率v(HI)=

(6)实验室用锌粒和稀硫酸制H2,为了增大反应速率下列措施不可行的是
a.加入浓硝酸
b.加热
c.把锌粒换成锌粉
d.用98.3%的浓硫酸代替稀硫酸
(7)氢气可用于制燃料电池,某种氢氧燃料电池是用固体金属氧化物(可传导O2-)作电解质,两极上的电极反应式分别为A极:2H2+2O2--4e-=2H2O;B极:O2+4e-=2O2-。则A极是该氢氧燃料电池的
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】化学研究和工业生产中需要关注化学反应的快慢和程度。速率与限度是认识和研究化学反应的重要视角。
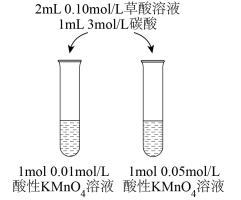
(1)某同学对草酸溶液与酸性高锰酸钾溶液的反应速率影响因素进行研究。该同学采用如图所示的实验方案,拟根据溶液褪色的先后顺序定性探究外界条件对反应速率的影响。
①该同学拟研究的影响因素是_______ 。
②你认为该同学的实验方案_______ (填“合理”或“不合理”),理由是_______ 。
(2)亚硝酰氯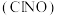 是有机合成中常用试剂,已知:
是有机合成中常用试剂,已知: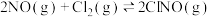
 。在体积为
。在体积为 恒容密闭容器中充入
恒容密闭容器中充入
 和
和
 ,在不同温度下发生反应,
,在不同温度下发生反应,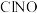 的百分含量随时间的变化如图所示。(已知:
的百分含量随时间的变化如图所示。(已知: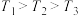 )
)
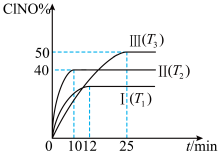
①与实验Ⅰ相比,实验Ⅱ除温度不同外,还改变的条件是_______ 。
②实验Ⅱ反应至 达到平衡,此时
达到平衡,此时 的转化率为
的转化率为_______ (保留1位小数)。
③实验Ⅲ反应至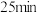 达到平衡,则
达到平衡,则
_______  。
。

(1)某同学对草酸溶液与酸性高锰酸钾溶液的反应速率影响因素进行研究。该同学采用如图所示的实验方案,拟根据溶液褪色的先后顺序定性探究外界条件对反应速率的影响。
①该同学拟研究的影响因素是
②你认为该同学的实验方案
(2)亚硝酰氯
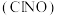 是有机合成中常用试剂,已知:
是有机合成中常用试剂,已知: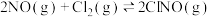
 。在体积为
。在体积为 恒容密闭容器中充入
恒容密闭容器中充入
 和
和
 ,在不同温度下发生反应,
,在不同温度下发生反应,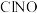 的百分含量随时间的变化如图所示。(已知:
的百分含量随时间的变化如图所示。(已知: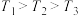 )
)
①与实验Ⅰ相比,实验Ⅱ除温度不同外,还改变的条件是
②实验Ⅱ反应至
 达到平衡,此时
达到平衡,此时 的转化率为
的转化率为③实验Ⅲ反应至
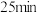 达到平衡,则
达到平衡,则
 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】Ⅰ.由γ羟基丁酸生成γ丁内酯的反应如下:
HOCH2CH2CH2COOH
 +H2O,在298 K下,γ羟基丁酸水溶液的初始浓度为
+H2O,在298 K下,γ羟基丁酸水溶液的初始浓度为
0.180 mol/L,测得γ丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
(1)该反应在50~80 min内的平均反应速率为___________ mol/(L·min)。
(2)120 min时γ羟基丁酸的转化率为___________ 。
Ⅱ.某学习小组欲探究外界条件对化学反应速率的影响,设计实验如下表所示:
(3)写出该探究实验中发生反应的化学方程式___________ ;根据___________ ,可以判断反应进行的快慢。
(4)实验I、II探究的是:其它条件相同时,Na2S2O3溶液的浓度对反应速率的影响,若实验III、IV也想达到与实验I、II相同的探究目的,则X=___________ 。
HOCH2CH2CH2COOH
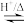
 +H2O,在298 K下,γ羟基丁酸水溶液的初始浓度为
+H2O,在298 K下,γ羟基丁酸水溶液的初始浓度为0.180 mol/L,测得γ丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
| t/min | 21 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| c/(mol·L-1) | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(2)120 min时γ羟基丁酸的转化率为
Ⅱ.某学习小组欲探究外界条件对化学反应速率的影响,设计实验如下表所示:
| 实验序号 | 温度 | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| I | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| II | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| III | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| IV | 35 | 5 | 0.2 | X | 0.2 | Y |
(4)实验I、II探究的是:其它条件相同时,Na2S2O3溶液的浓度对反应速率的影响,若实验III、IV也想达到与实验I、II相同的探究目的,则X=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数如下表所示。请回答下列问题:
(1)根据上述反应可推导出 、
、 与
与 之间的关系:
之间的关系:
_______ ;
(2)根据反应③判断熵变
_______ 0(填“>”“=”或“<”),依据反应自发进行的判据:ΔG=ΔH-TΔS<0时反应可自发进行,判断:在_______ (填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃下,测得反应③在某时刻时,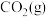 、
、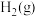 、
、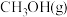 、
、 的浓度分别为
的浓度分别为 、
、 、
、 、
、 ,则此时v正
,则此时v正____ v逆(填“>”“=”或“<”)。
(4)提高反应③的反应速率且增大 的产率,可采取的措施_______。
的产率,可采取的措施_______。
(5) 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图1所示。反应④完成之后,以
排放并实现资源利用,原理如图1所示。反应④完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 、
、 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳。
,在催化剂上有积碳。
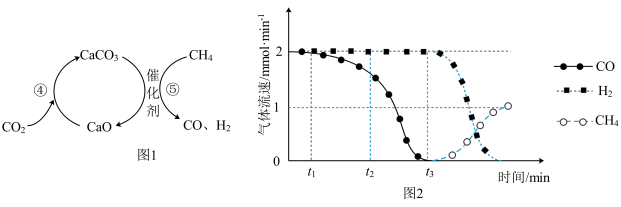
则反应⑤的化学方程式为_______ ,下列叙述正确的是_______ 。
A.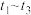 ,
, 比
比 多,且生成
多,且生成 速率不变,有可能是发生副反应
速率不变,有可能是发生副反应
B. 时刻,副反应生成
时刻,副反应生成 的速率大于反应⑤生成
的速率大于反应⑤生成 速率
速率
C. 之后,生成
之后,生成 的速率为0,是因为反应⑤不再发生
的速率为0,是因为反应⑤不再发生
| 化学反应 | 平衡常数 | |||
| 500℃ | 700℃ | 800℃ | ||
①  |  | 2.5 | 0.34 | 0.15 |
②  |  | 1.0 | 1.70 | 2.52 |
③  |  | |||
 、
、 与
与 之间的关系:
之间的关系:
(2)根据反应③判断熵变

(3)500℃下,测得反应③在某时刻时,
 、
、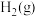 、
、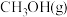 、
、 的浓度分别为
的浓度分别为 、
、 、
、 、
、 ,则此时v正
,则此时v正(4)提高反应③的反应速率且增大
 的产率,可采取的措施_______。
的产率,可采取的措施_______。| A.扩大反应容器的容积 | B.使用合适的催化剂 |
| C.缩小反应容器的容积 | D.从平衡体系中及时分离出 |
 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图1所示。反应④完成之后,以
排放并实现资源利用,原理如图1所示。反应④完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 、
、 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳。
,在催化剂上有积碳。
则反应⑤的化学方程式为
A.
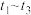 ,
, 比
比 多,且生成
多,且生成 速率不变,有可能是发生副反应
速率不变,有可能是发生副反应
B.
 时刻,副反应生成
时刻,副反应生成 的速率大于反应⑤生成
的速率大于反应⑤生成 速率
速率C.
 之后,生成
之后,生成 的速率为0,是因为反应⑤不再发生
的速率为0,是因为反应⑤不再发生
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】硫酸厂排放的尾气中常含有较多的 ,为防止其污染空气,常用还原法对其进行处理。其中之一为
,为防止其污染空气,常用还原法对其进行处理。其中之一为 还原法,反应原理为
还原法,反应原理为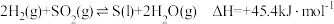 。
。
(1)已知: 的燃烧热
的燃烧热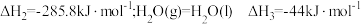 。则表示液态硫
。则表示液态硫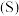 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为_______ 。
(2)不同催化剂下的反应机理不尽相同,如图为以氧化铝为载体催化下的反应机理示意图,已知第一步反应在 下进行,第二步反应在
下进行,第二步反应在 下进行。
下进行。
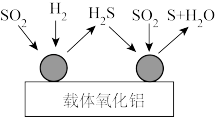
①根据图示写出第一步反应的化学方程式:_______ 。
② 是非常活泼的还原剂,以
是非常活泼的还原剂,以 为还原剂最大的优点是在低温下有较高的吸收率,缺点是
为还原剂最大的优点是在低温下有较高的吸收率,缺点是_______ (写一条即可)。
(3)一定温度下,向 恒容密闭容器内充入
恒容密闭容器内充入 和
和 发生
发生 ,体系中
,体系中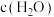 与反应时间
与反应时间 的关系如图所示。
的关系如图所示。
①指定温度下,该反应的平衡常数的计算式为_______ 。
②下列判断正确的是_______ (填字母)。
a. 时反应均未达平衡,且
时反应均未达平衡,且 时v逆大于
时v逆大于 时v逆
时v逆
b.混合气体密度不再变化时,说明该反应达平衡
c.其他条件不变,平衡后将容器容积压缩至 ,达到新平衡,
,达到新平衡,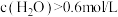
d.其他条件不变,平衡后再向容器中加入 和
和 ,达到新平衡时,
,达到新平衡时, 转化率不变
转化率不变
(4)某温度下,向 恒容密闭容器中按照物质的量之比为
恒容密闭容器中按照物质的量之比为 充入
充入 和
和 混合气发生
混合气发生 ,反应进行到不同时间测得各物质的浓度如图所示。
,反应进行到不同时间测得各物质的浓度如图所示。

①对比平衡常数的大小,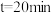 时
时
_______ 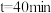 时
时 (填“大于”“小于”或“等于”),说明原因
(填“大于”“小于”或“等于”),说明原因_______ 。
②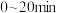 时,反应速率表示为
时,反应速率表示为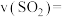
_______ 。
 ,为防止其污染空气,常用还原法对其进行处理。其中之一为
,为防止其污染空气,常用还原法对其进行处理。其中之一为 还原法,反应原理为
还原法,反应原理为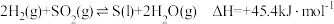 。
。(1)已知:
 的燃烧热
的燃烧热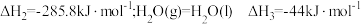 。则表示液态硫
。则表示液态硫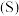 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(2)不同催化剂下的反应机理不尽相同,如图为以氧化铝为载体催化下的反应机理示意图,已知第一步反应在
 下进行,第二步反应在
下进行,第二步反应在 下进行。
下进行。
①根据图示写出第一步反应的化学方程式:
②
 是非常活泼的还原剂,以
是非常活泼的还原剂,以 为还原剂最大的优点是在低温下有较高的吸收率,缺点是
为还原剂最大的优点是在低温下有较高的吸收率,缺点是(3)一定温度下,向
 恒容密闭容器内充入
恒容密闭容器内充入 和
和 发生
发生 ,体系中
,体系中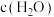 与反应时间
与反应时间 的关系如图所示。
的关系如图所示。
①指定温度下,该反应的平衡常数的计算式为
②下列判断正确的是
a.
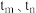 时反应均未达平衡,且
时反应均未达平衡,且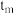 时v逆大于
时v逆大于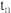 时v逆
时v逆b.混合气体密度不再变化时,说明该反应达平衡
c.其他条件不变,平衡后将容器容积压缩至
 ,达到新平衡,
,达到新平衡,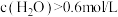
d.其他条件不变,平衡后再向容器中加入
 和
和 ,达到新平衡时,
,达到新平衡时, 转化率不变
转化率不变(4)某温度下,向
 恒容密闭容器中按照物质的量之比为
恒容密闭容器中按照物质的量之比为 充入
充入 和
和 混合气发生
混合气发生 ,反应进行到不同时间测得各物质的浓度如图所示。
,反应进行到不同时间测得各物质的浓度如图所示。
①对比平衡常数的大小,
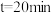 时
时
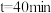 时
时 (填“大于”“小于”或“等于”),说明原因
(填“大于”“小于”或“等于”),说明原因②
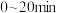 时,反应速率表示为
时,反应速率表示为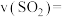
您最近一年使用:0次
【推荐3】汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)⇌N2(g)+2CO2(g),请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-l
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-l
则2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的△H=____ kJ·mol-l。
(2)一定温度下,向体积为 1 L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1 mol,n(NO)=0.2 mol,n(N2)= a mol,且N2占平衡总体积的 。
。
①则该反应的平衡常数K=______ 。若保持温度及容器体积不变,平衡后在此基础上再向容器中充入3a mol的N2、0.2 mol的NO,平衡将______ 移动(填“向左”、“向右”或“不”)。
②下列各种情况,可说明该反应已经达到平衡的是______ 。
A.v生成(CO2)= v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n molN≡N
③在t2时刻,将容器迅速压缩到原容积的 ,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线
,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线_________ 。

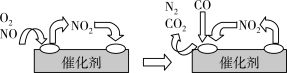
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。写出上述变化中的总化学反应方程式_________ 。
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-l
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-l
则2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的△H=
(2)一定温度下,向体积为 1 L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1 mol,n(NO)=0.2 mol,n(N2)= a mol,且N2占平衡总体积的
 。
。 ①则该反应的平衡常数K=
②下列各种情况,可说明该反应已经达到平衡的是
A.v生成(CO2)= v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n molN≡N
③在t2时刻,将容器迅速压缩到原容积的
 ,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线
,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。写出上述变化中的总化学反应方程式

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题
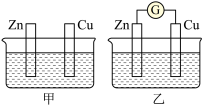
(1)以下叙述中,正确的是______ 。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大
D.乙中电流从铜片经导线流向锌片
E.乙溶液中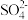 向铜片方向移动
向铜片方向移动
(2)变化过程中能量转化的形式主要是:甲为____ ;乙为_____ 。
(3)若反应过程中有 电子发生转移,则生成的氢气在标况下的体积为
电子发生转移,则生成的氢气在标况下的体积为__________
(4)原电池在工作时,下列反应不可能作为原电池工作时发生的反应的是:______
A.
B.
C.
D.

(1)以下叙述中,正确的是
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大
D.乙中电流从铜片经导线流向锌片
E.乙溶液中
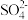 向铜片方向移动
向铜片方向移动(2)变化过程中能量转化的形式主要是:甲为
(3)若反应过程中有
 电子发生转移,则生成的氢气在标况下的体积为
电子发生转移,则生成的氢气在标况下的体积为(4)原电池在工作时,下列反应不可能作为原电池工作时发生的反应的是:
A.
B.
C.

D.
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________ ;

②根据下表数据,计算生成1molNH3时该反应放出的热量为______ kJ;
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应,5min达到平衡,测得c(NH3)=0.4mol/L,则O至5min时 (N2)=
(N2)=______ ,反应开始与平衡时气体的物质的量之比为__________ ;
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:

①装置甲甲SO42-向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是____ ;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后.取出洗净、干燥、称量.两电极质量差为6g。则导线中通过电子的物质的量为______ mol。
(1)已知一定条件下,反应N2+3H2
 2NH3为放热反应;:
2NH3为放热反应;:①下图能正确表示该反应中能量变化的是

②根据下表数据,计算生成1molNH3时该反应放出的热量为
| 化学键 | H-H | N≡N | N-H |
| 断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应,5min达到平衡,测得c(NH3)=0.4mol/L,则O至5min时
 (N2)=
(N2)=(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:

①装置甲甲SO42-向
②四种金属活动性由强到弱的顺序是
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后.取出洗净、干燥、称量.两电极质量差为6g。则导线中通过电子的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】燃料电池作为安全性能较好的一类化学电源得到了广泛的应用。可作燃料的物质有甲烷、肼(H2N-NH2)等,燃料电池结构如图所示。
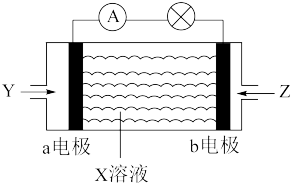
(1)在常温下,甲烷的燃烧热△H为-890.31 kJ/mol,写出甲烷燃烧的热化学方程式:_____ 。
(2)若X溶液为NaOH溶液,Y发生氧化反应,则Y为___ (填“甲烷”或“氧气”),a电极的电极反应式为_____ 。
(3)若用肼作燃料,负极的电极反应式为N2H4-4e-+4OH-=4H2O+N2↑ 。
①N2的电子式是______ 。
②根据上述肼的电极反应式,X可能是_____ (填“NaOH”或“H2SO4”)。
③每转移2 mol电子时,产生标准状况下N2的体积是_______ 。

(1)在常温下,甲烷的燃烧热△H为-890.31 kJ/mol,写出甲烷燃烧的热化学方程式:
(2)若X溶液为NaOH溶液,Y发生氧化反应,则Y为
(3)若用肼作燃料,负极的电极反应式为N2H4-4e-+4OH-=4H2O+N2↑ 。
①N2的电子式是
②根据上述肼的电极反应式,X可能是
③每转移2 mol电子时,产生标准状况下N2的体积是
您最近一年使用:0次



