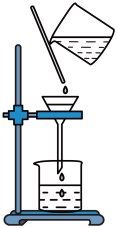
Na2S2O4 (保险粉)是一种强还原剂,锌粉法制备Na2S2O4的原理为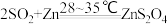 、
、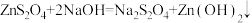 ,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
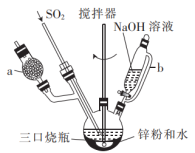
(1)仪器a中盛放的药品是___________ (填名称),导管b的作用是___________ 。
(2)实验开始前,需要向三口烧瓶中充满N2,目的是___________ 。
(3)通入三口烧瓶中的SO2是由铜屑与浓硫酸反应制得的,生成SO2的化学方程式为___________ 。
(4)制备Na2S2O4时,三口烧瓶的加热方式是___________ 。
(5)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤、酒精洗涤及干燥得产品。加入NaCl固体的作用是___________ ,酒精洗涤的目的是___________ 。
(6)取a g产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用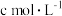 的
的 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗 标准溶液V mL。
标准溶液V mL。
已知: 被还原为
被还原为 ,
,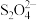 被氧化为
被氧化为 。
。
①滴定反应的离子方程式为___________ 。
②产品中Na2S2O4的质量分数为___________ 。(列出计算式)。
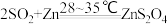 、
、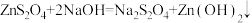 ,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
(1)仪器a中盛放的药品是
(2)实验开始前,需要向三口烧瓶中充满N2,目的是
(3)通入三口烧瓶中的SO2是由铜屑与浓硫酸反应制得的,生成SO2的化学方程式为
(4)制备Na2S2O4时,三口烧瓶的加热方式是
(5)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤、酒精洗涤及干燥得产品。加入NaCl固体的作用是
(6)取a g产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用
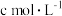 的
的 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗 标准溶液V mL。
标准溶液V mL。已知:
 被还原为
被还原为 ,
,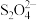 被氧化为
被氧化为 。
。①滴定反应的离子方程式为
②产品中Na2S2O4的质量分数为
2021·陕西安康·一模 查看更多[4]
陕西省安康市2021届高三第一次教学质量联考化学试题(已下线)大题03 无机制备类实验题-【考前抓大题】备战2021年高考化学(全国通用)(已下线)重点4 物质制备分析-2021年高考化学【热点·重点·难点】专练(新高考)陕西省宝鸡市陈仓区2021届高三第二次教学质量检测理科综合化学试题
更新时间:2021-01-21 21:19:40
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】为验证化学反应“2Fe3++2I-=2Fe2++I2”是可逆反应,并探究平衡移动与物质的浓度、性质的关系,甲、乙两同学进行如下实验。
已知:a.含I2的溶液呈黄色或棕黄色。
b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
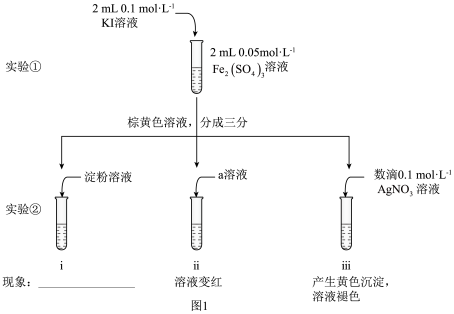
I.甲同学设计下列实验进行相关探究,实验如图1所示。
回答下列问题:
(1)甲同学利用实验②中ⅰ和ⅱ证明Fe2(SO4)3溶液与KI溶液的反应为可逆反应,实验ⅰ中的现象是_____ ,实验ⅱ中a是_____ (填化学式)溶液。
(2)用离子方程式表示实验②ⅲ中产生黄色沉淀的原因_____ 。
II.乙同学:利用色度计对Fe2(SO4)3溶液与KI溶液的反应进行再次探究。
【实验过程】
实验中溶液的透光率数据变化如图2所示。

回答下列问题:
(3)乙同学实验③的目的是_____ 。
(4)乙同学通过透光率变化推断:FeCl3溶液与KI溶液的反应为可逆反应.理由是_____ 。
(5)乙同学根据氧化还原反应的规律,用图3装置(a、b均为石墨电极),探究化学平衡移动与I-、Fe2+的浓度及还原性强弱关系,操作过程如图:
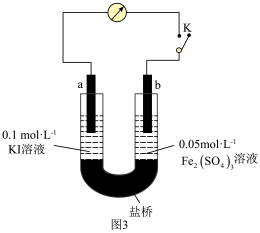
①K闭合时,电流计指针向右偏转,乙同学得出结论:2Fe3++2I- 2Fe2++I2向正反应方向进行,b作
2Fe2++I2向正反应方向进行,b作______ (填“正”或“负”)极,还原性I->Fe2+。
②当指针归零(反应达到平衡)后,向U型管右管滴加0.1mol•L-1FeSO4溶液,电流计指针向左偏转,由此得出还原性为Fe2+______ I-(填“>”或“<”)。
(6)综合甲、乙两位同学的实验探究过程,可得出结论:2Fe3++2I-=2Fe2++I2为可逆反应,改变条件可使平衡移动;Fe3+和I2的氧化性强弱受______ 影响。
已知:a.含I2的溶液呈黄色或棕黄色。
b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
I.甲同学设计下列实验进行相关探究,实验如图1所示。

回答下列问题:
(1)甲同学利用实验②中ⅰ和ⅱ证明Fe2(SO4)3溶液与KI溶液的反应为可逆反应,实验ⅰ中的现象是
(2)用离子方程式表示实验②ⅲ中产生黄色沉淀的原因
II.乙同学:利用色度计对Fe2(SO4)3溶液与KI溶液的反应进行再次探究。
【实验过程】
| 序号 | 实验步骤1 | 实验步骤2 |
| 实验③ | 将盛有2mL蒸馏水的比色皿放入色度计的槽孔中 | 向比色皿中逐滴滴入5滴(每滴约0.025mL)0.05mol•L-1Fe2(SO4)3溶液,同时采集溶液的透光率数据 |
| 实验④ | 将盛有2mL0.1mol•L-1KI溶液的比色皿放入色度计的槽孔中 | 同上 |
| 实验⑤ | 将盛有2mL0.2mol•L-1KI溶液的比色皿放入色度计的槽孔中 | 同上 |

回答下列问题:
(3)乙同学实验③的目的是
(4)乙同学通过透光率变化推断:FeCl3溶液与KI溶液的反应为可逆反应.理由是
(5)乙同学根据氧化还原反应的规律,用图3装置(a、b均为石墨电极),探究化学平衡移动与I-、Fe2+的浓度及还原性强弱关系,操作过程如图:

①K闭合时,电流计指针向右偏转,乙同学得出结论:2Fe3++2I-
 2Fe2++I2向正反应方向进行,b作
2Fe2++I2向正反应方向进行,b作②当指针归零(反应达到平衡)后,向U型管右管滴加0.1mol•L-1FeSO4溶液,电流计指针向左偏转,由此得出还原性为Fe2+
(6)综合甲、乙两位同学的实验探究过程,可得出结论:2Fe3++2I-=2Fe2++I2为可逆反应,改变条件可使平衡移动;Fe3+和I2的氧化性强弱受
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】联氨(又称联肼, ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为___________ ,其中氮的化合价为___________
(2)联氨为二元弱碱,第一步电离: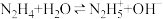 该步平衡常数的值为
该步平衡常数的值为___________ (已知: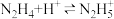 的
的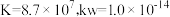 )
)
(3)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是___________ 联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。与使用Na2SO3处理水中溶解的O2相比,联氨的优点是___________
 ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:(1)联氨分子的电子式为
(2)联氨为二元弱碱,第一步电离:
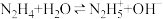 该步平衡常数的值为
该步平衡常数的值为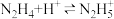 的
的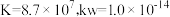 )
)(3)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】亚氯酸钠(NaClO2)是一种高效氧化剂和优质漂白剂。一种以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:

已知:
①纯ClO2易分解爆炸,空气中ClO2 的体积分数在10%以下比较安全;
②NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
③含水NaClO2受热易分解。
(1)试剂A可以选择___________ (填字母序号)。
a. SO2 b. 浓硝酸 c. KMnO4
(2)反应Ⅱ的离子方程式为___________ 。
(3)下列关于上述流程的说法中,合理的是___________ (填字母序号)。
a. 反应Ⅰ进行过程中应持续鼓入空气
b. 反应Ⅰ后得到的母液中,溶质的主要成分是NaCl
c. 反应Ⅱ中NaOH 应过量
(4)已知压强越大,物质的沸点越高。反应Ⅱ结束后采用“减压蒸发”操作的原因是___________ 。
(5)中间产物二氧化氯(ClO2)在生产生活中也有广泛应用。用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2和CO2.若处理含NaCN4×10-5mol ·L-1的废水 1000L,至少需要ClO2的质量为___________ g.

已知:
①纯ClO2易分解爆炸,空气中ClO2 的体积分数在10%以下比较安全;
②NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
③含水NaClO2受热易分解。
(1)试剂A可以选择
a. SO2 b. 浓硝酸 c. KMnO4
(2)反应Ⅱ的离子方程式为
(3)下列关于上述流程的说法中,合理的是
a. 反应Ⅰ进行过程中应持续鼓入空气
b. 反应Ⅰ后得到的母液中,溶质的主要成分是NaCl
c. 反应Ⅱ中NaOH 应过量
(4)已知压强越大,物质的沸点越高。反应Ⅱ结束后采用“减压蒸发”操作的原因是
(5)中间产物二氧化氯(ClO2)在生产生活中也有广泛应用。用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2和CO2.若处理含NaCN4×10-5mol ·L-1的废水 1000L,至少需要ClO2的质量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如图。
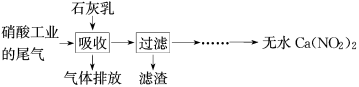
已知:
4NO2+2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O
NO+NO2+Ca(OH)2=Ca(NO2)2+H2O
(1)用化学方程式表示工业生产硝酸产生NO尾气的原因_______ 。
(2)上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是_______ ;滤渣可循环使用,滤渣的主要成分是_______ (填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。若n(NO)∶n(NO2)>1∶1,则会导致_______ ;若n(NO)∶n(NO2)<1∶1,则会导致_______ 。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为_______ 。

已知:
4NO2+2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O
NO+NO2+Ca(OH)2=Ca(NO2)2+H2O
(1)用化学方程式表示工业生产硝酸产生NO尾气的原因
(2)上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。若n(NO)∶n(NO2)>1∶1,则会导致
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热的仪器已略)。
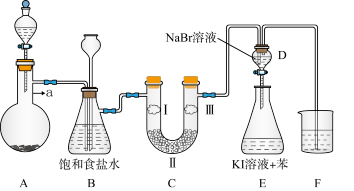
(1)实验室制备氯气离子方程式为_______ 。
(2)装置B中饱和食盐水的作用是_______ ,装置B还起到_______ 作用。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放_______ 。
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,离子反应方程为:_______ 。
(5)你认为在实验中装置F最合理的试剂为_______ (填字母)。
(6)二氧化氯气体能代替氯气消毒自来水。50L 0.1mol/L的 溶液恰好与一定量的
溶液恰好与一定量的 反应完全,则
反应完全,则 的物质的量是
的物质的量是_______ 已知 反应生成
反应生成 )。
)。

(1)实验室制备氯气离子方程式为
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 水 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)你认为在实验中装置F最合理的试剂为_______ (填字母)。
| A.NaOH溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D. |
 溶液恰好与一定量的
溶液恰好与一定量的 反应完全,则
反应完全,则 的物质的量是
的物质的量是 反应生成
反应生成 )。
)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】KMnO4常作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(1)向K2MnO4溶液中通入足量CO2可制得KMnO4,副产物是黑色沉淀M。该反应中氧化剂与还原剂的质量之比为_____ 。在锂离子有机高聚物中锂与M构成原电池,消耗8.7 g M时转移 0.1 mol电子。该电池正极的电极反应式为_____________ 。
(2)实验室用KMnO4制备O2和Cl2。取0.4 mol KMnO4固体加热一段时间后,收集到a mol O2,在反应后的残留固体中加入足量浓盐酸,加热又收集到b mol Cl2。设锰元素全部转化成Mn2+存在于溶液中,当a+b=0.8时,在标准状况下生成Cl2的体积为____ L。
(3)电解K2MnO4溶液可以制备KMnO4。工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,该反应的化学方程式为____________ 。用镍片(不参与反应)作阳极,铁板作阴极,电解K2MnO4溶液可制备KMnO4。上述过程用流程图表示如下:

则D的化学式为____ ;阳极的电极反应式为___________ ;阳离子的迁移方向是____________ 。
(4)废液中c(Mn2+)较大时会污染水体。实验室可用过二硫酸铵[(NH4)2S2O8]溶液检验废水中的Mn2+,实验现象是溶液变紫红色(还原产物为 )。过二硫酸可以看成是H2O2的衍生物,过二硫酸铵中含有过氧键(—O—O—)。写出检验Mn2+时发生反应的离子方程式:
)。过二硫酸可以看成是H2O2的衍生物,过二硫酸铵中含有过氧键(—O—O—)。写出检验Mn2+时发生反应的离子方程式:____________ ;如果将这个反应设计成双液(或双桶)电池,盐桥中的溶液用____ (填“饱和KCl溶液”、“饱和K2SO4溶液”或“饱和NH4Cl溶液”)。
(1)向K2MnO4溶液中通入足量CO2可制得KMnO4,副产物是黑色沉淀M。该反应中氧化剂与还原剂的质量之比为
(2)实验室用KMnO4制备O2和Cl2。取0.4 mol KMnO4固体加热一段时间后,收集到a mol O2,在反应后的残留固体中加入足量浓盐酸,加热又收集到b mol Cl2。设锰元素全部转化成Mn2+存在于溶液中,当a+b=0.8时,在标准状况下生成Cl2的体积为
(3)电解K2MnO4溶液可以制备KMnO4。工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,该反应的化学方程式为

则D的化学式为
(4)废液中c(Mn2+)较大时会污染水体。实验室可用过二硫酸铵[(NH4)2S2O8]溶液检验废水中的Mn2+,实验现象是溶液变紫红色(还原产物为
 )。过二硫酸可以看成是H2O2的衍生物,过二硫酸铵中含有过氧键(—O—O—)。写出检验Mn2+时发生反应的离子方程式:
)。过二硫酸可以看成是H2O2的衍生物,过二硫酸铵中含有过氧键(—O—O—)。写出检验Mn2+时发生反应的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】钴配合物 溶于热水,在冷水中微溶,可通过如下反应制备:
溶于热水,在冷水中微溶,可通过如下反应制备: 。
。
具体步骤如下:
Ⅰ.称取 ,用
,用 水溶解。
水溶解。
Ⅱ.分批加入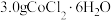 后,将溶液温度降至
后,将溶液温度降至 以下,加入
以下,加入 活性炭、
活性炭、 浓氨水,搅拌下逐滴加入
浓氨水,搅拌下逐滴加入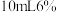 的双氧水。
的双氧水。
Ⅲ.加热至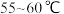 反应
反应 。冷却,过滤。
。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的 沸水中,趁热过滤。
沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入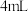 浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
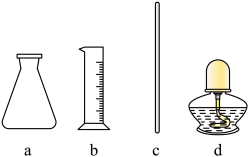
(1)步骤Ⅰ中使用的部分仪器如下。_______ 。加快NH4Cl溶解的操作有_______ 。
(2)步骤Ⅱ中,将温度降至10℃以下以避免_______ 、_______ ;可选用_______ 降低溶液温度。
(3)指出下列过滤操作中不规范之处:_______ 。_______ 。
(5)步骤Ⅴ中加入浓盐酸的目的是_______ 。
 溶于热水,在冷水中微溶,可通过如下反应制备:
溶于热水,在冷水中微溶,可通过如下反应制备: 。
。具体步骤如下:
Ⅰ.称取
 ,用
,用 水溶解。
水溶解。Ⅱ.分批加入
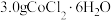 后,将溶液温度降至
后,将溶液温度降至 以下,加入
以下,加入 活性炭、
活性炭、 浓氨水,搅拌下逐滴加入
浓氨水,搅拌下逐滴加入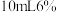 的双氧水。
的双氧水。Ⅲ.加热至
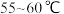 反应
反应 。冷却,过滤。
。冷却,过滤。Ⅳ.将滤得的固体转入含有少量盐酸的
 沸水中,趁热过滤。
沸水中,趁热过滤。Ⅴ.滤液转入烧杯,加入
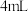 浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。回答下列问题:
(1)步骤Ⅰ中使用的部分仪器如下。
(2)步骤Ⅱ中,将温度降至10℃以下以避免
(3)指出下列过滤操作中不规范之处:
(5)步骤Ⅴ中加入浓盐酸的目的是
您最近一年使用:0次
【推荐2】按要求完成下列问题。
(1)分别用等体积的下列液体洗涤BaSO4沉淀,造成BaSO4的损失量大的是_______ (填标号)。
a.0.010mol/L硫酸 b.蒸馏水
(2)在常温下,实验测得0.1mol/LCH3COONa溶液的pH=9,则溶液中由水电离出来的c(OH-)=_______ 。
(3)电解精炼铜,阳极的主要电极反应为_______ 。
(4)SOCl2是一种液态化合物,沸点为77℃。在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,发生剧烈反应,液面上有白雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出。则SOCl2和水反应的化学方程式为:_______ 。
(1)分别用等体积的下列液体洗涤BaSO4沉淀,造成BaSO4的损失量大的是
a.0.010mol/L硫酸 b.蒸馏水
(2)在常温下,实验测得0.1mol/LCH3COONa溶液的pH=9,则溶液中由水电离出来的c(OH-)=
(3)电解精炼铜,阳极的主要电极反应为
(4)SOCl2是一种液态化合物,沸点为77℃。在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,发生剧烈反应,液面上有白雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出。则SOCl2和水反应的化学方程式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】 I.科学家一直致力于“人工固氮”的新方法研究。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O(l) 4NH3(g)+3O2 (g) ΔH=a kJ·mol-1
4NH3(g)+3O2 (g) ΔH=a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
①此合成反应的a______ 0 (填“>”“<”或“=”)
②已知:
N2 (g) + 3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1,
2NH3(g) ΔH=-92.4kJ·mol-1,
2H2 (g) + O2 (g)===2H2O (l) ΔH=-571.6kJ·mol-1,
则2N2 (g) + 6H2O(l) 4NH3(g) + 3O2 (g) ΔH=
4NH3(g) + 3O2 (g) ΔH=____________ ;
(2)用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而减小的是___________ (填字母标号)
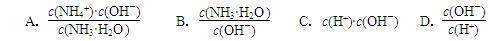
Ⅱ.工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。
(1)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2SO2 (g) + O2(g) 2SO3(g) ΔH=-196.0kJ·mol-1
2SO3(g) ΔH=-196.0kJ·mol-1
①容器体积不变时,为了提高SO2的转化率,可采用的措施是____________ (填字母标号)
②某温度时,在一个容积为10L的密闭容器中充入4.0 molSO2和2.0 molO2,半分钟后达到平衡,并放出352.8kJ的热量。此时SO2的转化率是______ ,该温度下的平衡常数K=________ ;
(2)已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将________ (填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将________ 。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O(l)
 4NH3(g)+3O2 (g) ΔH=a kJ·mol-1
4NH3(g)+3O2 (g) ΔH=a kJ·mol-1进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a
②已知:
N2 (g) + 3H2(g)
 2NH3(g) ΔH=-92.4kJ·mol-1,
2NH3(g) ΔH=-92.4kJ·mol-1,2H2 (g) + O2 (g)===2H2O (l) ΔH=-571.6kJ·mol-1,
则2N2 (g) + 6H2O(l)
 4NH3(g) + 3O2 (g) ΔH=
4NH3(g) + 3O2 (g) ΔH=(2)用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而减小的是
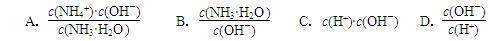
Ⅱ.工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。
(1)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2SO2 (g) + O2(g)
 2SO3(g) ΔH=-196.0kJ·mol-1
2SO3(g) ΔH=-196.0kJ·mol-1①容器体积不变时,为了提高SO2的转化率,可采用的措施是
| A.加入V2O5作催化剂 | B.使用过量SO2 | C.高温 | D.通入过量空气 |
②某温度时,在一个容积为10L的密闭容器中充入4.0 molSO2和2.0 molO2,半分钟后达到平衡,并放出352.8kJ的热量。此时SO2的转化率是
(2)已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】亚硝酰氯( ,熔点:
,熔点: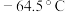 ,沸点:
,沸点: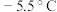 )是一种黄色气体,遇水易水解生成
)是一种黄色气体,遇水易水解生成 和
和 。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气 和
和 ,制备装置如图所示:
,制备装置如图所示:

为制备纯净干燥的气体,补充下表中缺少的药品
(2)乙组同学利用甲组制得的 和
和 制备
制备 ,装置如图所示:
,装置如图所示:
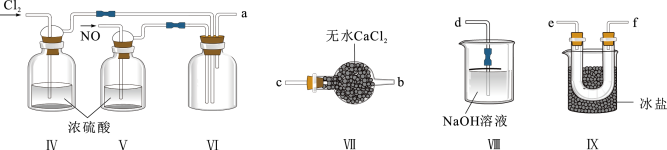
① 分子中各原子均满足8电子稳定结构,则
分子中各原子均满足8电子稳定结构,则 的电子式为
的电子式为___________ ;
②装置连接顺序为a→___________ (按气流自左向右方向,用小写字母表示);
③装置Ⅳ、Ⅴ除了可进一步干燥 、
、 外,另一作用是
外,另一作用是___________ ;
④装置Ⅶ的作用是___________ ;
⑤装置Ⅷ中吸收尾气时, 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
 ,熔点:
,熔点: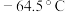 ,沸点:
,沸点: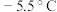 )是一种黄色气体,遇水易水解生成
)是一种黄色气体,遇水易水解生成 和
和 。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。(1)甲组的同学拟制备原料气
 和
和 ,制备装置如图所示:
,制备装置如图所示:
为制备纯净干燥的气体,补充下表中缺少的药品
| 装置I | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
制备纯净的 |  | ① | ② |
制备纯净的 |  | ③ | ④ |
 和
和 制备
制备 ,装置如图所示:
,装置如图所示:
①
 分子中各原子均满足8电子稳定结构,则
分子中各原子均满足8电子稳定结构,则 的电子式为
的电子式为②装置连接顺序为a→
③装置Ⅳ、Ⅴ除了可进一步干燥
 、
、 外,另一作用是
外,另一作用是④装置Ⅶ的作用是
⑤装置Ⅷ中吸收尾气时,
 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下流程制得:
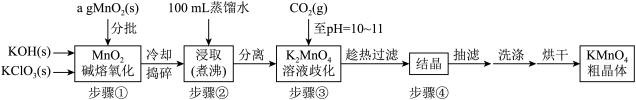
已知:①在碱性条件下,二价锰以Mn(OH)2形式稳定存在,三价锰以MnOOH形式稳定存在。Mn(OH)2和MnOOH均难溶于水和碱性溶液。
②无水MnSO4晶体熔点700℃,在不同温度下它和MnOOH固体受热发生分解:
4MnSO4 2Mn2O3+4SO2↑+O2↑;2MnOOH
2Mn2O3+4SO2↑+O2↑;2MnOOH Mn2O3+H2O↑。
Mn2O3+H2O↑。
③步骤1中KOH、KClO3的量可确保MnO2完全氧化转化,K2MnO4溶液显绿色。相关物质的溶解度数据见下表:
请回答:
(1)下列说法正确的是___________ 。
A步骤③中的CO2也可以用稀盐酸、稀醋酸来代替
B步骤③中取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明K2MnO4歧化反应已完全
C为加快烘干速率,降低能耗,提高效益,烘干时可快速升温烘干
(2)步骤③中,K2MnO4歧化反应(还原产物为MnO2)的方程式是_____ ,当溶液pH值达10~11时,停止通CO2:若CO2过多,可能造成的后果及原因是_____ 。
(3)通过用草酸(H2C2O4)滴定KMnO4溶液的方法可测定KMnO4产品的收率(即产率)。实验时先将所得产品ag溶解在蒸馏水中,加水定容至250mL,取出25.00mL于锥形瓶中,用cmol·L-1的草酸标准溶液来滴定,消耗标准液体积为VmL。则KMnO4产品的收率为______ (用含字母的式子表示,且化至最简)。
(4)由MnSO4溶液制备较纯净Mn2O3请设计实验方案:向MnSO4溶液中___________ ,72h后得到产品Mn2O3。(须使用的试剂:0.2mol·L‑1氨水、3%H2O2溶液、BaCl2溶液、热水

已知:①在碱性条件下,二价锰以Mn(OH)2形式稳定存在,三价锰以MnOOH形式稳定存在。Mn(OH)2和MnOOH均难溶于水和碱性溶液。
②无水MnSO4晶体熔点700℃,在不同温度下它和MnOOH固体受热发生分解:
4MnSO4
 2Mn2O3+4SO2↑+O2↑;2MnOOH
2Mn2O3+4SO2↑+O2↑;2MnOOH Mn2O3+H2O↑。
Mn2O3+H2O↑。③步骤1中KOH、KClO3的量可确保MnO2完全氧化转化,K2MnO4溶液显绿色。相关物质的溶解度数据见下表:
| 20℃ | K2CO3 | KHCO3 | K2MnO4 | KMnO4 |
| S(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
请回答:
(1)下列说法正确的是
A步骤③中的CO2也可以用稀盐酸、稀醋酸来代替
B步骤③中取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明K2MnO4歧化反应已完全
C为加快烘干速率,降低能耗,提高效益,烘干时可快速升温烘干
(2)步骤③中,K2MnO4歧化反应(还原产物为MnO2)的方程式是
(3)通过用草酸(H2C2O4)滴定KMnO4溶液的方法可测定KMnO4产品的收率(即产率)。实验时先将所得产品ag溶解在蒸馏水中,加水定容至250mL,取出25.00mL于锥形瓶中,用cmol·L-1的草酸标准溶液来滴定,消耗标准液体积为VmL。则KMnO4产品的收率为
(4)由MnSO4溶液制备较纯净Mn2O3请设计实验方案:向MnSO4溶液中
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】重铬酸钾(K2Cr2O7)在皮革、火柴、印染化学、电镀等方面应用广泛。回答下列问题:
(1)酒驾醉驾危害社会安全,早期测定是否饮酒的方法是重铬酸钾法:溶液由橙红色变为绿色(Cr3+)则表明已经饮酒。写出重铬酸钾法检验饮酒的离子方程式:___________________________ 。
(2)用铬铁矿(FeO•Cr2O3,含Al2O3杂质)为原料制备重铬酸钾的工艺:

已知:i. 2CrO42﹣+2H+ Cr2O72﹣+H2O;
Cr2O72﹣+H2O;
ii.常温,Ksp[Al(OH)3]=1.3×10﹣33;
iii.有关物质的溶解度曲线如图:

①上述工艺流程图中的操作I的主要反应为:2FeO•Cr2O3+4Na2CO3+7NaNO3 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,另外一个反应的化学方程式是
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,另外一个反应的化学方程式是__________ 。
②滤渣2的成分是_____ (写化学式),常温,滤液中,c(Al3+)=_____ mol•L﹣1
③工艺流程图中,操作“调节pH”的作用是_________________________________ 。
④操作Ⅲ,加入KCl的目的是________________________________________ ;实验室中,操作IV用到的玻璃仪器有酒精灯、烧杯、___________________ 。
(1)酒驾醉驾危害社会安全,早期测定是否饮酒的方法是重铬酸钾法:溶液由橙红色变为绿色(Cr3+)则表明已经饮酒。写出重铬酸钾法检验饮酒的离子方程式:
(2)用铬铁矿(FeO•Cr2O3,含Al2O3杂质)为原料制备重铬酸钾的工艺:

已知:i. 2CrO42﹣+2H+
 Cr2O72﹣+H2O;
Cr2O72﹣+H2O; ii.常温,Ksp[Al(OH)3]=1.3×10﹣33;
iii.有关物质的溶解度曲线如图:

①上述工艺流程图中的操作I的主要反应为:2FeO•Cr2O3+4Na2CO3+7NaNO3
 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,另外一个反应的化学方程式是
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,另外一个反应的化学方程式是②滤渣2的成分是
③工艺流程图中,操作“调节pH”的作用是
④操作Ⅲ,加入KCl的目的是
您最近一年使用:0次



