C、N、O、Al、Si、Cu是常见的六种元素。
①Si位于元素周期表第________ 周期第________ 族。
②N的基态原子核外电子排布式为________ ;Cu的基态原子最外层有________ 个电子。
③用“>”或“<”填空:
(2)O、Na、P、Cl四种元素中电负性最大的是________ (填元素符号),其中P原子的核外电子排布式为___________________ 。
(3)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。b、c、d中第一电离能最大的是_________ (填元素符号),e的价层电子轨道示意图为____________ 。
(4)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
则该元素是________ (填写元素符号)。
②基态锗(Ge)原子的电子排布式是______ 。Ge的最高价氯化物的分子式是________ 。
③Ge元素可能的性质或应用有______ 。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
①Si位于元素周期表第
②N的基态原子核外电子排布式为
③用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al | N | 金刚石 | CH4 |
(2)O、Na、P、Cl四种元素中电负性最大的是
(3)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。b、c、d中第一电离能最大的是
(4)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | …… |
| In/(kJ·mol-1) | 578 | 1 817 | 2 745 | 11 578 | …… |
则该元素是
②基态锗(Ge)原子的电子排布式是
③Ge元素可能的性质或应用有
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
更新时间:2021-01-27 22:41:26
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】电负性与电离能是两种定量描述元素原子得失电子能力的参数,请根据表中数据回答问题。
(1)非金属性:S_______ (填“>”、“=”或“<”)F。
(2)依据电负性数值,上述元素中最容易形成离子键的是_______ 和_______ 。
(3)已知某主族元素Y,其基态原子核外有2个电子层,3个未成对电子,Y元素基态原子的轨道表示式为_______ ,通过分析电负性的变化规律,确定Y元素电负性的取值范围是_______ 。
(4)由电负性数据推断:化合物 中P的化合价为
中P的化合价为_______ 。已知 与水反应是非氧化还原反应,写出
与水反应是非氧化还原反应,写出 与水反应的化学方程式
与水反应的化学方程式_______ 。
(5)对于同周期元素,元素气态基态原子的第一电离能呈现起伏变化,结合原子核外电子排布式解释第一电离能镁元素高于铝元素的原因_______ 。
| 元素符号 |  |  | C | O | F |  |  | P | S |  |
| 电负性 | 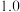 |  |  |  |  |  |  |  |  |  |
(2)依据电负性数值,上述元素中最容易形成离子键的是
(3)已知某主族元素Y,其基态原子核外有2个电子层,3个未成对电子,Y元素基态原子的轨道表示式为
(4)由电负性数据推断:化合物
 中P的化合价为
中P的化合价为 与水反应是非氧化还原反应,写出
与水反应是非氧化还原反应,写出 与水反应的化学方程式
与水反应的化学方程式(5)对于同周期元素,元素气态基态原子的第一电离能呈现起伏变化,结合原子核外电子排布式解释第一电离能镁元素高于铝元素的原因
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】C、Si、Ge、Sn都是IVA族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)Ge的原子核外电子排布式为_______ 。
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是_______ 。
(3)CO2分子的空间构型及碳氧之间的成键方式_______ 。
(4)1molSiO2晶体中的硅氧键数目为_______ 。
(5)CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为_______ 。
(6)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm- 1,CO分子中碳氧键的伸缩振动频率为2143cm - 1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度_______ (填字母)。
(A)强 (B)弱 (C)相等 (D)无法判断。
(1)Ge的原子核外电子排布式为
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是
(3)CO2分子的空间构型及碳氧之间的成键方式
(4)1molSiO2晶体中的硅氧键数目为
(5)CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为
(6)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm- 1,CO分子中碳氧键的伸缩振动频率为2143cm - 1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度
(A)强 (B)弱 (C)相等 (D)无法判断。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】下图中A~D是中学化学教科书中常见的几种晶体结构模型:
(1)请填写相应物质的名称:A___________ ;B.___________ ;C.___________ ;D.___________ 。
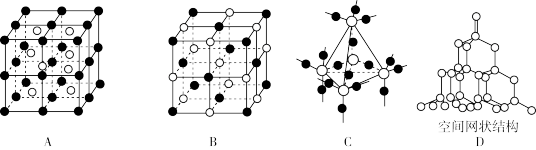
(2)铜元素位于元素周期表___________ 区。单质铜及镍都是由___________ 键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959 kJ∙mol−1,INi=1753 kJ∙mol−1,ICu>INi的原因是___________ 。
(3)单质铁的一种晶体如图甲、乙所示,若按甲虚线方向切乙得到的截面图是___________ (填字母序号)。

(1)请填写相应物质的名称:A
(2)铜元素位于元素周期表
(3)单质铁的一种晶体如图甲、乙所示,若按甲虚线方向切乙得到的截面图是

您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐1】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Z位于元素周期表第________ 周期第________ 族,Y的氢化物空间构型是________ 。
(2)XY2是一种常用的溶剂,XY2的分子中存在________ 个σ键。在H—Y、H—Z两种共价键中,键的极性较强的是____________________ ,键长较长的是________________ 。
(3)XZ4分子中X以________ 方式杂化。
(4)写出W元素的原子核外电子排布式________ 。
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的分子中存在
(3)XZ4分子中X以
(4)写出W元素的原子核外电子排布式
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】锌在工业中有重要作用,也是人体必需的微量元素。请完成下列空白:
(1)Zn的核外电子排布式为___________ 。
(2)《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。
)入药,可用于治疗皮肤炎症或表面创伤。 中阴离子空间结构为
中阴离子空间结构为___________ ,C的杂化方式为___________ 。
(1)Zn的核外电子排布式为
(2)《中华本草》等中医典籍中,记载了炉甘石(
 )入药,可用于治疗皮肤炎症或表面创伤。
)入药,可用于治疗皮肤炎症或表面创伤。 中阴离子空间结构为
中阴离子空间结构为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质X的晶体类型为___________ ,其中X原子的配位数为___________ 。
(2)元素Y基态原子的核外电子排布式为_____________ ,同周期元素中,第一电离能最大的是___________ (写元素符号)。
(3)X与Y形成的一种化合物的立方晶胞如图所示。
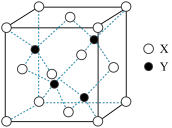
①该化合物的化学式为____________________ ,已知晶胞参数a=0.542nm,此晶体的密度为____________ g·cm-3。(写出计算式,不要求计算结果。阿伏加 德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________ 。
(1)单质X的晶体类型为
(2)元素Y基态原子的核外电子排布式为
(3)X与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为
②该化合物难溶于水但易溶于氨水,其原因是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】现有A、B、C、D、E、F、G、H元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1)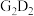 的电子式为
的电子式为_______ 。(D、G为字母代号,请将字母代号用元素符号表示,下同)。
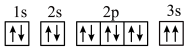
(2)某同学推断E元素基态原子的核外电子轨道表示式如图。该同学所画的电子轨道表示式违背了_______ ,该元素的 远远大于
远远大于 ,其原因是
,其原因是_______ 。
(3)D、E、F三种元素的简单离子半径由大到小的顺序是_______ 。
(4)H位于元素周期表中_______ 区(按电子排布分区),其基态原子的价电子排布为_______ 。与元素H位于同一周期,其原子基态时未成对电子数在同周期中最多的元素是_______ (填元素符号)。
(5)第一电离能介于Al、P之间的第三周期元素有_______ 种。
(6)写出一种由A、B、C、D四种元素组成离子化合物_______ 。
| A | 核外电子数和电子层数相等 |
| B | 形成化合物种类最多的元素 |
| C | 基态原子的核外p能级电子数比s能级电子数少1 |
| D | 基态原子的核外p轨道中有两个未成对电子 |
| E | 态基态原子的第一至第四电离能分别是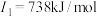 , ,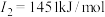 , , , ,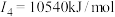 |
| F | 主族序数与周期数的差为4 |
| G | 前四周期中电负性最小的元素 |
| H | 位于元素周期表中的第11列 |
(1)
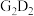 的电子式为
的电子式为(2)某同学推断E元素基态原子的核外电子轨道表示式如图。该同学所画的电子轨道表示式违背了
 远远大于
远远大于 ,其原因是
,其原因是
(3)D、E、F三种元素的简单离子半径由大到小的顺序是
(4)H位于元素周期表中
(5)第一电离能介于Al、P之间的第三周期元素有
(6)写出一种由A、B、C、D四种元素组成离子化合物
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐2】如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:
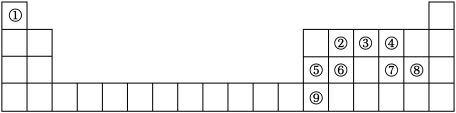
(1)⑤号元素基态原子最高能级的电子占据的原子轨道电子云轮廓为___________ 形。
(2)②③④号元素的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3)元素①②形成的一种化合物是石油化学工业重要的基本原料,写出该化合物中σ键与π键的数目之比为___________ 。
(4)元素⑦⑧可形成原子个数比为 的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式:
的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式:___________ 。
(5)元素③⑥形成的化合物是一种性质优良的无机非金属材料,具有熔点高,硬度大,电绝缘性好,化学性质稳定等性质,它的晶体类型是___________ 。
(6)元素⑨可形成的卤化物的熔点如表所示:
三种物质的熔点呈现以上规律的原因是___________ 。

(1)⑤号元素基态原子最高能级的电子占据的原子轨道电子云轮廓为
(2)②③④号元素的第一电离能由大到小的顺序为
(3)元素①②形成的一种化合物是石油化学工业重要的基本原料,写出该化合物中σ键与π键的数目之比为
(4)元素⑦⑧可形成原子个数比为
 的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式:
的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式:(5)元素③⑥形成的化合物是一种性质优良的无机非金属材料,具有熔点高,硬度大,电绝缘性好,化学性质稳定等性质,它的晶体类型是
(6)元素⑨可形成的卤化物的熔点如表所示:
| 卤化物 | 氟化物 | 氯化物 | 溴化物 |
| 熔点/℃ | 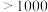 | 77.75 | 122.3 |
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】含硅化合物在生活中的应用非常广泛。请回答下列问题:
(1)祖母绿宝石的主要成分化学式为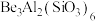 ,Be与Al的第一电离能大小关系为:
,Be与Al的第一电离能大小关系为: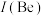
___________ 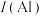 。
。
(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是___________ (不能用最简式表示)。___________ 。
(4)β-石英是晶质石英( )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为___________ ,请用价层电子对互斥模型解释图中键角。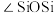 并不是180°的原因是
并不是180°的原因是___________ 。
(5)金刚砂的晶胞结构如图丙所示,在SiC中,每个C原子周围最近且等距的C原子数目为___________ ;若金刚砂的密度为ρ g⋅cm ,则晶体中最近的碳、硅原子之间的距离为
,则晶体中最近的碳、硅原子之间的距离为___________ pm(用代数式表示即可)。
(1)祖母绿宝石的主要成分化学式为
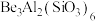 ,Be与Al的第一电离能大小关系为:
,Be与Al的第一电离能大小关系为: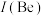
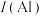 。
。(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为
 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是
 |  |  |  | |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
(4)β-石英是晶质石英(
 )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为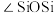 并不是180°的原因是
并不是180°的原因是(5)金刚砂的晶胞结构如图丙所示,在SiC中,每个C原子周围最近且等距的C原子数目为
 ,则晶体中最近的碳、硅原子之间的距离为
,则晶体中最近的碳、硅原子之间的距离为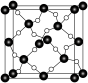

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐1】 固定是实现碳达峰、碳中和的有效途径。使用不同催化剂,
固定是实现碳达峰、碳中和的有效途径。使用不同催化剂, 固定的产物也不同。在戊二酸锌催化下,
固定的产物也不同。在戊二酸锌催化下, 固定方式主要有:
固定方式主要有:
(1)一个基态氧原子的价层电子轨道表示式为___________ ;基态碳原子核外有___________ 个未成对电子。
(2)乙中所含元素电负性由大到小的顺序为___________ (填元素符号),乙中碳原子的杂化类型是___________ 。
(3)戊二酸、丙二酸二甲酯的沸点分别为303℃、181℃,它们沸点差别较大的原因是___________ 。
(4)配离子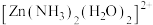 的空间结构只有1种,由此推知
的空间结构只有1种,由此推知 的空间结构是
的空间结构是___________ 。
(5)ZnO晶胞结构如图所示。已知:ZnO晶体的密度为 ,
, 代表阿伏加德罗常数的值。氧和锌的最近距离为
代表阿伏加德罗常数的值。氧和锌的最近距离为___________ nm。
 固定是实现碳达峰、碳中和的有效途径。使用不同催化剂,
固定是实现碳达峰、碳中和的有效途径。使用不同催化剂, 固定的产物也不同。在戊二酸锌催化下,
固定的产物也不同。在戊二酸锌催化下, 固定方式主要有:
固定方式主要有: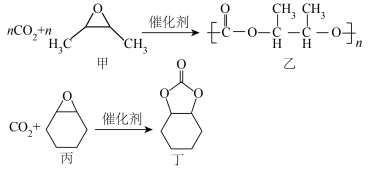
(1)一个基态氧原子的价层电子轨道表示式为
(2)乙中所含元素电负性由大到小的顺序为
(3)戊二酸、丙二酸二甲酯的沸点分别为303℃、181℃,它们沸点差别较大的原因是
(4)配离子
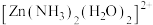 的空间结构只有1种,由此推知
的空间结构只有1种,由此推知 的空间结构是
的空间结构是(5)ZnO晶胞结构如图所示。已知:ZnO晶体的密度为
 ,
, 代表阿伏加德罗常数的值。氧和锌的最近距离为
代表阿伏加德罗常数的值。氧和锌的最近距离为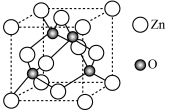
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】砷元素(As)广泛分布于自然界中,土壤、水体、矿物和生物体内都含有微量的砷。工业上提取砷的某步反应如下:

(1)砷元素在周期表中的位置是___________ 。
(2)沸点:AsH3___________ NH3,原因是___________ 。
A.> B.<
(3)关于I~Ⅳ四种物质的说法正确的是___________。
(4)已知H3AsO3为三元弱酸,则分子中As原子存在___________ 对孤电子对,AsO 的空间构型为
的空间构型为___________ 。
A.正四面体 B.三角锥形 C.角形
(5)溶解于水中的H3AsO4存在如下平衡:H3AsO4 H2AsO
H2AsO +H+,H2AsO
+H+,H2AsO
 HAsO
HAsO +H+,HAsO
+H+,HAsO
 AsO
AsO +H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因
+H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因___________ 。
(6)砷和镍(Ni)形成某种晶体的晶胞如图1所示,图2为该晶胞的俯视投影图。
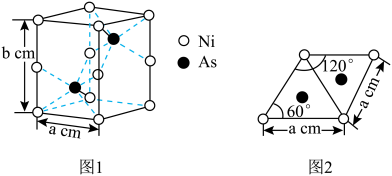
该晶胞中含有___________ 个Ni原子。该晶体的密度 ρ =___________ g·cm-3。(设NA为阿伏加德罗常数,该晶体的摩尔质量为M g·mol-1,用含 a、b、M和NA的代数式表示。)

(1)砷元素在周期表中的位置是
(2)沸点:AsH3
A.> B.<
(3)关于I~Ⅳ四种物质的说法正确的是___________。
| A.I中仅有σ键 | B.Ⅱ中部分元素的第一电离能: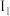 (O)> (O)>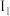 (S) (S) |
| C.Ⅲ中含有的元素中砷的电负性最大 | D.Ⅳ中含有的化学键为离子键、共价键 |
(4)已知H3AsO3为三元弱酸,则分子中As原子存在
 的空间构型为
的空间构型为A.正四面体 B.三角锥形 C.角形
(5)溶解于水中的H3AsO4存在如下平衡:H3AsO4
 H2AsO
H2AsO +H+,H2AsO
+H+,H2AsO
 HAsO
HAsO +H+,HAsO
+H+,HAsO
 AsO
AsO +H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因
+H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因(6)砷和镍(Ni)形成某种晶体的晶胞如图1所示,图2为该晶胞的俯视投影图。

该晶胞中含有
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐3】科学家合成一种新化合物(如图所示)。其中W、X、Y、Z为短周期元素,且位于同一周期,W是所在周期中第一电离能最小的元素,Y元素基态原子的未成对电子数等于其电子层数,Z元素的原子核外最外层电子数是X元素原子核外电子数的一半。回答下列问题:
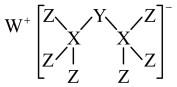
(1)W、X、Y、Z原子半径由大到小的顺序为
(2)Z的核外电子排布式为
(3)基态X原子价电子轨道表示式为
(4)W元素基态原子核外电子有
(5)X的电负性
您最近一年使用:0次



