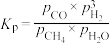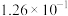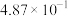(2)若25℃,101 kPa下,1 g CH4完全燃烧生成液态水和CO2气体,放出55.6 kJ的热量,则甲烷的燃烧热为
(3)对于下列反应:2SO2(g)+ O2(g)⇌2SO3(g),如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为
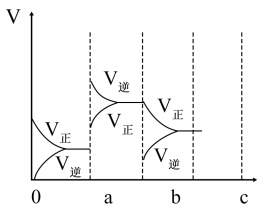
(4)下图表示在密闭容器中反应:2SO2(g)+O2(g)⇌2SO3(g) △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是
相似题推荐
Ⅰ.(1)氮的固定是几百年来科学家一直研究的课题。
下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2(g)  2NH3(g) 2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知;人类不适合大规模模拟大气固氮的原因
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。可用酸性KMnO4溶液检验,完成其反应的离子方程式。MnO
 +NO
+NO +
+ +H2O。
+H2O。(3)工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)
CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比) = x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
= x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。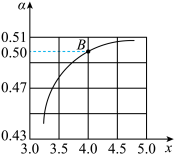
其它条件不变时,α随着x增大而增大的原因是
II.(4)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g)=2PCl3(g) △H1=-612 kJ· mol-1
2P(s) + 5Cl2(g)=2PCl5(g) △H2=-798 kJ· mol-1
气态PCl5生成气态PCl3和Cl2的热化学方程式为
(5)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=
(6)一定温度下,向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成
(1)用H2S和天然气生产CS2的反应为CH4(g)+2H2S(g)
 CS2(l)+4H2(g)。
CS2(l)+4H2(g)。已知:I.CH4(g)+4S(s)
 CS2(g)+2H2S(g) ΔH1=akJ·mol-1;
CS2(g)+2H2S(g) ΔH1=akJ·mol-1;II.S(s)+H2(g)
 H2S(g) ΔH2=bkJ·mol-1;
H2S(g) ΔH2=bkJ·mol-1;Ⅲ.CS2(1)
 CS2(g) ΔH3=ckJ·mol-1。
CS2(g) ΔH3=ckJ·mol-1。则反应CH4(g)+2H2S(g)
 CS2(1)+4H2(g)的ΔH=
CS2(1)+4H2(g)的ΔH=(2)800℃时,将一定量的H2S气体充入1L密闭容器中,发生反应H2S(g)
 S(s)+H2(g),tmin后反应达到化学平衡状态,测得容器中H2与H2S的质量浓度分别为0.02g/L、0.34g/L,则H2S的初始浓度
S(s)+H2(g),tmin后反应达到化学平衡状态,测得容器中H2与H2S的质量浓度分别为0.02g/L、0.34g/L,则H2S的初始浓度(3)向恒压密闭容器中充入0.1molCH4和0.2molH2S,发生反应CH4(g)+2H2S(g)
 CS2(g)+4H2(g),测得不同温度下,CH4的平衡转化率(%)与温度(℃)的关系如图所示:
CS2(g)+4H2(g),测得不同温度下,CH4的平衡转化率(%)与温度(℃)的关系如图所示:
①1200℃,反应达到平衡时, H2S的物质的量分数为
②1200℃时,在恒温恒容时,欲提高CH4的平衡转化率,可以采取的措施是
A.使用高效催化剂 B.再充入CH4
C.再充入H2S D.充入He E.移走H2
(4)某溶液中含0.01mol/L Fe2+和某浓度的Mn2+,当S2-浓度至少为
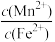 =
=【推荐3】合成气(CO、 )可用于合成低碳烯烃和甲醇等化工产品。回答下列问题:
)可用于合成低碳烯烃和甲醇等化工产品。回答下列问题:
(1)用天然气制备合成气的原理如下:

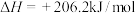
该反应的压强平衡常数(Kp)随温度的变化如下表:
温度/℃ | 700 | 750 | 800 | 850 | 900 |
|
|
| 1.00 | 5.23 |
|
根据热力学状态函数自由能(∆G)的数学表达式: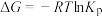 (R为大于0的常数,T为热力学温度),可以推知当温度超过
(R为大于0的常数,T为热力学温度),可以推知当温度超过
(2)用转炉熔渣(未冷却)制备合成气时,涉及反应如下:
Ⅰ.

Ⅱ.

Ⅲ.

反应温度与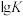 的关系如图所示。
的关系如图所示。
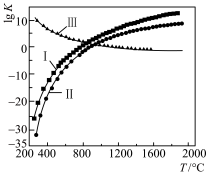
①
②反应: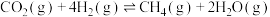 的
的
 、
、 表示)。
表示)。
③用转炉熔渣制取合成气的优点是
(3)在三个密闭容器中,按起始物质的量之比
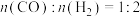 ,将CO和
,将CO和 充入容器中,在不同的温度和压强下,发生反应:
充入容器中,在不同的温度和压强下,发生反应: 。CO的转化率
。CO的转化率 与温度的关系如图所示:
与温度的关系如图所示: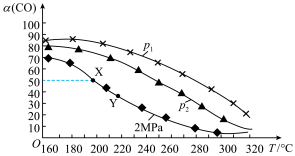
①
 (填“>”“<”或“=”);反应速率
(填“>”“<”或“=”);反应速率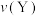
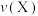 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②X点处,该反应的平衡常数为 (用平衡分压表示,分压等于总压乘以物质的量分数)。
(用平衡分压表示,分压等于总压乘以物质的量分数)。
③提高CO的转化率除改变温度和压强外还可采取的措施是
(1)在体积为2 L的恒容密闭容器中,充入2 mol CO2和6 mol H2,一定条件下反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。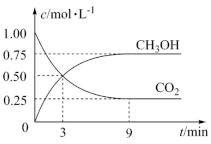
①计算:从0 min到3 min,H2的平均反应速率v(H2)=
②能说明上述反应达到平衡状态的是
A.c(CO2)∶c(H2)=1∶3
B.混合气体的密度不再发生变化
C.单位时间内消耗3molH2,同时生成l mol H2O
D.CO2的体积分数在混合气体中保持不变
③反应达到平衡后,保持其他条件不变,能加快反应速率且使体系中气体的物质的量减少,可采取的措施有
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
(2)在容积相同的密闭容器里,分别充入等量的氮气和氢气,在不同温度下发生反应:N2(g)+3H2(g)
 2NH3(g),并分别在相同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图象如图所示,请回答:
2NH3(g),并分别在相同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图象如图所示,请回答: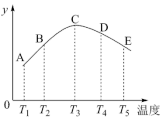
①A、B、C、D、E五点中,肯定未达到平衡点的是
②此可逆反应的正反应是
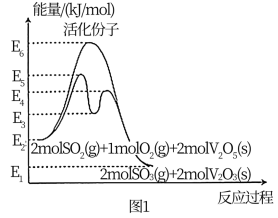
(1)已知:I.SO2(g)+V2O5(s)
 SO3(g)+V2O4(s) △H1=+24 kJ•mol-1
SO3(g)+V2O4(s) △H1=+24 kJ•mol-1Ⅱ.2V2O4(s)+O2(g)
 2V2O5(s) △H2=-244 kJ•mol-1
2V2O5(s) △H2=-244 kJ•mol-1①SO2(g)+
 O2(g)
O2(g) SO3(g) △H3=
SO3(g) △H3=②活化分子比普通分子高出的能量称为活化能,则反应Ⅱ的正反应活化能为
③总反应速率一般由慢反应决定,从图1中分析决定V2O5催化氧化SO2的反应速率的是反应
(2)某温度下,向2 L的恒容密闭容器中充入等物质的量的SO2和O2,测得SO2的物质的量变化如图2所示:

①第5 min时反应达到平衡,v(SO3)=
 。
。②该温度下,反应的平衡常数K=
I.制氢
(1)如图为Pt—TiO2催化剂在HCOOH水溶液中发生光催化反应产生H2的原理示意图。
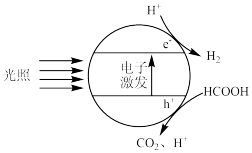
①光解HCOOH水溶液过程中,光能最终转化为
②如图,发生反应的化学方程式为
Ⅱ.加氢
(2)在一定条件下,在2L恒容密闭容器中,发生苯催化加氢反应:
 (l)+3H2(g) ⇌
(l)+3H2(g) ⇌ (l)△H1,相关物质的燃烧热数据如表所示:
(l)△H1,相关物质的燃烧热数据如表所示:| 物质 |  (l) (l) | H2(g) |  (l) (l) |
| 燃烧热△H/(kJ·mol-1) | -3260 | -286 | -3916 |
②从反应开始至10min时,测得放出101kJ的热量,则该反应在0-10min内的平均反应速率为
Ⅲ.释氢
(3)一定条件下,环己烷的气相脱氢反应为:
 (g) ⇌
(g) ⇌ (g)+3H2(g)△H>0。
(g)+3H2(g)△H>0。①恒压下,
 起始浓度相同时,该反应在有、无分子筛膜时环己烷的平衡转化率随温度的变化如图所示,其中分子筛膜能选择性分离出H2。
起始浓度相同时,该反应在有、无分子筛膜时环己烷的平衡转化率随温度的变化如图所示,其中分子筛膜能选择性分离出H2。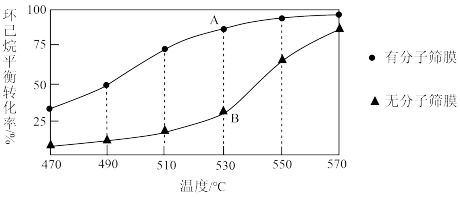
环己烷平衡转化率随温度升高而增大的原因是
②某温度下,恒容密闭容器中,若
 的起始物质的量浓度为amol▪L-1,达到平衡时,H2的产率为b,则该温度下反应的平衡常数K=
的起始物质的量浓度为amol▪L-1,达到平衡时,H2的产率为b,则该温度下反应的平衡常数K=| 实验 | 试剂x | 现象及操作 |
 | 溴水 | i.溶液呈黄色,取出少量滴加KSCN溶液,变红 |
| 碘水 | ii.溶液呈黄色,取出少量滴加KSCN溶液,未变红 |
(2)以上实验体现出氧化性关系:Br2
(3)针对实验中未检测到Fe3+,小组同学分析:I2+2Fe2+
 2Fe3++2I-(反应a),限度小,产生的c(Fe3+)低;若向ii的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡
2Fe3++2I-(反应a),限度小,产生的c(Fe3+)低;若向ii的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡(4)针对小组同学的分析,进行实验i:向的黄色溶液中滴加足量AgNO3溶液。现象及操作如下:
Ⅰ.立即产生黄色沉淀,一段时间后,又有黑色固体从溶液中析出;取出少量黑色固体,洗涤后,加入浓硝酸,黑色固体消失,生成红棕色气体。再向溶液中加入NaCl溶液,出现白色沉淀,证明黑色固体含有Ag。
Ⅱ.静置,取上层溶液,用KSCN溶液检验,变红;用CCl4萃取,无明显现象。
针对上述现象,小组同学提出不同观点并对之进行研究。
①观点1:由产生黄色沉淀不能判断反应a的平衡正向移动,说明理由:
②观点2:Fe3+可能由 Ag+氧化产生。
实验iv:向 FeSO4溶液滴加 AgNO3溶液,
(5)观点1、2 虽然合理,但加入 AgNO3溶液能否使反应a的平衡移动,还需要进一步确认。
设计实验:取ii的黄色溶液,
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如下:
①Fe3O4中Fe的化合价是+ 2和
②重整系统发生反应的化学方程式为
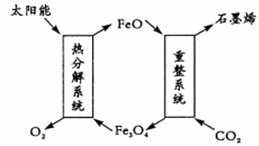
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃。在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)
 C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。
C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。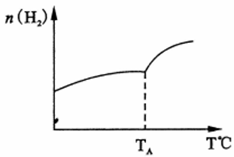
① 其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将
②△H
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3·H2O(aq)
 NH4+ (aq) +OH-(aq) △H1=a kJ•mol-1
NH4+ (aq) +OH-(aq) △H1=a kJ•mol-1CO2 (g) + H2O(l)
 H2CO3 (aq) △H2=bkJ•mol-1
H2CO3 (aq) △H2=bkJ•mol-1H2CO3(aq) + OH-(aq)
 HCO3-(aq) + H2O(l) △H3=ckJ•mol-1
HCO3-(aq) + H2O(l) △H3=ckJ•mol-1则利用NH3• H2O吸收CO2制备NH4HCO3的热化学方程式为
②已知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5mol • L-1 |
Ka1(H2CO3) | 4×10-7mol • L-1 |
Ka2(H2CO3) | 4×10-11mol • L-1 |
则反应NH4++HCO3-+H2O
 NH3• H2O+ H2CO3的平衡常数k=
NH3• H2O+ H2CO3的平衡常数k=(1)氮氧化物间可以相互转化。已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步,第一步:2NO(g)
2NO2(g)的反应历程分两步,第一步:2NO(g) N2O2(g)(快),第二步:N2O2(g)+O2(g)
N2O2(g)(快),第二步:N2O2(g)+O2(g) 2NO2(g)(慢),比较第一步反应的活化能E1与第二步反应的活化能E2大小:E1
2NO2(g)(慢),比较第一步反应的活化能E1与第二步反应的活化能E2大小:E1(2)已知:2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH=-746.5kJ·mol-1,恒温、恒容条件下,将2.0molNO和1.0molCO充入一个容积为2L的密闭容器中进行上述反应,反应过程中部分物质的物质的量变化如图所示。
N2(g)+2CO2(g) ΔH=-746.5kJ·mol-1,恒温、恒容条件下,将2.0molNO和1.0molCO充入一个容积为2L的密闭容器中进行上述反应,反应过程中部分物质的物质的量变化如图所示。
0-9min内N2的平均反应速率v(N2)=
a.升高温度 b.加入NO c.加催化剂 d.减小压强 e.降低温度
(3)T°C时,存在如下平衡:2NO2(g)
 N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~1gc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~1gc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
①T°C时,该反应的平衡常数K=
②T°C时,往刚性容器中充入一定量NO2,平衡后测得c(N2O4)为1.0mol·L-1,则平衡时NO2的物质的量分数为
(4)利用反应NO2+NH3→N2+H2O(未配平)制作如图所示的电池,用以消除氮氧化物的污染。电池工作时,OH-移向

【推荐1】铜-钢双金属废料和铜烟灰是铜的重要二次资源。
Ⅰ.从铜-钢双金属废料中浸出铜的工艺流程如下:
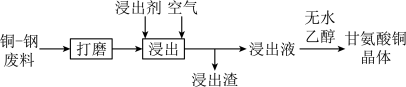
 不同,甘氨酸在水溶液中分别以
不同,甘氨酸在水溶液中分别以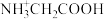 、
、 或
或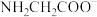 为主要形式存在。内盐
为主要形式存在。内盐 是两性化合物,请用离子方程式表示其水解使水溶液呈碱性的原因:
是两性化合物,请用离子方程式表示其水解使水溶液呈碱性的原因:(2)浸出剂的制备:主要原料有甘氨酸(简写为
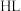 )、
)、 溶液和
溶液和 固体。取一定量
固体。取一定量 固体溶于水,随后依次加入
固体溶于水,随后依次加入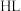 ”或“
”或“ ”,下同)、
”,下同)、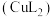 、
、 等。
等。(3)浸出:将经打磨的铜钢废料投入浸出剂,控制温度50℃,通入空气,并搅拌。浸出剂不与钢作用,但与铜反应,最终铜全部转化为
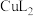 进入溶液,从而实现铜、钢分离。
进入溶液,从而实现铜、钢分离。①浸出时发生的反应过程为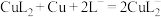 、
、
②其它条件不变时,空气流量对铜浸出速率的影响如图1所示。当空气流量超过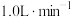 时,铜浸出速率急剧下降的可能原因是
时,铜浸出速率急剧下降的可能原因是

Ⅱ.从铜烟灰(主要成分为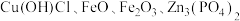 )中回收铜的主要步骤为:酸浸→萃取→反萃取→电解。
)中回收铜的主要步骤为:酸浸→萃取→反萃取→电解。
已知: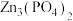 溶于无机酸。
溶于无机酸。
(5)萃取、反萃取:向浸出液(
 浓度为
浓度为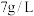 )中加入有机萃取剂
)中加入有机萃取剂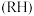 萃取,其原理可表示为:
萃取,其原理可表示为: (水层)
(水层) (有机层)
(有机层) (有机层)
(有机层) (水层)。
(水层)。向萃取所得有机相中加入硫酸,反萃取得到水相( 浓度达
浓度达 )。该工艺中设计萃取、反萃取的目的是
)。该工艺中设计萃取、反萃取的目的是
 2CO2(g)+N2(g)。在密闭容器中发生该反应时
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
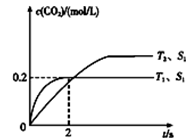
据此判断:
①该反应的温度T2
②在T1温度下,0~2 s内的平均反应速率v(N2)=
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若增大催化剂的表面积,则CO转化率
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是
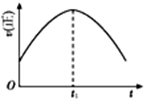
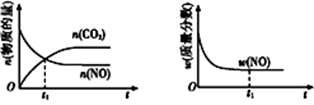
a b c
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ/mol
2NO2(g)
 N2O4(g) ΔH=-56.9 kJ/mol
N2O4(g) ΔH=-56.9 kJ/mol写出CH4催化还原N2O4(g)生成N2、CO2和H2O(g)的热化学方程式:
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极a、b表面发生的电极反应式分别为a:
b:

键能 | C=O | H-H | C-H | H-O |
kJ·mol-1 | 803 | 436 | 414 | 464 |
(2)二氧化碳甲烷化反应体系中,存在副反应:CO2(g)+ H2(g)= CO(g)+H2O(g) ΔH>0。向1L恒容密闭容器中通入1 mol CO2和5 mol H2,测得相同反应时间内,不同催化剂作用下温度对CO2转化率和CH4选择性的影响如图所示。

CH4选择性=
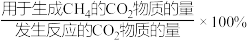
①写出一种既能提高二氧化碳甲烷化的反应速率又能提高甲烷产率的措施
②反应温度在260°C ~320°C之间时,应选择
③温度高于320°C后,以Ni为催化剂,CO2的转化率随温度升高显著上升的原因是
④若A点表示320°C时的平衡状态,则容器中CH4的浓度为
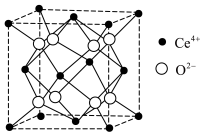
(3)CeO2理想晶胞如图所示。若晶胞边长为a nm, NA为阿伏加德罗常数的值。CeO2理想晶胞中Ce4+的配位数为