氨气是一种重要的化工原料。
I.已知 298K、101kPa 下,合成氨反应的能量变化如图1所示(ad表示被催化剂吸附,反应历程中粒子均为气态)。
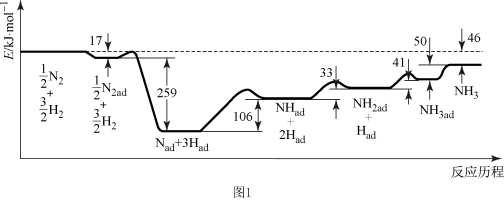
(1)该条件下,N2(g)+3H2(g) 2NH3 (g) ΔH =
2NH3 (g) ΔH =___________ 。
(2)反应历程中决定合成氨反应速率的一步反应的热化学方程式为___________ 。
(3)改变下列某一条件,既能加快合成氨反应速率又能提高氮气的平衡转化率的是___________ (填字母)。
A. 升高温度 B. 增大压强 C.增加 N2的量 D.及时分离氨气
Ⅱ.以氨气作还原剂,可除去烟气中的氮氧化物。其中除去 NO 的反应原理如下:4NH3 (g)+6NO(g) 5N2 (g)+6H2 O(g) ΔH= −1980 kJ/mol
5N2 (g)+6H2 O(g) ΔH= −1980 kJ/mol
(4)反应速率与浓度之间存在如下关系:v正=k正 c4 (NH3 )·c6 (NO),v逆 =k逆 c5 (N2 )·c6 (H2O) 。k正 、k逆 为速率常数,只受温度影响。350℃时,在 2L 恒容密闭容器中,通入 0.9mol NH3(g)和 1.2mol NO(g)发生反应,保持温度不变,平衡时 NO 的转化率为 50%,则此温度下
___________ ;当温度升高时,k正增大 m 倍,k逆增大 n 倍,则m ___________ n(填“>”、“<”或“=”)。
(5)初始投料量一定,平衡时 NO 的转化率与温度、压强的关系如图 2 所示,则 P1、P2、P3 由大到小的顺序为___________ ,原因是___________ 。
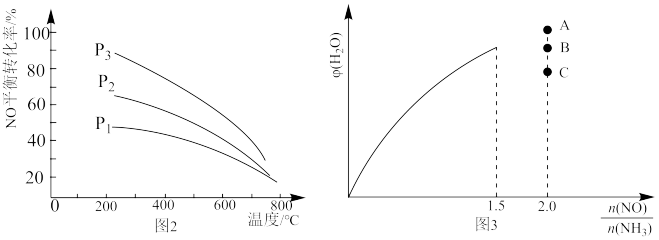
(6)保持温度不变,在恒容密闭容器中按一定比充入 NH3(g)和NO(g)发生反应,达到平衡时H2O(g)的体积分数 φ(H2O)随 的变化如图 3 所示,当
的变化如图 3 所示,当 时,达到平衡时 φ(H2O)可能是 A、B、C 三点中的
时,达到平衡时 φ(H2O)可能是 A、B、C 三点中的___________ (填“A”、“B”或“C”)。
I.已知 298K、101kPa 下,合成氨反应的能量变化如图1所示(ad表示被催化剂吸附,反应历程中粒子均为气态)。

(1)该条件下,N2(g)+3H2(g)
 2NH3 (g) ΔH =
2NH3 (g) ΔH =(2)反应历程中决定合成氨反应速率的一步反应的热化学方程式为
(3)改变下列某一条件,既能加快合成氨反应速率又能提高氮气的平衡转化率的是
A. 升高温度 B. 增大压强 C.增加 N2的量 D.及时分离氨气
Ⅱ.以氨气作还原剂,可除去烟气中的氮氧化物。其中除去 NO 的反应原理如下:4NH3 (g)+6NO(g)
 5N2 (g)+6H2 O(g) ΔH= −1980 kJ/mol
5N2 (g)+6H2 O(g) ΔH= −1980 kJ/mol(4)反应速率与浓度之间存在如下关系:v正=k正 c4 (NH3 )·c6 (NO),v逆 =k逆 c5 (N2 )·c6 (H2O) 。k正 、k逆 为速率常数,只受温度影响。350℃时,在 2L 恒容密闭容器中,通入 0.9mol NH3(g)和 1.2mol NO(g)发生反应,保持温度不变,平衡时 NO 的转化率为 50%,则此温度下

(5)初始投料量一定,平衡时 NO 的转化率与温度、压强的关系如图 2 所示,则 P1、P2、P3 由大到小的顺序为

(6)保持温度不变,在恒容密闭容器中按一定比充入 NH3(g)和NO(g)发生反应,达到平衡时H2O(g)的体积分数 φ(H2O)随
 的变化如图 3 所示,当
的变化如图 3 所示,当 时,达到平衡时 φ(H2O)可能是 A、B、C 三点中的
时,达到平衡时 φ(H2O)可能是 A、B、C 三点中的
更新时间:2021/05/14 13:26:50
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】I. CO2、SO2的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
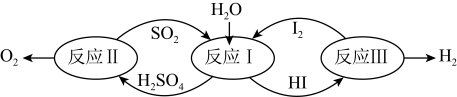
(1)反应I的化学方程式是_________ 。
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550kJ·mol-1
它由两步反应组成:
i. H2SO4(l)=SO3(g)+H2O(g) ΔH=+177kJ•mol-1
ii. SO3(g)分解
则SO3(g)分解的热化学方程式为_________ 。
(3)电催化还原CO2的方法具有催化效率更高、反应条件更温和的优点,CO2在 纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为
纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为_________ (填“a”“b”或“c”)。

II.在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。
(4)已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式_________ 。
III.磷的一种化合物叫亚磷酸(H3PO3)。已知:
a. 0.1mol/L H3PO3溶液的pH=1.7;
b. H3PO3与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐;
c. H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
(5)关于H3PO3的说法:①强电解质;②弱电解质;③二元酸;④三元酸;⑥氧化性酸;⑥还原性酸,其中正确的是_________。
(6)写出H3PO3与过量NaOH溶液反应的离子方程式_________ 。

(1)反应I的化学方程式是
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550kJ·mol-1
它由两步反应组成:
i. H2SO4(l)=SO3(g)+H2O(g) ΔH=+177kJ•mol-1
ii. SO3(g)分解
则SO3(g)分解的热化学方程式为
(3)电催化还原CO2的方法具有催化效率更高、反应条件更温和的优点,CO2在
 纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为
纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为
II.在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。
(4)已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式
III.磷的一种化合物叫亚磷酸(H3PO3)。已知:
a. 0.1mol/L H3PO3溶液的pH=1.7;
b. H3PO3与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐;
c. H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
(5)关于H3PO3的说法:①强电解质;②弱电解质;③二元酸;④三元酸;⑥氧化性酸;⑥还原性酸,其中正确的是_________。
| A.②④⑥ | B.②③⑥ | C.①④⑤ | D.②③⑤ |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】CO2减排策略主要有三种:减少排放,捕集封存,转化利用。其中CO2转化利用,生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。由CO2转化制甲醇具有重要的经济效益。
(1)高效催化剂对CO2加氢制甲醇的反应速率影响很大。通过计算机分析,CO2加氢制甲醇在不同催化条件下存在两种反应路径的势能图如下图所示。

①CO2加氢制甲醇的热化学方程式为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=_______ eV/mol(阿伏加德罗常数用NA表示);
②_______ (填“甲酸盐”或“羧酸”)路径更有利于CO2加氢制甲醇反应,对该路径的反应速率影响最大的一步反应是_______ ;
③根据势能图,下列说法合理的是_______ (填标号)。
A.CO2分压越大,催化剂表面积越大,CO2在催化剂表面的吸附速率越大
B.不考虑H3COH*,两种路径中产生的含碳中间体种类均有5种
C.中间体HCOO*比COOH*更稳定
D.使用高活性催化剂可降低反应焓变,加快反应速率
(2)CO2催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arrhenius经验公式为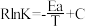 (其中Ea为活化能,k为速率常数,R和C为常数)。
(其中Ea为活化能,k为速率常数,R和C为常数)。

①该反应的活化能Ea=________ kJ/mol;
②当使用更高效的催化剂时,在图中画出Rlnk与 关系的示意图
关系的示意图_______ 。
(3)在CO2催化加氢制甲醇过程中也存在竞争反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0,在恒温密闭容器中,维持压强和投料比不变,将CO2和H2按一定流速通过反应器,CO2转化率和甲醇选择性[x(CH3OH)%=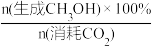 ]随温度变化关系如下图所示:
]随温度变化关系如下图所示:
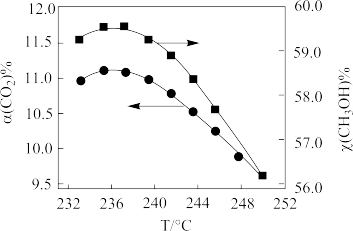
CO2转化率和甲醇选择性随温度的变化曲线
①若233-251℃时催化剂的活性受温度影响不大,分析235℃后图中曲线下降的原因_______ 。
②在压强为P的恒温恒压密闭容器中,加入1molCO2和3molH2反应并达到平衡状态,CO2平衡转化率为20%,甲醇的选择性为50%,计算CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)在该温度下的平衡常数Kp=_______ 。(列出计算式)
(1)高效催化剂对CO2加氢制甲醇的反应速率影响很大。通过计算机分析,CO2加氢制甲醇在不同催化条件下存在两种反应路径的势能图如下图所示。

①CO2加氢制甲醇的热化学方程式为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=
②
③根据势能图,下列说法合理的是
A.CO2分压越大,催化剂表面积越大,CO2在催化剂表面的吸附速率越大
B.不考虑H3COH*,两种路径中产生的含碳中间体种类均有5种
C.中间体HCOO*比COOH*更稳定
D.使用高活性催化剂可降低反应焓变,加快反应速率
(2)CO2催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arrhenius经验公式为
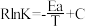 (其中Ea为活化能,k为速率常数,R和C为常数)。
(其中Ea为活化能,k为速率常数,R和C为常数)。
①该反应的活化能Ea=
②当使用更高效的催化剂时,在图中画出Rlnk与
 关系的示意图
关系的示意图(3)在CO2催化加氢制甲醇过程中也存在竞争反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0,在恒温密闭容器中,维持压强和投料比不变,将CO2和H2按一定流速通过反应器,CO2转化率和甲醇选择性[x(CH3OH)%=
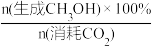 ]随温度变化关系如下图所示:
]随温度变化关系如下图所示:
CO2转化率和甲醇选择性随温度的变化曲线
①若233-251℃时催化剂的活性受温度影响不大,分析235℃后图中曲线下降的原因
②在压强为P的恒温恒压密闭容器中,加入1molCO2和3molH2反应并达到平衡状态,CO2平衡转化率为20%,甲醇的选择性为50%,计算CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)在该温度下的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研究利用和减少碳的排放。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g) + 3H2(g) CH3OH(g) + H2O(g);ΔH1=-49.6 kJ/mol
CH3OH(g) + H2O(g);ΔH1=-49.6 kJ/mol
反应Ⅱ:2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH2=-23.4 kJ/mol
CH3OCH3(g) + H2O(g);ΔH2=-23.4 kJ/mol
反应Ⅲ:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g);ΔH3
CH3OCH3(g) + 3H2O(g);ΔH3
(1)ΔH3=___________ ,反应Ⅱ的活化能E(正)___________ E(逆)(填“>”“<”或“=”)。
(2)在T1温度下,将6molCO2、和14molH2充入2L的恒容密闭容器中发生反应Ⅰ和Ⅲ,达到平衡状态时CH3OH(g)和CH3OCH3(g)的物质的量分别为2mol和1mol。则T1温度时反应Ⅰ的平衡常数K=___________ 。
(3)为实现“碳达峰"及“碳中和”,二氧化碳甲烷化技术是CO2循环再利用最有效的技术之一、请回答下列问题:
①二氧化碳甲烷化时发生的反应为CO2(g) + 4H2(g) CH4(g) + 2H2O(g),某温度下,向容积为1 L的恒容密闭容器中充入2 mol CO2和5 mol H2,5 min时反应达到平衡,CO2的转化率为50%,该反应的平衡常数K为
CH4(g) + 2H2O(g),某温度下,向容积为1 L的恒容密闭容器中充入2 mol CO2和5 mol H2,5 min时反应达到平衡,CO2的转化率为50%,该反应的平衡常数K为___________ ;能判断该反应已达化学平衡状态的标志是___________ (填标号)。
A.CO2体积分数保持不变
B.容器中混合气体的质量保持不变
C.混合气体的平均相对分子质量保持不变
D.CO2的生成速率与H2O的生成速率相等
②某温度,在体积为1 L的恒容密闭容器中加入1molCO2和4molH2,10min后达到平衡,CO2的平衡转化率和CH4的选择性分别为80%、90%,则CH4的反应速率为___________ 。(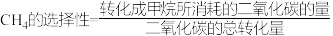 )
)
反应Ⅰ:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g);ΔH1=-49.6 kJ/mol
CH3OH(g) + H2O(g);ΔH1=-49.6 kJ/mol反应Ⅱ:2CH3OH(g)
 CH3OCH3(g) + H2O(g);ΔH2=-23.4 kJ/mol
CH3OCH3(g) + H2O(g);ΔH2=-23.4 kJ/mol反应Ⅲ:2CO2(g) + 6H2(g)
 CH3OCH3(g) + 3H2O(g);ΔH3
CH3OCH3(g) + 3H2O(g);ΔH3(1)ΔH3=
(2)在T1温度下,将6molCO2、和14molH2充入2L的恒容密闭容器中发生反应Ⅰ和Ⅲ,达到平衡状态时CH3OH(g)和CH3OCH3(g)的物质的量分别为2mol和1mol。则T1温度时反应Ⅰ的平衡常数K=
(3)为实现“碳达峰"及“碳中和”,二氧化碳甲烷化技术是CO2循环再利用最有效的技术之一、请回答下列问题:
①二氧化碳甲烷化时发生的反应为CO2(g) + 4H2(g)
 CH4(g) + 2H2O(g),某温度下,向容积为1 L的恒容密闭容器中充入2 mol CO2和5 mol H2,5 min时反应达到平衡,CO2的转化率为50%,该反应的平衡常数K为
CH4(g) + 2H2O(g),某温度下,向容积为1 L的恒容密闭容器中充入2 mol CO2和5 mol H2,5 min时反应达到平衡,CO2的转化率为50%,该反应的平衡常数K为A.CO2体积分数保持不变
B.容器中混合气体的质量保持不变
C.混合气体的平均相对分子质量保持不变
D.CO2的生成速率与H2O的生成速率相等
②某温度,在体积为1 L的恒容密闭容器中加入1molCO2和4molH2,10min后达到平衡,CO2的平衡转化率和CH4的选择性分别为80%、90%,则CH4的反应速率为
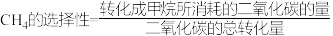 )
)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】(1)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸。
已知:①N2(g)+O2(g)=2NO(g) △H="+180.5" kJ/mol
②N2(g)+3H2(g)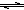 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
③2H2(g)+O2(g) = 2H2O(g) △H=-483.6 kJ/mol
氨催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为________________ 。
(2)研究在其他条件不变时,改变起始物氢气的物质的量对N2(g)+3H2(g)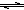 2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):
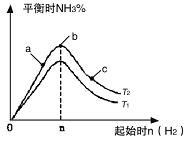
①图象中T2和T1的关系是:T2____ T1(填“高于”“低于”“等于”“无法确定”)。
②a、b、c三点中,N2转化率最高的是______ (填字母)。
③若容器容积为1L,T2℃在起始体系中加入1 mol N2,n(H2)=3mol,经过5 min反应达到平衡时H2的转化率为60%,则v(NH3)=______ 。保持容器体积不变,若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q___ 110.88 kJ(填“>”、“<”或“=”)。
已知:①N2(g)+O2(g)=2NO(g) △H="+180.5" kJ/mol
②N2(g)+3H2(g)
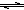 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol③2H2(g)+O2(g) = 2H2O(g) △H=-483.6 kJ/mol
氨催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为
(2)研究在其他条件不变时,改变起始物氢气的物质的量对N2(g)+3H2(g)
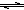 2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):
①图象中T2和T1的关系是:T2
②a、b、c三点中,N2转化率最高的是
③若容器容积为1L,T2℃在起始体系中加入1 mol N2,n(H2)=3mol,经过5 min反应达到平衡时H2的转化率为60%,则v(NH3)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】习近平总书记在党的二十大报告中指出“实现碳达峰、碳中和是一场广泛而深刻的经济社会系统性变革”。其中研发CO2的转化技术是行之有效的手段。
已知,CO2生产甲醇过程主要发生以下反应:
反应I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H1=-48.97kJ/mol
CH3OH(g)+H2O(g) ∆H1=-48.97kJ/mol
反应II.CO2(g)+H2(g) CO(g)+H2O(g) ∆H2=41.17kJ.mol
CO(g)+H2O(g) ∆H2=41.17kJ.mol
反应III.CO(g)+2H2(g) CH3OH(g) ∆H3=-90.14kJ/mol
CH3OH(g) ∆H3=-90.14kJ/mol
(1)反应Ⅲ正反应活化能Ea(E)与逆反应活化能Ea(逆)大小关系为:Ea(E)___________ Ea(逆)(填“>”、“<”或“=”)。
(2)在CO2加氢合成甲醇的体系中,下列说法错误的是___________。
(3)已知:CH3OH的选择性==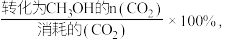 不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是___________。
不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是___________。
已知,CO2生产甲醇过程主要发生以下反应:
反应I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H1=-48.97kJ/mol
CH3OH(g)+H2O(g) ∆H1=-48.97kJ/mol 反应II.CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2=41.17kJ.mol
CO(g)+H2O(g) ∆H2=41.17kJ.mol 反应III.CO(g)+2H2(g)
 CH3OH(g) ∆H3=-90.14kJ/mol
CH3OH(g) ∆H3=-90.14kJ/mol(1)反应Ⅲ正反应活化能Ea(E)与逆反应活化能Ea(逆)大小关系为:Ea(E)
(2)在CO2加氢合成甲醇的体系中,下列说法错误的是___________。
| A.若在绝热恒容容器,反应Ⅰ的平衡常数K保持不变,说明反应Ⅰ、Ⅱ、Ⅲ都已达平衡 |
| B.若气体的平均相对分子质量不变,说明反应I、II、III都已达平衡 |
| C.体系达平衡后,若压缩体积,反应I平衡正向移动,反应Ⅱ平衡不移动 |
| D.选用合适的催化剂可以提高甲醇在单位时间内的产量 |
(3)已知:CH3OH的选择性==
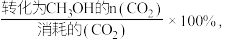 不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是___________。
不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是___________。| A.高温高压 | B.高温低压 | C.低温低压 | D.低温高压 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】Ⅰ.一定条件下,在容积为5 L的密闭容器中,A、B、C三种气体的物质的量随时间t的变化如图甲所示。已知达到平衡后,降低温度,A的体积分数减小。
(1)该反应的化学方程式为_______ 。
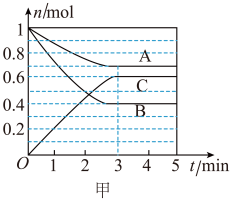
(2)该反应的反应速率v随时间t的关系如图乙所示。
①根据图乙判断,在 时刻改变的外界条件是
时刻改变的外界条件是_______ 。
②a、b、c对应的平衡状态中,C的体积分数最大的是状态_______ 。
③各阶段的平衡常数如表所示:
 、
、 、
、 之间的大小关系为
之间的大小关系为_______ (用“>”“<”或“=”连接)。
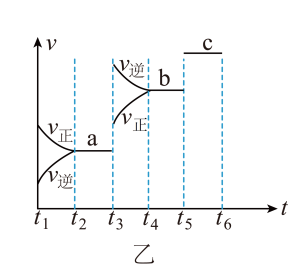
Ⅱ.在密闭容器中充入一定量的 ,发生反应:
,发生反应: ,如图丙所示为
,如图丙所示为 气体分解生成
气体分解生成 和
和 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。
(3)
_______ (填填“>”“<”或“=”)0。
(4)图丙中压强( 、
、 、
、 )由大到小的顺序为
)由大到小的顺序为_______ 。
(5)如果想进一步提高 的转化率,除改变温度、压强外,还可以采取的措施有
的转化率,除改变温度、压强外,还可以采取的措施有_______ 。

(1)该反应的化学方程式为
(2)该反应的反应速率v随时间t的关系如图乙所示。

①根据图乙判断,在
 时刻改变的外界条件是
时刻改变的外界条件是②a、b、c对应的平衡状态中,C的体积分数最大的是状态
③各阶段的平衡常数如表所示:
 | 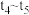 | 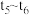 |
 |  |  |
 、
、 、
、 之间的大小关系为
之间的大小关系为Ⅱ.在密闭容器中充入一定量的
 ,发生反应:
,发生反应: ,如图丙所示为
,如图丙所示为 气体分解生成
气体分解生成 和
和 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。
(3)

(4)图丙中压强(
 、
、 、
、 )由大到小的顺序为
)由大到小的顺序为(5)如果想进一步提高
 的转化率,除改变温度、压强外,还可以采取的措施有
的转化率,除改变温度、压强外,还可以采取的措施有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】化学反应速率、限度及能量与生产、生活密切相关,根据所学知识,回答下列问题:
(1)一密闭体系中发生反应
 ,某一时间段内反应速率与时间的关系曲线图如图。
,某一时间段内反应速率与时间的关系曲线图如图。

① 处于平衡状态的时间段有
处于平衡状态的时间段有___________ 。
②(每次反应达到平衡后,仅改变其中一个条件) 、
、 、
、 时刻体系中发生变化的条件分别是
时刻体系中发生变化的条件分别是___________ 、___________ 、___________ 。
③下列各时间段中,氨的百分含量最高的是___________ (填标号)。
A.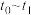 B.
B. C.
C. D.
D.
(2)在相同温度下,反应 在如图装置中达到化学平衡。
在如图装置中达到化学平衡。
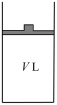
①若缓慢将体积扩大至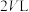 ,平衡
,平衡___________ (填“正向”、“逆向”或“不”)移动。
②若迅速缩小体积至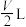 然后保持不变,体系颜色的变化情况为
然后保持不变,体系颜色的变化情况为___________ 。
(1)一密闭体系中发生反应

 ,某一时间段内反应速率与时间的关系曲线图如图。
,某一时间段内反应速率与时间的关系曲线图如图。
①
 处于平衡状态的时间段有
处于平衡状态的时间段有②(每次反应达到平衡后,仅改变其中一个条件)
 、
、 、
、 时刻体系中发生变化的条件分别是
时刻体系中发生变化的条件分别是③下列各时间段中,氨的百分含量最高的是
A.
 B.
B. C.
C. D.
D.
(2)在相同温度下,反应
 在如图装置中达到化学平衡。
在如图装置中达到化学平衡。
①若缓慢将体积扩大至
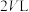 ,平衡
,平衡②若迅速缩小体积至
 然后保持不变,体系颜色的变化情况为
然后保持不变,体系颜色的变化情况为
您最近一年使用:0次
【推荐2】Ⅰ.碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·molˉ1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2=______
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g) 2Fe(s)+3CO(g) + 6H2(g) ΔH>0
2Fe(s)+3CO(g) + 6H2(g) ΔH>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为_____
②若该反应在恒温恒容容器中进行,能表明该反应达到平衡状态的是_____
A.CH4的转化率等于CO的产率 B.混合气体的密度不变
C.v(CO)与v(H2)的比值为1:2 D.固体的总质量不变
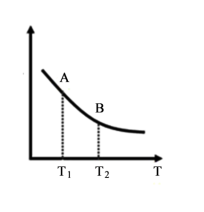
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA_____ KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些_____
A.H2的逆反应速率 B.CH4的的体积分数
C.混合气体的平均相对分子质量 D.CO的体积分数
Ⅱ.已知2A2(g)+B2(g) 2C3(g) △H=-Q1 kJ/mol (Q1>0),在一个有催化剂的容积不变的密闭容器中加入2 mol A2和1 mol B2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g) △H=-Q1 kJ/mol (Q1>0),在一个有催化剂的容积不变的密闭容器中加入2 mol A2和1 mol B2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)下列措施可以同时提高反应速率和B2的转化率是___________ (填选项序号)。
A.选择适当的催化剂
B.增大压强
C.及时分离生成的C3
D.升高温度
(2)达到平衡后,向原容器中通入少量的Ar,A2的转化率将___________ (填“增大“、“减小”或“不变”)
(3)达到平衡时,A2的转化率为___________
(4)将上述容器改为恒压容器,起始时加入2 mol A2和1 mol B2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2___________ Q4(填“>”、“<”或“=”)。
(5)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是___________ ;
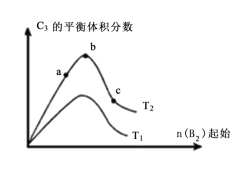
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点A2和B2的物质的量之比为2:1
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·molˉ1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2=
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g)
 2Fe(s)+3CO(g) + 6H2(g) ΔH>0
2Fe(s)+3CO(g) + 6H2(g) ΔH>0①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为
②若该反应在恒温恒容容器中进行,能表明该反应达到平衡状态的是
A.CH4的转化率等于CO的产率 B.混合气体的密度不变
C.v(CO)与v(H2)的比值为1:2 D.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA

A.H2的逆反应速率 B.CH4的的体积分数
C.混合气体的平均相对分子质量 D.CO的体积分数
Ⅱ.已知2A2(g)+B2(g)
 2C3(g) △H=-Q1 kJ/mol (Q1>0),在一个有催化剂的容积不变的密闭容器中加入2 mol A2和1 mol B2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g) △H=-Q1 kJ/mol (Q1>0),在一个有催化剂的容积不变的密闭容器中加入2 mol A2和1 mol B2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。(1)下列措施可以同时提高反应速率和B2的转化率是
A.选择适当的催化剂
B.增大压强
C.及时分离生成的C3
D.升高温度
(2)达到平衡后,向原容器中通入少量的Ar,A2的转化率将
(3)达到平衡时,A2的转化率为
(4)将上述容器改为恒压容器,起始时加入2 mol A2和1 mol B2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2
(5)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是

A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点A2和B2的物质的量之比为2:1
您最近一年使用:0次
【推荐3】甲烷在工农业生产、生活中有着重要作用,请回答下列问题。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)∆H1=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)∆H2
若在相同条件下,1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则∆H2=_________ 。
(2)用CH4催化还原NO,欲提高N2的平衡产率,应该采取的措施是_______ (填序号)。
A.升高温度B.增大压强C.降低温度D.降低压强
(3)一定温度下,在初始体积为2L恒压密闭容器中通入1molCH4和4molNO(假设只发生反应②),20min后该反应达到平衡,测得容器中N2的物质的量为0.8mol。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=________________ ,该温度下反应的平衡常数K=_______________ 。(答案可用分数表示)
(4)为了提高CH4和NO转化为N2的产率,种学家寻找了一种新型的催化剂。将CH4和NO按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得N2的产率与温度的关系如图所示,OA段N2产率增大的原因是_________ 。

(5)对于反应②而言,不同温度下,CH4的浓度变化如图所示,下列说法正确的是__________ (填序号)。

A.T1大于T2
B.c时二氧化碳的浓度为0.2mol/L
C.a点正反应速率大于b点的逆反应速率
D.a点的反应速率一定比c点的反应速率小
(6)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液,该甲烷燃料电池中,负极反应方程式为_______ 。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)∆H1=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)∆H2
若在相同条件下,1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则∆H2=
(2)用CH4催化还原NO,欲提高N2的平衡产率,应该采取的措施是
A.升高温度B.增大压强C.降低温度D.降低压强
(3)一定温度下,在初始体积为2L恒压密闭容器中通入1molCH4和4molNO(假设只发生反应②),20min后该反应达到平衡,测得容器中N2的物质的量为0.8mol。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=
(4)为了提高CH4和NO转化为N2的产率,种学家寻找了一种新型的催化剂。将CH4和NO按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得N2的产率与温度的关系如图所示,OA段N2产率增大的原因是

(5)对于反应②而言,不同温度下,CH4的浓度变化如图所示,下列说法正确的是

A.T1大于T2
B.c时二氧化碳的浓度为0.2mol/L
C.a点正反应速率大于b点的逆反应速率
D.a点的反应速率一定比c点的反应速率小
(6)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液,该甲烷燃料电池中,负极反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】碳、氮是重要的非金属元素,在生产、生活中有广泛的应用。
(1)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l) C6H12O6(s)+6O2(g) △H=+669.62 kJ•mol-1该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
C6H12O6(s)+6O2(g) △H=+669.62 kJ•mol-1该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是__________ 。
a.增大CO2的浓度 b.取走一半C6H12O6
c.加入催化剂 d.适当升高温度
(2)N2O5的分解反应2N2O5(g) 4NO2(g) + O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g) + O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2) =________ mol•L-1•min-1。
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为_________ (填化学式);A电极的电极反应式为_______________________ ,一段时间后,若乙中需加0.2 mol Cu(OH)2使溶液复原,则转移的电子的物质的量为 _____________ 。

(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图

①b点时,平衡体系中C、N原子个数之比接近________________ ;
②a、b、c三点CO的转化率从大到小的顺序为____________ ;a、c、d三点的平衡常数从大到小的顺序为__________________ 。
③若 =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___________ 。
(1)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)
 C6H12O6(s)+6O2(g) △H=+669.62 kJ•mol-1该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
C6H12O6(s)+6O2(g) △H=+669.62 kJ•mol-1该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是a.增大CO2的浓度 b.取走一半C6H12O6
c.加入催化剂 d.适当升高温度
(2)N2O5的分解反应2N2O5(g)
 4NO2(g) + O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g) + O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5) /(mol•L﹣1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为

(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③若
 =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】绿色发展是必由之路,我国宣布二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。
I.以 制备甲醇是实现“双碳”目标的重要途径。在体积为2.5L的密闭容器中,充入
制备甲醇是实现“双碳”目标的重要途径。在体积为2.5L的密闭容器中,充入 和
和 ,180℃下反应仅得甲醇(沸点64.7℃)和物质X,测得各物质物质的量随时间的部分变化图象如图所示:
,180℃下反应仅得甲醇(沸点64.7℃)和物质X,测得各物质物质的量随时间的部分变化图象如图所示:

(1) 的电子式为
的电子式为___________ ;该反应的化学反应方程式为___________ 。
(2)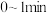 内,甲醇的平均反应速率为
内,甲醇的平均反应速率为___________  (保留两位有效数字)。
(保留两位有效数字)。
(3)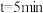 时,正反应速率
时,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
(4)其他条件不变,将该恒容容器,改为体积可变的容器,达到平衡时,测得 的转化率为15%,则平衡时甲醇的浓度为
的转化率为15%,则平衡时甲醇的浓度为___________  。
。
(5)甲醇燃料电池具有启动快、效率高等优点。若以 溶液为电解液,其负极的电极反应式为
溶液为电解液,其负极的电极反应式为___________ 。
II.甲烷与 重整制备合成气也是
重整制备合成气也是 综合利用的研究热点之一、
综合利用的研究热点之一、
(6)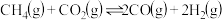 ,此反应的能量变化如图所示:
,此反应的能量变化如图所示:

则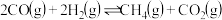 ,属于
,属于___________ 反应(填“吸热”或“放热”)。
(7)恒容条件下,下列描述能证明该反应达到平衡的是___________(填字母)。
I.以
 制备甲醇是实现“双碳”目标的重要途径。在体积为2.5L的密闭容器中,充入
制备甲醇是实现“双碳”目标的重要途径。在体积为2.5L的密闭容器中,充入 和
和 ,180℃下反应仅得甲醇(沸点64.7℃)和物质X,测得各物质物质的量随时间的部分变化图象如图所示:
,180℃下反应仅得甲醇(沸点64.7℃)和物质X,测得各物质物质的量随时间的部分变化图象如图所示:
(1)
 的电子式为
的电子式为(2)
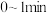 内,甲醇的平均反应速率为
内,甲醇的平均反应速率为 (保留两位有效数字)。
(保留两位有效数字)。(3)
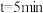 时,正反应速率
时,正反应速率(4)其他条件不变,将该恒容容器,改为体积可变的容器,达到平衡时,测得
 的转化率为15%,则平衡时甲醇的浓度为
的转化率为15%,则平衡时甲醇的浓度为 。
。(5)甲醇燃料电池具有启动快、效率高等优点。若以
 溶液为电解液,其负极的电极反应式为
溶液为电解液,其负极的电极反应式为II.甲烷与
 重整制备合成气也是
重整制备合成气也是 综合利用的研究热点之一、
综合利用的研究热点之一、(6)
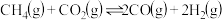 ,此反应的能量变化如图所示:
,此反应的能量变化如图所示:
则
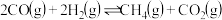 ,属于
,属于(7)恒容条件下,下列描述能证明该反应达到平衡的是___________(填字母)。
| A.容器中气体密度不再改变 |
B.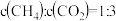 不再改变 不再改变 |
C.断裂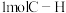 同时断裂 同时断裂 |
D. 的体积分数不再改变 的体积分数不再改变 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】合成气(CO+H2)是制备合成油和烯烃等众多化工产品的枢纽原料,而催化甲烷部分氧化是生产合成气的主要工艺之一,涉及的反应为:
①2CH4(g)+O2(g) 2CO(g)+4H2(g) △H
2CO(g)+4H2(g) △H
已知如下反应:
②CH4(g)+2O2(g) CO2(g)+2H2O(g) △H1=-810kJ/mol
CO2(g)+2H2O(g) △H1=-810kJ/mol
③CH4(g)+H2O(g) CO(g)+3H2(g) △H2=+225kJ/mol
CO(g)+3H2(g) △H2=+225kJ/mol
④CO(g)+H2O(g) CO2(g)+H2(g) △H3=-35kJ/mol
CO2(g)+H2(g) △H3=-35kJ/mol
请回答下列问题:
(1)试计算反应①的△H=___ 。
(2)在某体积固定的绝热密闭容器中发生反应④,下列事实能证明反应已达平衡的是___ 。
(3)在某恒容密闭容器中加入一定量的甲烷和氧气发生反应③,使其充分反应,测得不同温度和压强下甲烷的转化率如图1所示,由该图可得出的结论是___ 。

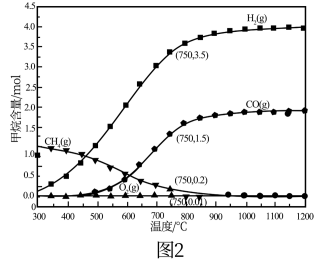
(4)现将2molCH4和1molO2加入某体积可变的密闭容器中,发生反应①。控制压强为1atm,测得不同温度下反应体系中各组分平衡含量如图2所示。实际生产中控制的温度为750℃,则此温度下CO的产率为___ ,若平衡时容器的体积为VL,则该反应的平衡常数K=___ 。(用含V代数式表示,不必化简)。
①2CH4(g)+O2(g)
 2CO(g)+4H2(g) △H
2CO(g)+4H2(g) △H已知如下反应:
②CH4(g)+2O2(g)
 CO2(g)+2H2O(g) △H1=-810kJ/mol
CO2(g)+2H2O(g) △H1=-810kJ/mol③CH4(g)+H2O(g)
 CO(g)+3H2(g) △H2=+225kJ/mol
CO(g)+3H2(g) △H2=+225kJ/mol④CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-35kJ/mol
CO2(g)+H2(g) △H3=-35kJ/mol请回答下列问题:
(1)试计算反应①的△H=
(2)在某体积固定的绝热密闭容器中发生反应④,下列事实能证明反应已达平衡的是
| A.容器内温度不再变化 | B.混合气体的平均分子量不再变化 |
| C.各组分的物质的量相等 | D.1molH—O键断裂同时有1molH—H键断裂 |

(4)现将2molCH4和1molO2加入某体积可变的密闭容器中,发生反应①。控制压强为1atm,测得不同温度下反应体系中各组分平衡含量如图2所示。实际生产中控制的温度为750℃,则此温度下CO的产率为

您最近一年使用:0次



