我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a.CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1
b.CO2(g)+H2(g) CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
c.CH4(g) C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3
d.2CO(g) CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4
e.CO(g)+H2(g) H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=___________ (写出一个合理的代数式即可)。
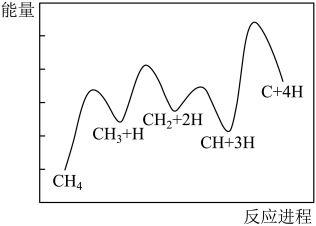
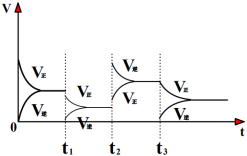
(2)一定条件下,c反应CH4分解形成碳的反应历程如图所示。该历程分___________ 步进行,其中第___________ 步的正反应活化能最大。
(3)某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行a反应,达到平衡时CO2的转化率是50%,则其平衡常数为___________ 。
(4)在一固定容积的密闭容器中进行b反应:CO2(g)+H2(g) CO(g)+H2O(g)。其平衡常数K和温度T的关系如下:
CO(g)+H2O(g)。其平衡常数K和温度T的关系如下:
①该反应的正反应为___________ 反应(填“吸热”或“放热”)。
②当温度为850℃,某时刻测得容器中各物质的物质的量如下:
此时上述反应正、逆反应速率的关系为:υ正___________ υ逆(填“大于”、“小于”或“等于”)。
③在一定温度下,压缩容器体积增大压强,则该反应中H2(g)的平衡转化率___________ (填“增大”、“减小”或“不变”)。工业生产中,通过此方法使容器压强增大以加快反应速率,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其原因可能是___________ 。
a.CH4(g)+CO2(g)
 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1b.CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2c.CH4(g)
 C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3d.2CO(g)
 CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4e.CO(g)+H2(g)
 H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5(1)根据盖斯定律,反应a的∆H1=
(2)一定条件下,c反应CH4分解形成碳的反应历程如图所示。该历程分

(3)某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行a反应,达到平衡时CO2的转化率是50%,则其平衡常数为
(4)在一固定容积的密闭容器中进行b反应:CO2(g)+H2(g)
 CO(g)+H2O(g)。其平衡常数K和温度T的关系如下:
CO(g)+H2O(g)。其平衡常数K和温度T的关系如下:| T/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
②当温度为850℃,某时刻测得容器中各物质的物质的量如下:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
③在一定温度下,压缩容器体积增大压强,则该反应中H2(g)的平衡转化率
更新时间:2021-07-15 21:39:26
|
相似题推荐
【推荐1】煤的综合利用包括煤的干馏、气化、液化等。煤的气化用于生产各种气体燃料,有利于环境保护和提高煤的利用效率;煤的液化产品将替代目前的石油,最常见的液化方法是用煤生产 ,对优化终端能源结构具有重要的战略意义。
,对优化终端能源结构具有重要的战略意义。
(1)工业上可利用煤气化后的产物CO或 来制备清洁液体燃料甲醇。已知:800
来制备清洁液体燃料甲醇。已知:800 时
时
反应Ⅰ:
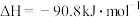
反应Ⅱ:
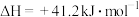
写出用 与
与 反应制备甲醇的热化学方程式:
反应制备甲醇的热化学方程式:___________ 。
①对于反应Ⅰ,在体积一定的密闭容器中按物质的量之比为1∶2充入CO和 ,测得平衡混合物中
,测得平衡混合物中 的体积分数在不同压强下随温度的变化情况如图所示。据此判断:
的体积分数在不同压强下随温度的变化情况如图所示。据此判断:
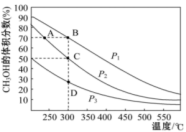
压强
___________ (填“ ”、“
”、“ ”或“
”或“ ”,下同)
”,下同) ;反应速率:
;反应速率: (状态A)
(状态A)___________  (状态B)。
(状态B)。
②对于反应Ⅱ,在体积一定的密闭容器中加入一定量的 和
和 进行反应。下列说法正确的是
进行反应。下列说法正确的是___________ 。
A.若该反应在恒容、绝热容器中进行,当容器中压强保持不变时表明反应达到平衡状态
B.该反应达到平衡时,向平衡体系中充入一定量的氦气,平衡可能发生移动
C.恒温恒容条件下,若改变反应物的投入量, 的值不发生变化
的值不发生变化
D.恒温恒容条件下,若投入气体的总量保持不变,设起始投料比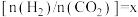 ,当
,当 或1/2时,
或1/2时, 的体积分数不变
的体积分数不变
(2)煤干馏产物焦炭常用于冶炼工业。已知反应①: ;反应②:
;反应②: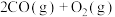
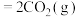 ,反应①、②的反应趋势与温度关系如图所示。
,反应①、②的反应趋势与温度关系如图所示。
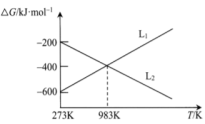
 对应反应是
对应反应是___________ ;当温度低于983K时,过量焦炭的氧化产物以为___________ 主。
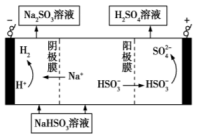
(3)燃煤烟道气常用 溶液充分吸收
溶液充分吸收 得到
得到 溶液,然后电解该溶液可制得硫酸。原理如图,写出电解时阳极的电极反应式
溶液,然后电解该溶液可制得硫酸。原理如图,写出电解时阳极的电极反应式___________ 。
 ,对优化终端能源结构具有重要的战略意义。
,对优化终端能源结构具有重要的战略意义。(1)工业上可利用煤气化后的产物CO或
 来制备清洁液体燃料甲醇。已知:800
来制备清洁液体燃料甲醇。已知:800 时
时反应Ⅰ:

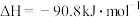
反应Ⅱ:

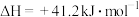
写出用
 与
与 反应制备甲醇的热化学方程式:
反应制备甲醇的热化学方程式:①对于反应Ⅰ,在体积一定的密闭容器中按物质的量之比为1∶2充入CO和
 ,测得平衡混合物中
,测得平衡混合物中 的体积分数在不同压强下随温度的变化情况如图所示。据此判断:
的体积分数在不同压强下随温度的变化情况如图所示。据此判断:
压强

 ”、“
”、“ ”或“
”或“ ”,下同)
”,下同) ;反应速率:
;反应速率: (状态A)
(状态A) (状态B)。
(状态B)。②对于反应Ⅱ,在体积一定的密闭容器中加入一定量的
 和
和 进行反应。下列说法正确的是
进行反应。下列说法正确的是A.若该反应在恒容、绝热容器中进行,当容器中压强保持不变时表明反应达到平衡状态
B.该反应达到平衡时,向平衡体系中充入一定量的氦气,平衡可能发生移动
C.恒温恒容条件下,若改变反应物的投入量,
 的值不发生变化
的值不发生变化D.恒温恒容条件下,若投入气体的总量保持不变,设起始投料比
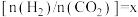 ,当
,当 或1/2时,
或1/2时, 的体积分数不变
的体积分数不变(2)煤干馏产物焦炭常用于冶炼工业。已知反应①:
 ;反应②:
;反应②: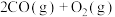
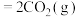 ,反应①、②的反应趋势与温度关系如图所示。
,反应①、②的反应趋势与温度关系如图所示。
 对应反应是
对应反应是(3)燃煤烟道气常用
 溶液充分吸收
溶液充分吸收 得到
得到 溶液,然后电解该溶液可制得硫酸。原理如图,写出电解时阳极的电极反应式
溶液,然后电解该溶液可制得硫酸。原理如图,写出电解时阳极的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】甲烷催化裂解是工业上制备乙炔的方法之一。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-885 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH2=-2600 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ/mol
则2CH4(g)=C2H2(g)+3H2(g)ΔH=_______ kJ/mol
(2)①若用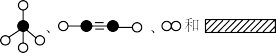 分别表示CH4、CH2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示,从吸附到解吸的过程中,能量状态最高的是
分别表示CH4、CH2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示,从吸附到解吸的过程中,能量状态最高的是_______ (填标号)。_______ 。_______ Pa2。
②在某温度下,向VL恒容密闭容器中充入0.12mol CH4只发生反应2CH4(g)=C2H4(g)+2H2(g),达到平衡时,测得p(H2)=p(CH4)。CH4的平衡转化率为_______ (结果保留两位有效数字)。
(4)甲烷除裂解反应外还能发生水蒸气重整反应,涉及以下反应方程式:
I.CH4(g)+H2O(g)→CO(g)+3H2(g) ΔH1=+206kJ·mol-1;
II.CO(g)+H2O(g)→CO2(g)+H2(g) ΔH2=-41kJ·mol-1;
在一体积可变的密闭容器中,加入一定量的CH4和H2O(g)发生水蒸气重整反应。
①压强为P0kPa时,分别在加CaO和不加CaO时,平衡体系H2的物质的量随温度变化如图所示。温度低于700℃时,加入CaO可明显提高混合气中H2的量,原因是_______ _______ (填“>”“<”或“=”)c(E)。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-885 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH2=-2600 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ/mol
则2CH4(g)=C2H2(g)+3H2(g)ΔH=
(2)①若用
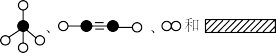 分别表示CH4、CH2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示,从吸附到解吸的过程中,能量状态最高的是
分别表示CH4、CH2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示,从吸附到解吸的过程中,能量状态最高的是
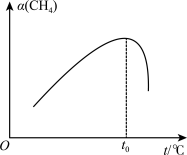
②在某温度下,向VL恒容密闭容器中充入0.12mol CH4只发生反应2CH4(g)=C2H4(g)+2H2(g),达到平衡时,测得p(H2)=p(CH4)。CH4的平衡转化率为
(4)甲烷除裂解反应外还能发生水蒸气重整反应,涉及以下反应方程式:
I.CH4(g)+H2O(g)→CO(g)+3H2(g) ΔH1=+206kJ·mol-1;
II.CO(g)+H2O(g)→CO2(g)+H2(g) ΔH2=-41kJ·mol-1;
在一体积可变的密闭容器中,加入一定量的CH4和H2O(g)发生水蒸气重整反应。
①压强为P0kPa时,分别在加CaO和不加CaO时,平衡体系H2的物质的量随温度变化如图所示。温度低于700℃时,加入CaO可明显提高混合气中H2的量,原因是


您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】请参考题中图表,已知E1=134kJ•mol﹣1、E2=368kJ•mol﹣1,根据要求回答下列问题:
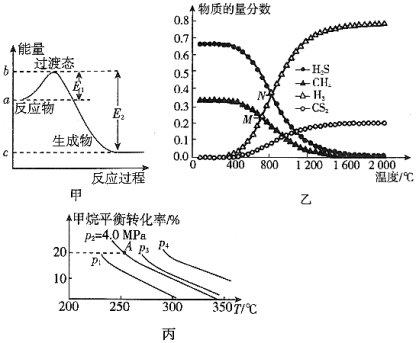
(1)图甲是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:___________ 。
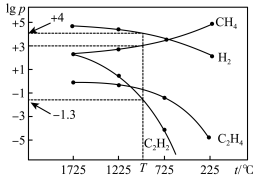
(2)在一2L密闭容器中,起始时向该容器中充入H2S和CH4,n(H2S):n(CH4)=2:1,起始的n(CH4)=3mol,发生反应:CH4(g)+2H2S(g) CS2(g)+4H2(g)。温度变化对平衡时产物的物质的量分数的影响如图乙所示,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是
CS2(g)+4H2(g)。温度变化对平衡时产物的物质的量分数的影响如图乙所示,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是___________ 。(列举一条)。N点对应温度下,化学反应经过了10min建立了平衡,该反应的v(H2S)=___________ 。
(3)反应CH4(g)+H2O(g) CO(g)+3H2(g)的平衡转化率与温度、压强关系如图丙所示[其中n(CH4):n(H2O)=1:1]。该反应在图中A点的平衡常数Kp=
CO(g)+3H2(g)的平衡转化率与温度、压强关系如图丙所示[其中n(CH4):n(H2O)=1:1]。该反应在图中A点的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________ 。
(4)瑞典化学家阿累尼乌斯的化学反应速率经验定律为k=Ae ,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是
,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是___________ (填序号,k正、k逆为正、逆反应速率常数)。
A.其他条件不变,升高温度,k正增大、k逆变小
B.其他条件不变,使用催化剂,k正、k逆同等倍数增大
C.其他条件不变,增大反应物浓度,k正增大、k逆不变
D.其他条件不变,减小压强,k正、k逆都变小

(1)图甲是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)在一2L密闭容器中,起始时向该容器中充入H2S和CH4,n(H2S):n(CH4)=2:1,起始的n(CH4)=3mol,发生反应:CH4(g)+2H2S(g)
 CS2(g)+4H2(g)。温度变化对平衡时产物的物质的量分数的影响如图乙所示,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是
CS2(g)+4H2(g)。温度变化对平衡时产物的物质的量分数的影响如图乙所示,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是(3)反应CH4(g)+H2O(g)
 CO(g)+3H2(g)的平衡转化率与温度、压强关系如图丙所示[其中n(CH4):n(H2O)=1:1]。该反应在图中A点的平衡常数Kp=
CO(g)+3H2(g)的平衡转化率与温度、压强关系如图丙所示[其中n(CH4):n(H2O)=1:1]。该反应在图中A点的平衡常数Kp=(4)瑞典化学家阿累尼乌斯的化学反应速率经验定律为k=Ae
 ,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是
,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是A.其他条件不变,升高温度,k正增大、k逆变小
B.其他条件不变,使用催化剂,k正、k逆同等倍数增大
C.其他条件不变,增大反应物浓度,k正增大、k逆不变
D.其他条件不变,减小压强,k正、k逆都变小
您最近一年使用:0次
【推荐1】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如图所示:

(1)已知: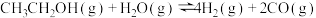
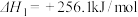
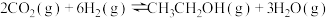

请写出反应II的热化学方程式______ 。
(2)反应II,在进气比[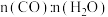 ]不同时,测得相应的CO平衡转化率见右图(各点的反应温度可能相同或不同,其他反应条件都相同)。
]不同时,测得相应的CO平衡转化率见右图(各点的反应温度可能相同或不同,其他反应条件都相同)。

①经分析,A和E两点对应的反应温度相同,其原因是KA=KB=______ (填数值)。该温度下,要提高CO平衡转化率,除了改变进气比之外,还可采取的措施是______ 。
②比较A、B两点对应的反应速率大小:vA______ vB(填“<”“=”或“>”)。.
(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。已知碳酸的电离常数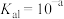 ,
,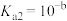 ,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中
,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中
______ 。

(1)已知:
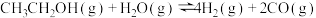
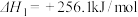
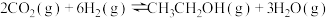

请写出反应II的热化学方程式
(2)反应II,在进气比[
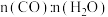 ]不同时,测得相应的CO平衡转化率见右图(各点的反应温度可能相同或不同,其他反应条件都相同)。
]不同时,测得相应的CO平衡转化率见右图(各点的反应温度可能相同或不同,其他反应条件都相同)。
①经分析,A和E两点对应的反应温度相同,其原因是KA=KB=
②比较A、B两点对应的反应速率大小:vA
(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。已知碳酸的电离常数
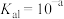 ,
, ,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中
,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】完成下列问题:
(1)可逆反应 △H,同时符合下列两图中各曲线的是:
△H,同时符合下列两图中各曲线的是:
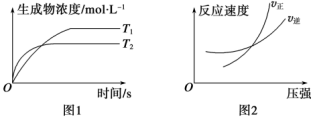

_______ 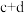 ;
;
_______  ;△H
;△H_______ 0(填“>”、“<”或“=”)。
(2)图象的变化是由某时刻改变条件引起的:
A.浓度减小B.加压C.降温
①确定 时刻的操作
时刻的操作_______ ; 时刻的操作
时刻的操作_______ ; 时刻的操作
时刻的操作_______ (填A、B、C) 。
②该反应正向是:_______ (吸、放)热反应。
③该反应气体物质的量_______ (增大、减小)的反应。
Ⅱ.反应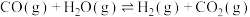 的平衡常数K随温度的变化如表所示:
的平衡常数K随温度的变化如表所示:
(3)从表中数据可以推断,此反应的正反应为_______ (填“吸热”或“放热”)反应。
(4)在830℃时,向恒容密闭容器中充入2mol CO(g),5mol (g),4mol
(g),4mol (g)和3mol
(g)和3mol (g),此时
(g),此时
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(1)可逆反应
 △H,同时符合下列两图中各曲线的是:
△H,同时符合下列两图中各曲线的是:

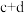 ;
;
 ;△H
;△H(2)图象的变化是由某时刻改变条件引起的:

A.浓度减小B.加压C.降温
①确定
 时刻的操作
时刻的操作 时刻的操作
时刻的操作 时刻的操作
时刻的操作②该反应正向是:
③该反应气体物质的量
Ⅱ.反应
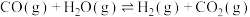 的平衡常数K随温度的变化如表所示:
的平衡常数K随温度的变化如表所示:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(4)在830℃时,向恒容密闭容器中充入2mol CO(g),5mol
 (g),4mol
(g),4mol (g)和3mol
(g)和3mol (g),此时
(g),此时
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】工业上利用C2H2制取C2H4的反应为C2H2(g)+H2(g) C2H4(g) △H。回答下列问题:
C2H4(g) △H。回答下列问题:
(1)H2可通过反应CH4(g)+H2O(g) CO(g)+3H2(g)获取。T℃时,向2L恒容密闭容器中充入1.2mol水蒸气和1.2molCH4(g),经过2min反应达平衡,平衡后测得CO的浓度为0.3mol•L-1,则0~2min内H2的平均反应速率为
CO(g)+3H2(g)获取。T℃时,向2L恒容密闭容器中充入1.2mol水蒸气和1.2molCH4(g),经过2min反应达平衡,平衡后测得CO的浓度为0.3mol•L-1,则0~2min内H2的平均反应速率为______ ,平衡时CH4的转化率为______ 。
(2)对于反应C2H2(g)+H2(g) C2H4(g),其他条件一定时,温度、压强对平衡时混合气体中C2H4体积分数的影响如图所示。
C2H4(g),其他条件一定时,温度、压强对平衡时混合气体中C2H4体积分数的影响如图所示。
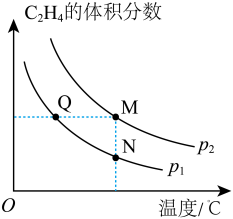
①该反应为______ 反应(填“吸热”或“放热”),压强:p1______ p2(填“>”“=”或“<”)。
②Q、M、N三点的平衡常数KQ、KM、KN的大小关系为______ 。
(3)对于反应C2H2(g)+H2(g) C2H4(g),为了增大反应速率,且增大H2的平衡转化率,下列措施一定可行的是
C2H4(g),为了增大反应速率,且增大H2的平衡转化率,下列措施一定可行的是_____ (填字母)。
a.降低温度 b.使用合适的催化剂
c.缩小容器容积 d.减小原料气中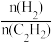 的比值
的比值
 C2H4(g) △H。回答下列问题:
C2H4(g) △H。回答下列问题:(1)H2可通过反应CH4(g)+H2O(g)
 CO(g)+3H2(g)获取。T℃时,向2L恒容密闭容器中充入1.2mol水蒸气和1.2molCH4(g),经过2min反应达平衡,平衡后测得CO的浓度为0.3mol•L-1,则0~2min内H2的平均反应速率为
CO(g)+3H2(g)获取。T℃时,向2L恒容密闭容器中充入1.2mol水蒸气和1.2molCH4(g),经过2min反应达平衡,平衡后测得CO的浓度为0.3mol•L-1,则0~2min内H2的平均反应速率为(2)对于反应C2H2(g)+H2(g)
 C2H4(g),其他条件一定时,温度、压强对平衡时混合气体中C2H4体积分数的影响如图所示。
C2H4(g),其他条件一定时,温度、压强对平衡时混合气体中C2H4体积分数的影响如图所示。
①该反应为
②Q、M、N三点的平衡常数KQ、KM、KN的大小关系为
(3)对于反应C2H2(g)+H2(g)
 C2H4(g),为了增大反应速率,且增大H2的平衡转化率,下列措施一定可行的是
C2H4(g),为了增大反应速率,且增大H2的平衡转化率,下列措施一定可行的是a.降低温度 b.使用合适的催化剂
c.缩小容器容积 d.减小原料气中
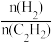 的比值
的比值
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】CO2-CH4干气重整反应制合成气(H2、CO)是CO2资源化利用的重要研究方向。其反应主要包括:
反应I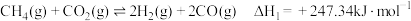
反应Ⅱ
(1)已知 H2(g)、CO(g)的燃烧热分别为285.8 kJ∙mol-1和283kJ∙mol-1,水的汽化热为44kJ∙mol-1,则△H2=_______ kJ∙mol-1;能同时提高CH4(g)的平衡转化率和反应速率的措施为_______ (写一条即可)。
(2)向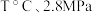 的恒压密闭容器中,充入1molCH4(g)和1mol CO2 (g)发生反应I和Ⅱ.达到平衡时,CO2的转化率为80%,
的恒压密闭容器中,充入1molCH4(g)和1mol CO2 (g)发生反应I和Ⅱ.达到平衡时,CO2的转化率为80%,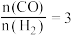 ,则平衡时气体的总物质的量
,则平衡时气体的总物质的量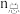 =
=_______ mol;反应Ⅰ的压强平衡常数Kp=_______ (MPa)2;若反应在刚性容器中达到平衡,则CO2(g)的转化率_______ (填“>”“=”或“<”)80%。
(3)实验研究发现,在(2)条件下,催化剂表面产生积碳与下列2个反应有关:
反应Ⅲ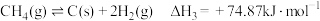
反应IV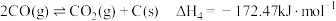
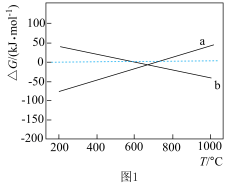
①已知ΔG=△H-TΔS,ΔG的值只取决于反应体系的始态和终态,忽略△H、ΔS随温度的变化,反应Ⅲ和反应IV的ΔG与T的关系如图1所示,其中表示反应Ⅲ的曲线为_______ (填“a”或“b”);在200~400℃时,催化剂表面产生的积碳主要来自于反应_______ (填“Ⅲ”或“IV”)。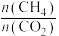 对催化剂表面积碳生成量的影响如图2、3所示。
对催化剂表面积碳生成量的影响如图2、3所示。_______ (填选项字母)。
A.压强一定时,增大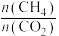 且升高温度
且升高温度
B.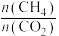 一定时,升高温度且减小压强
一定时,升高温度且减小压强
C.温度一定时,增大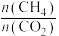 且增大压强
且增大压强
D.温度一定时,降低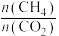 且减小压强
且减小压强
反应I
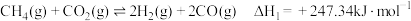
反应Ⅱ

(1)已知 H2(g)、CO(g)的燃烧热分别为285.8 kJ∙mol-1和283kJ∙mol-1,水的汽化热为44kJ∙mol-1,则△H2=
(2)向
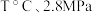 的恒压密闭容器中,充入1molCH4(g)和1mol CO2 (g)发生反应I和Ⅱ.达到平衡时,CO2的转化率为80%,
的恒压密闭容器中,充入1molCH4(g)和1mol CO2 (g)发生反应I和Ⅱ.达到平衡时,CO2的转化率为80%,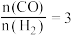 ,则平衡时气体的总物质的量
,则平衡时气体的总物质的量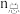 =
=(3)实验研究发现,在(2)条件下,催化剂表面产生积碳与下列2个反应有关:
反应Ⅲ
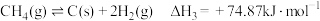
反应IV
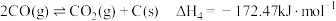
①已知ΔG=△H-TΔS,ΔG的值只取决于反应体系的始态和终态,忽略△H、ΔS随温度的变化,反应Ⅲ和反应IV的ΔG与T的关系如图1所示,其中表示反应Ⅲ的曲线为
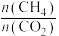 对催化剂表面积碳生成量的影响如图2、3所示。
对催化剂表面积碳生成量的影响如图2、3所示。
A.压强一定时,增大
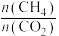 且升高温度
且升高温度B.
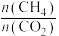 一定时,升高温度且减小压强
一定时,升高温度且减小压强C.温度一定时,增大
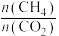 且增大压强
且增大压强D.温度一定时,降低
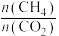 且减小压强
且减小压强
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】在硫酸工业中,通过下列反应使SO2氧化为SO3:2SO2(g)+O2(g)⇌2SO3(g) △H=-196.6kJ/mol。其实验数据如下:
(1)应选用的温度是_______ 左右,应选用的压强约是_______ 。
(2)实际生产中原料气含SO2为7%(体积分数)、O2为11%。O2相对过量的理由是_______ 。
(3)尾气中SO2必须回收的主要原因是_______ 。
(4)分别在不同温度T1°C、T2°C以及起始压力为0.10MPa下,向恒容容器中通入SO2和O2[其中n(SO2):n(O2)=2:1],测得容器内总压强随时间变化如图所示。

①其他条件不变时,A、B两点的v逆较大者为_______ 。
②B点的分压平衡常数Kp=_______ (答计算结果。分压=总压×物质的量分数)。
③必须在高温下才能启动,原因是_______ 。
④下列措施能提高SO2转化效率的是_______
A.适当减压
B.增大催化剂的比表面积
C.合理控制反应器中气体的流速
D.反应器前段加热,后段冷却
(5)若向恒容恒温容器(1.00L)中各加入2.00molSO2、3.00molO2,测得反应过程中容器内n(SO2)随时间变化关系如下:
a值最可能是_______ 。
| 温度 | 不同压强下SO2的平衡转化率 | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450°C | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550°C | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)应选用的温度是
(2)实际生产中原料气含SO2为7%(体积分数)、O2为11%。O2相对过量的理由是
(3)尾气中SO2必须回收的主要原因是
(4)分别在不同温度T1°C、T2°C以及起始压力为0.10MPa下,向恒容容器中通入SO2和O2[其中n(SO2):n(O2)=2:1],测得容器内总压强随时间变化如图所示。

①其他条件不变时,A、B两点的v逆较大者为
②B点的分压平衡常数Kp=
③必须在高温下才能启动,原因是
④下列措施能提高SO2转化效率的是
A.适当减压
B.增大催化剂的比表面积
C.合理控制反应器中气体的流速
D.反应器前段加热,后段冷却
(5)若向恒容恒温容器(1.00L)中各加入2.00molSO2、3.00molO2,测得反应过程中容器内n(SO2)随时间变化关系如下:
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(SO2)/mol | 2.00 | 1.60 | 1.40 | a | 1.25 | 1.225 | 1.225 |
a值最可能是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】环氧乙烷( )是重要的化工原料,用环氧化法生产。
)是重要的化工原料,用环氧化法生产。
主反应(反应①):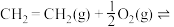

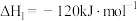
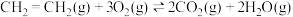
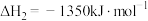
1.基态碳原子轨道表示式为___________。(不定项)
A. | B. | C. | D.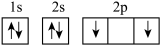 |
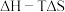 随温度变化的是___________。
随温度变化的是___________。A. | B. | C. | D. |
| A.混合气体的密度保持不变 |
| B.混合气体的平均相对分子质量保持不变 |
C.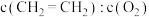 保持不变 保持不变 |
D.每消耗 同时生成 同时生成 的环氧乙烷 的环氧乙烷 |

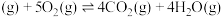 的
的
 。(填写计算数值)
。(填写计算数值) 在
 的恒容密闭容器中充入
的恒容密闭容器中充入 乙烯和
乙烯和 ,仅发生反应①和反应②,相同时间
,仅发生反应①和反应②,相同时间 后测得乙烯的转化率
后测得乙烯的转化率 及
及 的浓度随温度变化如下图:
的浓度随温度变化如下图:
 反应进行
反应进行 时乙烯的消耗速率为
时乙烯的消耗速率为 。
。600℃时测得环氧乙烷的选择性2/3(环氧乙烷选择性
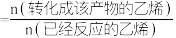 )
)6.写出主反应的平衡常数表达式
7.根据图表数据,
 下,
下, 时该容器中
时该容器中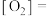
 ,该温度下主反应的平衡常数数值为
,该温度下主反应的平衡常数数值为其他烯烃也能与
 在催化剂存在下发生环氧化。有四种烯烃结构如下:
在催化剂存在下发生环氧化。有四种烯烃结构如下: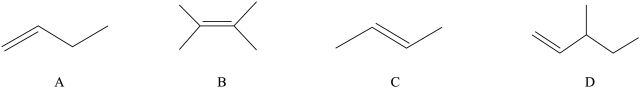
9.上述存在立体异构现象的烯烃是
10.写出A发生环氧化生成的有机物的结构简式
除乙烯氧化法(路径一),路径二也是制备环氧乙烷的工业方法
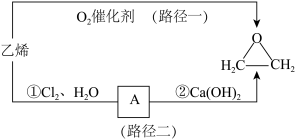
12.请从绿色化学角度评价上述两种制备方案
(相对原子质量:H-1 O-16 C1-35.5)
您最近一年使用:0次



