NOx是形成雾霾天气的主要原因之一,以NOx为主的污染综合治理是当前重要的研究课题。
(1)通常可采用氢气进行催化还原,消除NO造成的污染。
已知:①N2(g)+O2(g)=2NO(g) ∆H=akJ·mol-1;
②2H2(g)+O2(g)=2H2O(l) ∆H=bkJ·mol-1;
③H2O(g)=H2O(l) ∆H=ckJ·mol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:___________ 。
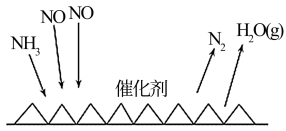
(2)用NH3催化还原氮氧化物(SCR)技术是常见的烟气氮氧化物脱除技术。反应原理如图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应。当有15mol电子发生转移时,则参与反应的NO的物质的量为___________ 。
(3)可用电解法将硝酸工业的尾气NO转变为NH4NO3,其工作原理如图:
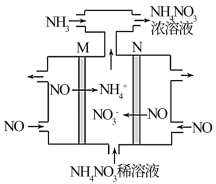
M极接电源的___________ 极,N极的电极反应式为___________ 。
(4)汽车尾气中的NO、以NO为主,净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)∆H=akJ·mol-1,在500℃时,向恒容密闭体系中通入5mol的NO和5mol的CO进行反应时,体系中压强与时间的关系如图所示:
2CO2(g)+N2(g)∆H=akJ·mol-1,在500℃时,向恒容密闭体系中通入5mol的NO和5mol的CO进行反应时,体系中压强与时间的关系如图所示:

500℃时的平衡常数Kp=___________ Mpa-1,(Kp为以平衡分压表示的平衡常数,平衡分压=总压×物质的量分数)。若在4min改变的条件为升高温度,Kp减小,则a___________ 0(填“大于”“小于”或“等于”)。
(1)通常可采用氢气进行催化还原,消除NO造成的污染。
已知:①N2(g)+O2(g)=2NO(g) ∆H=akJ·mol-1;
②2H2(g)+O2(g)=2H2O(l) ∆H=bkJ·mol-1;
③H2O(g)=H2O(l) ∆H=ckJ·mol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:
(2)用NH3催化还原氮氧化物(SCR)技术是常见的烟气氮氧化物脱除技术。反应原理如图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应。当有15mol电子发生转移时,则参与反应的NO的物质的量为

(3)可用电解法将硝酸工业的尾气NO转变为NH4NO3,其工作原理如图:

M极接电源的
(4)汽车尾气中的NO、以NO为主,净化的主要原理为:2NO(g)+2CO(g)
 2CO2(g)+N2(g)∆H=akJ·mol-1,在500℃时,向恒容密闭体系中通入5mol的NO和5mol的CO进行反应时,体系中压强与时间的关系如图所示:
2CO2(g)+N2(g)∆H=akJ·mol-1,在500℃时,向恒容密闭体系中通入5mol的NO和5mol的CO进行反应时,体系中压强与时间的关系如图所示:
500℃时的平衡常数Kp=
更新时间:2021-07-20 22:28:21
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】乙二醇是重要的化工原料,通过下列过程可实现煤到乙二醇的转化。

(1)“气化”中主要反应:验共酬巷|
反应I:
反应II: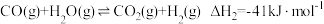
反应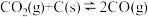 的
的
_______  。
。
(2)“转化1”中主要反应:
反应III: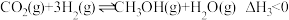
反应IV: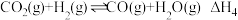
将 和
和 按一定比例投入恒容密闭容器中,分别在
按一定比例投入恒容密闭容器中,分别在 和
和 下达到平衡,
下达到平衡, 下
下 平衡转化率更大、甲醇的产率较低,原因是
平衡转化率更大、甲醇的产率较低,原因是_______ 。
(3)“转化2”中的总反应为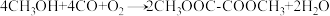 ,该转化分为两步进行,第一步为
,该转化分为两步进行,第一步为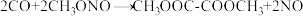 ,机理如图所示。
,机理如图所示。
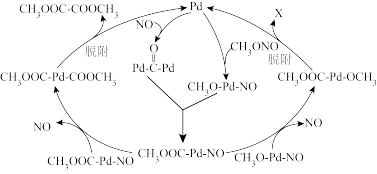
①化合物X的结构简式为_______ 。
② 中混有的少量
中混有的少量 ,会在
,会在 表面形成
表面形成 中间体参与反应,生成的有机物有
中间体参与反应,生成的有机物有 、
、_______ 。
③“转化2”的第二步为 和
和 进行的
进行的 再生反应,反应的化学方程式为
再生反应,反应的化学方程式为_______ 。
(4)“转化3”生成乙二醇和甲醇,每生成 乙二醇转移的电子为
乙二醇转移的电子为_______  。
。

(1)“气化”中主要反应:验共酬巷|
反应I:

反应II:
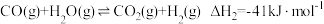
反应
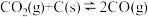 的
的
 。
。(2)“转化1”中主要反应:
反应III:
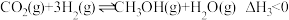
反应IV:
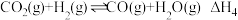
将
 和
和 按一定比例投入恒容密闭容器中,分别在
按一定比例投入恒容密闭容器中,分别在 和
和 下达到平衡,
下达到平衡, 下
下 平衡转化率更大、甲醇的产率较低,原因是
平衡转化率更大、甲醇的产率较低,原因是(3)“转化2”中的总反应为
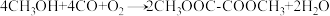 ,该转化分为两步进行,第一步为
,该转化分为两步进行,第一步为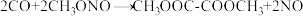 ,机理如图所示。
,机理如图所示。
①化合物X的结构简式为
②
 中混有的少量
中混有的少量 ,会在
,会在 表面形成
表面形成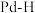 中间体参与反应,生成的有机物有
中间体参与反应,生成的有机物有 、
、③“转化2”的第二步为
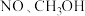 和
和 进行的
进行的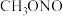 再生反应,反应的化学方程式为
再生反应,反应的化学方程式为(4)“转化3”生成乙二醇和甲醇,每生成
 乙二醇转移的电子为
乙二醇转移的电子为 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】在2 L密闭容器中,加入等物质的量的NO和O2,800℃时发生反应:2NO(g)+O2(g)→2NO2(g),其中n(NO)随时间的变化如表:
(1)上述反应________ (填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是______ 。
(3)用O2表示从0~2s内该反应的平均速率v=________ ,5s时O2的转化率为_____________ 。
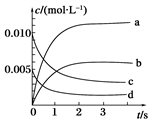
(4)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化如图所示。写出该反应的热化学方程式:_______________________ 。
(5)以N2和H2为反应物,盐酸酸化的NH4Cl溶液为电解质的原电池,工作原理如下图所示,下列说法不正确的是___________ 。
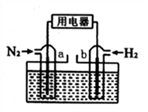
A.b电极为负极
B.反应过程中,溶液中的Cl-向a电极移动
C.a电极的电极反应式为:N2+6e-+8H+=2NH4+
D.电池反应为N2+3H2+2HCl=2NH4Cl
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应
(2)如图所示,表示NO2变化曲线的是

(3)用O2表示从0~2s内该反应的平均速率v=
(4)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化如图所示。写出该反应的热化学方程式:

(5)以N2和H2为反应物,盐酸酸化的NH4Cl溶液为电解质的原电池,工作原理如下图所示,下列说法不正确的是

A.b电极为负极
B.反应过程中,溶液中的Cl-向a电极移动
C.a电极的电极反应式为:N2+6e-+8H+=2NH4+
D.电池反应为N2+3H2+2HCl=2NH4Cl
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】建设生态文明,研究碳的化合物对减少CO2在大气中累积及实现可再生能源的有效利用具有重要意义。
(1)已知有关化学键的键能E数据如下
CO2和H2在一定条件下能发生反应:CO2(g)+H2(g)⇌HCOOH(g),该反应的活化能为akJ·mol-1,其反应过程如图所示,则Ea2=_______ kJ/mol(用含a的代数式表示)
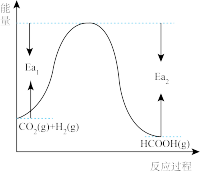
(2)该反应在_______ (填“高温”或“低温”)能自发进行。
(3)一定温度下,在一刚性密闭容器中,充入等物质的量的CO2和H2,此时容器的压强为48kPa,发生以上反应,6min时达到平衡,此时容器压强为30KPa,则0~6min内用H2的分压表示反应速率为_______ 。该温度下,此反应的平衡常数KP=_______ (KP是平衡分压代替平衡浓度计算的平衡常数)。
(4)恒温恒容条件下,为了提高CO2的转化率,可采取的措施为_______ (写一点即可),能说明该反应达到平衡状态的是_______ (填字母)。
A.混合气体的密度不再变化
B.甲酸的浓度不变
C.CO2的消耗速率与HCOOH的生成速率相等
D.混合气体的平均相对分子质量不再变化
(5)利用太阳能电池电解能实现CO2转化为HCOOH,如图所示。
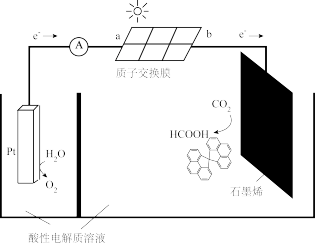
①电解过程中,b极发生的电极反应式为_______
②每转移1mol电子,阳极区溶液质量减轻_______ g。
(1)已知有关化学键的键能E数据如下
| 化学键 | C=O | H—H | C—H | C—O | O—H |
| E/(KJ·mol-1) | 745 | 436 | 413 | 356 | 463 |

(2)该反应在
(3)一定温度下,在一刚性密闭容器中,充入等物质的量的CO2和H2,此时容器的压强为48kPa,发生以上反应,6min时达到平衡,此时容器压强为30KPa,则0~6min内用H2的分压表示反应速率为
(4)恒温恒容条件下,为了提高CO2的转化率,可采取的措施为
A.混合气体的密度不再变化
B.甲酸的浓度不变
C.CO2的消耗速率与HCOOH的生成速率相等
D.混合气体的平均相对分子质量不再变化
(5)利用太阳能电池电解能实现CO2转化为HCOOH,如图所示。

①电解过程中,b极发生的电极反应式为
②每转移1mol电子,阳极区溶液质量减轻
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】含碳化合物的资源化综合利用,不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)利用CO、CO2和H2在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-58kJ·mol-1
③CO2(g)+H2(g)=CO(g)+H2O(g) △H
反应③的△H=_______ kJ·mol-1。
(2)工业上可通过甲醇洗基化法制取甲酸甲酯,反应为:CH3OH(g)+CO(g) HCOOCH3(g) △H=-29.1kJ·mol-1。
HCOOCH3(g) △H=-29.1kJ·mol-1。
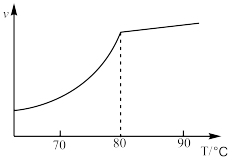
①科研人员对该反应进行了研究,在一定压强时,温度对反应速率的影响如图所示。实际工业生产中采用的温度是80℃,其理由是_______ 。
②反应过程发生副反应:2CH3OH(g) HCOOCH3(g)+2H2(g)。该反应的机理分二步完成,可以用如图表示:
HCOOCH3(g)+2H2(g)。该反应的机理分二步完成,可以用如图表示:
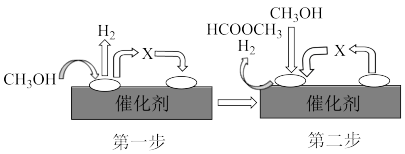
写出第二步的反应方程式_______ 。
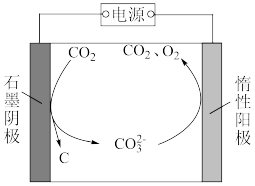
(3)华盛顿大学的研究人员研究出一种方法,可实现CO2零排放,其基本原理如图所示:反应温度控制在900℃时,电解质为熔融碳酸钠。电解过程中碳元素转化的过程可描述为_______ 。
(4)CO2气氛下乙苯催化脱氢制苯乙烯的反应为: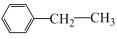 (g)+CO2(g)
(g)+CO2(g)
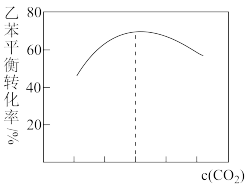
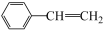 (g)+CO(g)+H2O(g)。原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加CO2浓度,乙苯平衡转化率与CO2浓度的关系如图所示,请解释乙苯平衡转化率随着CO2浓度变化的原因
(g)+CO(g)+H2O(g)。原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加CO2浓度,乙苯平衡转化率与CO2浓度的关系如图所示,请解释乙苯平衡转化率随着CO2浓度变化的原因_______ 。
(1)利用CO、CO2和H2在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-58kJ·mol-1
③CO2(g)+H2(g)=CO(g)+H2O(g) △H
反应③的△H=
(2)工业上可通过甲醇洗基化法制取甲酸甲酯,反应为:CH3OH(g)+CO(g)
 HCOOCH3(g) △H=-29.1kJ·mol-1。
HCOOCH3(g) △H=-29.1kJ·mol-1。①科研人员对该反应进行了研究,在一定压强时,温度对反应速率的影响如图所示。实际工业生产中采用的温度是80℃,其理由是

②反应过程发生副反应:2CH3OH(g)
 HCOOCH3(g)+2H2(g)。该反应的机理分二步完成,可以用如图表示:
HCOOCH3(g)+2H2(g)。该反应的机理分二步完成,可以用如图表示:
写出第二步的反应方程式
(3)华盛顿大学的研究人员研究出一种方法,可实现CO2零排放,其基本原理如图所示:反应温度控制在900℃时,电解质为熔融碳酸钠。电解过程中碳元素转化的过程可描述为

(4)CO2气氛下乙苯催化脱氢制苯乙烯的反应为:
 (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g)。原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加CO2浓度,乙苯平衡转化率与CO2浓度的关系如图所示,请解释乙苯平衡转化率随着CO2浓度变化的原因
(g)+CO(g)+H2O(g)。原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加CO2浓度,乙苯平衡转化率与CO2浓度的关系如图所示,请解释乙苯平衡转化率随着CO2浓度变化的原因
您最近一年使用:0次
【推荐2】研究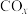 、
、 、
、 等气体的综合利用和污染防治具有重要意义。回答下列问题:
等气体的综合利用和污染防治具有重要意义。回答下列问题:
(1)处理含CO、 烟道气污染的一种方法是将其在催化剂作用下转化为
烟道气污染的一种方法是将其在催化剂作用下转化为 和单质S。
和单质S。
已知:
①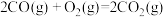
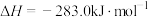
②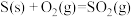

则CO和 气体反应生成固态硫和
气体反应生成固态硫和 气体的热化学方程式为
气体的热化学方程式为___________ 。
(2) 用NiO作载氧体的“化学链燃烧”示意图如下所示,该过程有利于
用NiO作载氧体的“化学链燃烧”示意图如下所示,该过程有利于 的分离和回收,主要热化学方程式如下:
的分离和回收,主要热化学方程式如下:

①

②
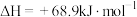
则 的燃烧热
的燃烧热
___________ ; 通过“化学链燃烧”所放出的热量在相同条件下与
通过“化学链燃烧”所放出的热量在相同条件下与 直接燃烧相比
直接燃烧相比___________ (填“前者大”“后者大”或“相同”)。
(3)氮氧化物是形成光化学烟雾和酸雨的一个重要原因。已知:
①

②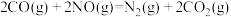
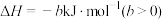
若用标准状况下3.36LCO将 还原至
还原至 (CO完全反应)的整个过程中转移电子的物质的量为
(CO完全反应)的整个过程中转移电子的物质的量为___________ mol,放出的热量为___________ kJ(用含有a和b的代数式表示)。
(4)工业上,二氧化碳和氢气在催化剂作用下可以制备甲醇:

①已知上述反应中相关的化学键键能数据如下:
则该反应的
___________ 。
②该反应在催化剂条件下反应历程如图所示,其中吸附在催化剂表面的物种用*标注,TS为过渡态。
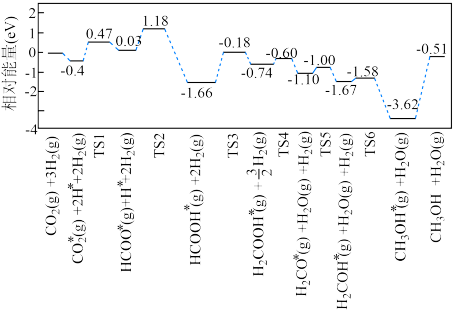
该历程中,最大能垒(活化能)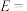
___________ eV,写出该步骤的化学方程式___________ 。
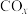 、
、 、
、 等气体的综合利用和污染防治具有重要意义。回答下列问题:
等气体的综合利用和污染防治具有重要意义。回答下列问题:(1)处理含CO、
 烟道气污染的一种方法是将其在催化剂作用下转化为
烟道气污染的一种方法是将其在催化剂作用下转化为 和单质S。
和单质S。已知:
①
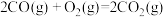
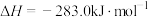
②
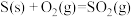

则CO和
 气体反应生成固态硫和
气体反应生成固态硫和 气体的热化学方程式为
气体的热化学方程式为(2)
 用NiO作载氧体的“化学链燃烧”示意图如下所示,该过程有利于
用NiO作载氧体的“化学链燃烧”示意图如下所示,该过程有利于 的分离和回收,主要热化学方程式如下:
的分离和回收,主要热化学方程式如下:
①


②

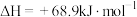
则
 的燃烧热
的燃烧热
 通过“化学链燃烧”所放出的热量在相同条件下与
通过“化学链燃烧”所放出的热量在相同条件下与 直接燃烧相比
直接燃烧相比(3)氮氧化物是形成光化学烟雾和酸雨的一个重要原因。已知:
①


②
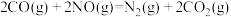
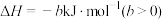
若用标准状况下3.36LCO将
 还原至
还原至 (CO完全反应)的整个过程中转移电子的物质的量为
(CO完全反应)的整个过程中转移电子的物质的量为(4)工业上,二氧化碳和氢气在催化剂作用下可以制备甲醇:

①已知上述反应中相关的化学键键能数据如下:
| 化学键 |  |  |  |  |  |
 | 436 | 745 | 463 | 413 | 351 |

②该反应在催化剂条件下反应历程如图所示,其中吸附在催化剂表面的物种用*标注,TS为过渡态。

该历程中,最大能垒(活化能)
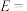
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。减轻汽车尾气(CO、NOx)对大气的污染,对这些排放气的处理以及再利用是化学工作者研究的重要课题。请思考回答下列问题:
Ⅰ.已知H2还原CO合成甲醇的热化学方程式为:
①CO(g)+2H2(g) CH3OH(g) △H1,K1;
CH3OH(g) △H1,K1;
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=–49kJ·mol-1,K2;
CH3OH(g)+H2O(g) △H2=–49kJ·mol-1,K2;
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=–41.1kJ·mol-1,K3;
CO2(g)+H2(g) △H3=–41.1kJ·mol-1,K3;
(1)则△H1=_______ ,K2=_______ (用K1、K3表示)。
Ⅱ. 是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)
是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中为速率常数。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中为速率常数。
(2)则Kp=_______ (用 表示)。
表示)。
Ⅲ.已知4CO(g)+2NO2(g) 4CO2(g)+N2(g) ∆H=﹣1200kJ•mol﹣1,在恒温恒容下发生上述反应。
4CO2(g)+N2(g) ∆H=﹣1200kJ•mol﹣1,在恒温恒容下发生上述反应。
(3)能说明该反应达到化学平衡状态的是_______ (填代号)。
a.v正(CO)=4v逆(N2)
b.CO2和N2的体积比保持不变
c.混合气体的平均相对分子质量保持不变
d.混合气体的密度保持不变
(4)某温度下,向1L恒容密闭容器中充入2molCO和1molNO2,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
①0~10min用CO2的浓度变化表示的反应速率为_______ 。
②此温度下,反应的平衡常数Kp=_______ kPa–1(Kp为以分压表示的平衡常数);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡_______ (填“右移”、“左移”或“不移动”)。
Ⅰ.已知H2还原CO合成甲醇的热化学方程式为:
①CO(g)+2H2(g)
 CH3OH(g) △H1,K1;
CH3OH(g) △H1,K1;②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2=–49kJ·mol-1,K2;
CH3OH(g)+H2O(g) △H2=–49kJ·mol-1,K2;③CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=–41.1kJ·mol-1,K3;
CO2(g)+H2(g) △H3=–41.1kJ·mol-1,K3;(1)则△H1=
Ⅱ.
 是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)
是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中为速率常数。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中为速率常数。(2)则Kp=
 表示)。
表示)。Ⅲ.已知4CO(g)+2NO2(g)
 4CO2(g)+N2(g) ∆H=﹣1200kJ•mol﹣1,在恒温恒容下发生上述反应。
4CO2(g)+N2(g) ∆H=﹣1200kJ•mol﹣1,在恒温恒容下发生上述反应。(3)能说明该反应达到化学平衡状态的是
a.v正(CO)=4v逆(N2)
b.CO2和N2的体积比保持不变
c.混合气体的平均相对分子质量保持不变
d.混合气体的密度保持不变
(4)某温度下,向1L恒容密闭容器中充入2molCO和1molNO2,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| 压强/kPa | 120 | 117.44 | 115.36 | 113.12 | 111.52 | 110 | 110 |
②此温度下,反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.已知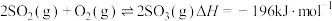 ,500℃时将2molSO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(
,500℃时将2molSO2和1molO2装入一体积恒定的10L密闭容器中,2分钟( )时达到平衡。如下图所示:
)时达到平衡。如下图所示:
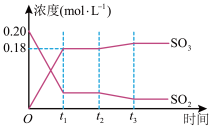
请回答下列问题:
(1)用 表示2分钟内该反应的平均反应速率为
表示2分钟内该反应的平均反应速率为_____  。计算500℃时该反应的平衡常数
。计算500℃时该反应的平衡常数
_____ 。
(2)上图表示该反应在时刻 达到平衡后,时刻
达到平衡后,时刻 因改变某个条件而发生变化的情况:图中时刻
因改变某个条件而发生变化的情况:图中时刻 发生改变的条件可能是
发生改变的条件可能是_____ (写一个即可)。
(3)某温度时,该反应的平衡常数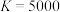 ,则该温度
,则该温度_____ 500℃(填“>”、“<”、“=”)。
(4)500℃时,若起始装入的 、
、 和
和 分别为0.2mol、ymol、wmol,达到平衡时各组分的含量与起始装入的
分别为0.2mol、ymol、wmol,达到平衡时各组分的含量与起始装入的 和
和 各2mol,达平衡后完全相同,则
各2mol,达平衡后完全相同,则
_____ mol。刚开始时反应向_____ (填“正”或“逆”)反应方向进行。
Ⅱ.研究NOx之间的转化具有重要意义。NO氧化反应: 分两步进行,其反应过程能量变化示意图如图。
分两步进行,其反应过程能量变化示意图如图。

①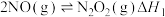
②
(5)决定NO氧化反应速率的步骤是_____ (填“①”或“②”)。
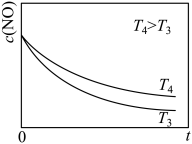
(6)在恒容的密闭容器中充入一定量的NO和 气体,保持其它条件不变,控制反应温度分别为
气体,保持其它条件不变,控制反应温度分别为 和
和 (
( ),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度
),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____ (填“ ”或“
”或“ ”)下消耗的时间较长,试结合反应过程能量图分析其原因
”)下消耗的时间较长,试结合反应过程能量图分析其原因_____ 。
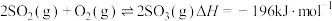 ,500℃时将2molSO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(
,500℃时将2molSO2和1molO2装入一体积恒定的10L密闭容器中,2分钟( )时达到平衡。如下图所示:
)时达到平衡。如下图所示:
请回答下列问题:
(1)用
 表示2分钟内该反应的平均反应速率为
表示2分钟内该反应的平均反应速率为 。计算500℃时该反应的平衡常数
。计算500℃时该反应的平衡常数
(2)上图表示该反应在时刻
 达到平衡后,时刻
达到平衡后,时刻 因改变某个条件而发生变化的情况:图中时刻
因改变某个条件而发生变化的情况:图中时刻 发生改变的条件可能是
发生改变的条件可能是(3)某温度时,该反应的平衡常数
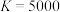 ,则该温度
,则该温度(4)500℃时,若起始装入的
 、
、 和
和 分别为0.2mol、ymol、wmol,达到平衡时各组分的含量与起始装入的
分别为0.2mol、ymol、wmol,达到平衡时各组分的含量与起始装入的 和
和 各2mol,达平衡后完全相同,则
各2mol,达平衡后完全相同,则
Ⅱ.研究NOx之间的转化具有重要意义。NO氧化反应:
 分两步进行,其反应过程能量变化示意图如图。
分两步进行,其反应过程能量变化示意图如图。
①
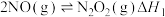
②

(5)决定NO氧化反应速率的步骤是
(6)在恒容的密闭容器中充入一定量的NO和
 气体,保持其它条件不变,控制反应温度分别为
气体,保持其它条件不变,控制反应温度分别为 和
和 (
( ),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度
),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度 ”或“
”或“ ”)下消耗的时间较长,试结合反应过程能量图分析其原因
”)下消耗的时间较长,试结合反应过程能量图分析其原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某小组设计实验研究单一组分浓度对化学平衡 的影响。
的影响。
【实验过程】

(1)待试管a中溶液的颜色不变后再进行后续实验,其目的是_______
(2)实验I:研究增大反应物 浓度对平衡的影响,实验方案如下:
浓度对平衡的影响,实验方案如下:
取少量试管a中棕黄色溶液于试管中,加入1~2滴饱和 溶液,溶液颜色加深,原因是:增大
溶液,溶液颜色加深,原因是:增大 浓度,导致Q
浓度,导致Q_______ K(填“>”或“<”),平衡向_______ (填“正反应”或“逆反应”)方向移动。
(3)实验Ⅱ:研究增大生成物 浓度对平衡的影响,实验方案如下图所示:
浓度对平衡的影响,实验方案如下图所示:

①请在图中将方案补充完整。_______
②能够证明增大生成物 浓度导致平衡移动的实验现象为
浓度导致平衡移动的实验现象为_______ 。
【实验反思】
(4)实验I、II从不同的角度佐证了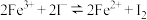 是一个可逆反应。
是一个可逆反应。
角度1:证明反应物不能完全被消耗,存在限度。相应的实验为_______ 。(填“I”或“II”)
角度2:_______ 。
 的影响。
的影响。【实验过程】

(1)待试管a中溶液的颜色不变后再进行后续实验,其目的是
(2)实验I:研究增大反应物
 浓度对平衡的影响,实验方案如下:
浓度对平衡的影响,实验方案如下:取少量试管a中棕黄色溶液于试管中,加入1~2滴饱和
 溶液,溶液颜色加深,原因是:增大
溶液,溶液颜色加深,原因是:增大 浓度,导致Q
浓度,导致Q(3)实验Ⅱ:研究增大生成物
 浓度对平衡的影响,实验方案如下图所示:
浓度对平衡的影响,实验方案如下图所示:
①请在图中将方案补充完整。
②能够证明增大生成物
 浓度导致平衡移动的实验现象为
浓度导致平衡移动的实验现象为【实验反思】
(4)实验I、II从不同的角度佐证了
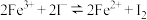 是一个可逆反应。
是一个可逆反应。角度1:证明反应物不能完全被消耗,存在限度。相应的实验为
角度2:
您最近一年使用:0次
【推荐3】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
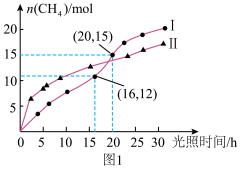
(1)利用光能和光催化剂,可将 CO2和 H2O(g)转化为 CH4,图 1 为在恒温、紫外光照射、不同催化剂(Ⅰ、II) 作用下,在体积为 2L 的密闭容器中,CH4的量随光照时间的变化。反应开始后的 16 小时内,在第_______ 种催化剂作用下, 收集的 CH4 较多;0~20 小时内,在第 I 种催化剂作用下,O2的平均生成速率 v(O2) = ______________ 。
(2)工业上常用 CH4和水蒸气在一定条件下的恒温恒容密闭容器中制取 H2 :
CH4(g)+H2O(g) ⇌ CO(g)+3H2(g)
①反应 CH4(g)+H2O(g)⇌ CO(g)+3H2(g)的△H=______ kJ/mol
已知:a.C(s)+2H2(g)= CH4(g) △H= -75 kJ/mol
b.2H2(g)+O2(g)=2H2O(l) △H= -484 kJ/mol
c.2C(s)+O2(g)=2CO(g) △H= -222 kJ/mol
②下列说法能表明该反应达平衡状态的是__________ (填字母)。
a.体系的温度不再变化
b.气体的平均摩尔质量不再变化
c.体系的密度保持不变
d.消耗 1mol CH4同时断裂 3 mol H-H 键
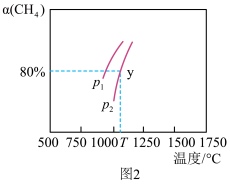
③一定温度时,在体积为 2L 的恒容密闭容器中,充入 0.25mol 的 CH4和 0.25mol 的水蒸气发生以上反应。测得CH4平衡时的转化率与温度、压强的关系如图 2 所示,则 p1________ (填“>”“<”或“=”) p2;温度为 1100℃时,y 点的平衡常数 K= ________ 。
.
(1)利用光能和光催化剂,可将 CO2和 H2O(g)转化为 CH4,图 1 为在恒温、紫外光照射、不同催化剂(Ⅰ、II) 作用下,在体积为 2L 的密闭容器中,CH4的量随光照时间的变化。反应开始后的 16 小时内,在第

(2)工业上常用 CH4和水蒸气在一定条件下的恒温恒容密闭容器中制取 H2 :
CH4(g)+H2O(g) ⇌ CO(g)+3H2(g)
①反应 CH4(g)+H2O(g)⇌ CO(g)+3H2(g)的△H=
已知:a.C(s)+2H2(g)= CH4(g) △H= -75 kJ/mol
b.2H2(g)+O2(g)=2H2O(l) △H= -484 kJ/mol
c.2C(s)+O2(g)=2CO(g) △H= -222 kJ/mol
②下列说法能表明该反应达平衡状态的是
a.体系的温度不再变化
b.气体的平均摩尔质量不再变化
c.体系的密度保持不变
d.消耗 1mol CH4同时断裂 3 mol H-H 键
③一定温度时,在体积为 2L 的恒容密闭容器中,充入 0.25mol 的 CH4和 0.25mol 的水蒸气发生以上反应。测得CH4平衡时的转化率与温度、压强的关系如图 2 所示,则 p1
.

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】 催化重整不仅可以得到合成气(CO和
催化重整不仅可以得到合成气(CO和 ),还对温室气体的减排具有重要意义。回答下列问题:
),还对温室气体的减排具有重要意义。回答下列问题:
(1) 催化重整反应为
催化重整反应为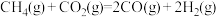 。
。
已知: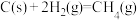 ∆H=-75
∆H=-75
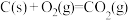 ∆H=-394
∆H=-394
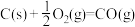 ∆H=-111
∆H=-111
该催化重整反应的∆H________  。有利于提高
。有利于提高 平衡转化率的条件是
平衡转化率的条件是________ (填标号)。
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2L的容器中加入2mol 、1mol
、1mol 以及催化剂进行重整反应,达到平衡时
以及催化剂进行重整反应,达到平衡时 的转化率是50%,其平衡常数为
的转化率是50%,其平衡常数为__________ 。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
由上表判断,催化剂X________ Y(填“优于”或“劣于”),理由是__________________ 。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示,升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是__________ (填标号)。
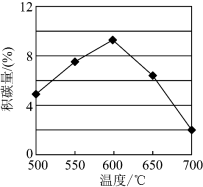
A.K积、K消均增加B.v消减小、v积增加
C.K积减小、K消增加D.v消增加的倍数比v积增加的倍数大
 催化重整不仅可以得到合成气(CO和
催化重整不仅可以得到合成气(CO和 ),还对温室气体的减排具有重要意义。回答下列问题:
),还对温室气体的减排具有重要意义。回答下列问题:(1)
 催化重整反应为
催化重整反应为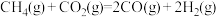 。
。已知:
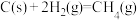 ∆H=-75
∆H=-75
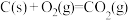 ∆H=-394
∆H=-394
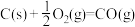 ∆H=-111
∆H=-111
该催化重整反应的∆H
 。有利于提高
。有利于提高 平衡转化率的条件是
平衡转化率的条件是A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2L的容器中加入2mol
 、1mol
、1mol 以及催化剂进行重整反应,达到平衡时
以及催化剂进行重整反应,达到平衡时 的转化率是50%,其平衡常数为
的转化率是50%,其平衡常数为(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应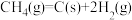 | 消碳反应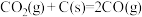 | ||
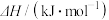 | 75 | 172 | |
活化能/( ) ) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |
由上表判断,催化剂X

A.K积、K消均增加B.v消减小、v积增加
C.K积减小、K消增加D.v消增加的倍数比v积增加的倍数大
您最近一年使用:0次
【推荐2】Ⅰ.双组元液体推进剂是一类重要的“火箭燃料”,其由燃烧剂和助燃剂组成;肼(N2H4)、偏二甲肼(C2H8N2)是常用的燃烧剂。长征二号是我国研制的第一代液体运载火箭,其推进剂配方为 和
和 。
。
(1) 和
和 点燃生成的三种产物均无毒无害,化学方程式为:
点燃生成的三种产物均无毒无害,化学方程式为:___________ 。
(2)含有 的燃料废水会造成污染,可采用氯化法处理;以下不适宜用作氯化试剂的是___________。
的燃料废水会造成污染,可采用氯化法处理;以下不适宜用作氯化试剂的是___________。
Ⅱ.在 恒容绝热容器中充入
恒容绝热容器中充入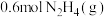 ,一定温度下发生反应:
,一定温度下发生反应:
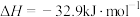 ,
, 的转化率随时间变化情况如图所示:
的转化率随时间变化情况如图所示:
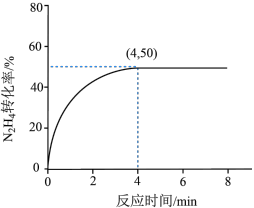
(3) 内,
内, 的反应速率为
的反应速率为___________ ,该温度下此反应的平衡常数为___________ (保留2位有效数字)。
(4)下列能够表明上述反应已达到平衡状态的有___________。
(5)写出一种提高 平衡转化率的方法:
平衡转化率的方法:___________ 。
Ⅲ肼不仅可以给火箭当粮食,还可以摇身一变成为氢气“储蓄罐”。是一种高选择性的肼分解制氢催化剂,催化反应机理如图所示,反应如下:

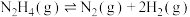
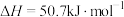
(6)根据上述信息,推测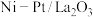 ___________。
___________。
Ⅳ.肼类燃烧剂会造成污染,这种粮食正逐渐被淘汰。长征五号B是我国近地轨道运载能力最大的新一代运载火箭,其粮食采用全新配方——低温液氢液氧推进剂,让火箭飞得更稳健。已知一定条件下:
①
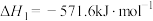
②
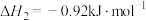
③
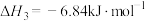
④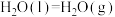
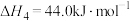
(7)请写出相同条件下液氢和液氧生成气态水的热化学方程式:___________ 。
(8)根据上述信息,以下说法正确的是___________。
 和
和 。
。(1)
 和
和 点燃生成的三种产物均无毒无害,化学方程式为:
点燃生成的三种产物均无毒无害,化学方程式为:(2)含有
 的燃料废水会造成污染,可采用氯化法处理;以下不适宜用作氯化试剂的是___________。
的燃料废水会造成污染,可采用氯化法处理;以下不适宜用作氯化试剂的是___________。A. | B. | C. | D. |
Ⅱ.在
 恒容绝热容器中充入
恒容绝热容器中充入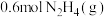 ,一定温度下发生反应:
,一定温度下发生反应:
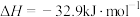 ,
, 的转化率随时间变化情况如图所示:
的转化率随时间变化情况如图所示:
(3)
 内,
内, 的反应速率为
的反应速率为(4)下列能够表明上述反应已达到平衡状态的有___________。
A.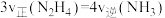 | B.气体密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 | D.平衡常数不再改变 |
(5)写出一种提高
 平衡转化率的方法:
平衡转化率的方法:Ⅲ肼不仅可以给火箭当粮食,还可以摇身一变成为氢气“储蓄罐”。是一种高选择性的肼分解制氢催化剂,催化反应机理如图所示,反应如下:

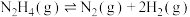
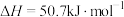
(6)根据上述信息,推测
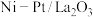 ___________。
___________。| A.能够有效降低制氢反应的反应热 | B.同时提高制氢正反应和逆反应的速率 |
| C.改变制氢反应的反应历程 | D.不参与化学反应,使用一段时间后无需补加 |
Ⅳ.肼类燃烧剂会造成污染,这种粮食正逐渐被淘汰。长征五号B是我国近地轨道运载能力最大的新一代运载火箭,其粮食采用全新配方——低温液氢液氧推进剂,让火箭飞得更稳健。已知一定条件下:
①

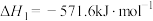
②

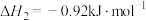
③

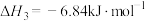
④
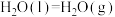
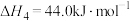
(7)请写出相同条件下液氢和液氧生成气态水的热化学方程式:
(8)根据上述信息,以下说法正确的是___________。
| A.变化④为熵增过程 |
| B.液氢液氧不点燃观察不到水生成,故该反应无法自发进行 |
C. 液态氢气的能量高于 液态氢气的能量高于 气态氢气的能量 气态氢气的能量 |
| D.液氢和液氧作为火箭推进剂符合绿色化学理念 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】为了探究反应条件对反应CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH的影响,某活动小组设计了三个实验,实验曲线如图所示:

(1)请依据实验曲线图补充完整表格中的实验条件:X=___________ ,Y=___________ 。
(2)实验Ⅲ从开始至平衡,平衡常数K=___________ 。
(3)对比实验Ⅱ和实验Ⅲ可知,升高温度,CO的转化率___________ (填“增大”“减小”或“不变”),ΔH___________ (填“>”或“<”)0
(4)在530℃时,平衡常数K=1,若往1L容器中投入0.4molCO(g)、0.1molH2O(g)、0.2molCO2(g)、0.2molH2(g),此时化学反应将___________ (填“向正反应方向”“向逆反应方向”或“不”)移动。

| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| I | 530℃ | 3MPa | 1.0mol·L-1 | 3.0mol·L-1 |
| Ⅱ | X | 5MPa | Y | 3.0mol·L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol·L-1 | 3.0mol·L-1 |
(1)请依据实验曲线图补充完整表格中的实验条件:X=
(2)实验Ⅲ从开始至平衡,平衡常数K=
(3)对比实验Ⅱ和实验Ⅲ可知,升高温度,CO的转化率
(4)在530℃时,平衡常数K=1,若往1L容器中投入0.4molCO(g)、0.1molH2O(g)、0.2molCO2(g)、0.2molH2(g),此时化学反应将
您最近一年使用:0次



