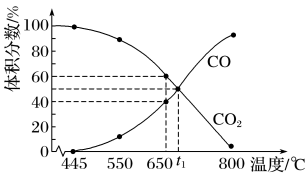
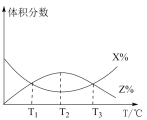
一定量的 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应: 。平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压
。平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压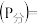 气体总压
气体总压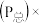 体积分数。下列说法不正确的是
体积分数。下列说法不正确的是
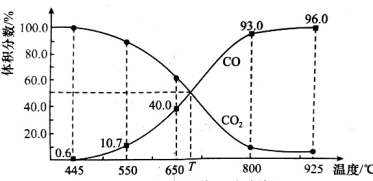
 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应: 。平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压
。平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压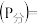 气体总压
气体总压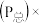 体积分数。下列说法不正确的是
体积分数。下列说法不正确的是
A.该反应 , , |
B.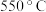 时,若充入惰性气体, 时,若充入惰性气体, , , 均减小,平衡向正反应方向移动 均减小,平衡向正反应方向移动 |
C. 时,若充入等体积的 时,若充入等体积的 和 和 ,平衡向逆反应方向移动 ,平衡向逆反应方向移动 |
D.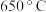 时,反应达平衡后 时,反应达平衡后 的转化率为 的转化率为 |
更新时间:2021/09/10 17:49:14
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列有关化学反应速率的说法正确的是
| A.用锌粒和稀硫酸反应制取氢气时,增大硫酸的浓度一定能加快产生氢气的速率 |
B.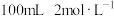 的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
C.汽车尾气中的 和 和 可以缓慢反应生成 可以缓慢反应生成 和 和 ,减小压强,反应速率减慢 ,减小压强,反应速率减慢 |
| D.合成氨的反应是一个放热反应,所以升高反应温度,反应速率减慢 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】常温下足量锌粒与稀硫酸发生反应: ,下列操作或加入的试剂能够加快反应速率但不影响生成
,下列操作或加入的试剂能够加快反应速率但不影响生成 的总量的是
的总量的是
 ,下列操作或加入的试剂能够加快反应速率但不影响生成
,下列操作或加入的试剂能够加快反应速率但不影响生成 的总量的是
的总量的是| A.升高温度 | B.增大压强 | C.加入盐酸 | D.加入 溶液 溶液 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g)⇌2HI(g),下列说法正确的是
| A.保持容器容积不变,向其中加入1 mol H2,化学反应速率不变 |
| B.保持容器容积不变,向其中加入1 mol Ar,化学反应速率增大 |
| C.保持容器内气体压强不变,向其中加入1 mol Ar,化学反应速率不变 |
| D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),化学反应速率不变 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
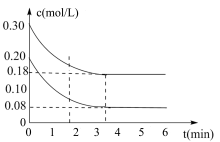
【推荐1】在2L密闭容器中加入一定量C(s)和H2O(g),进行反应C(s)+H2O(g) CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是( )
CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是( )
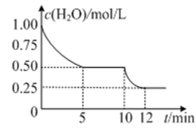
 CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是( )
CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是( )
| A.5min时该反应的K值一定大于12 min时的K值 |
| B.0~5min内,v (H2)=0.05mol/(L•min) |
| C.10 min时,改变的外界条件可能是减小压强 |
| D.该反应混合气体的平均相对分子质量:5min时大于12 min 时的 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】工业制硫酸的接触室中发生反应: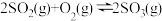 。该反应在500℃和催化剂存在下进行,下列有关说法正确的是
。该反应在500℃和催化剂存在下进行,下列有关说法正确的是
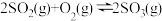 。该反应在500℃和催化剂存在下进行,下列有关说法正确的是
。该反应在500℃和催化剂存在下进行,下列有关说法正确的是| A.如果使氧气过量,并给足够时间让反应充分进行,SO2可以全部转化为SO3 |
| B.该反应的平衡常数(K)随体系压强的增加而增大 |
| C.该反应选择在500℃和催化剂存在下进行,因此该反应是吸热反应 |
| D.反应达到化学平衡后,只改变温度,化学平衡一定会被破坏 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】根据如图有关图像,说法正确的是
 | 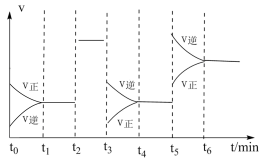 |  |
| 2X(g)+Y(g)⇌2Z(g)∆H | 2N2(g)+3H2(g)⇌2NH3(g)∆H<0 | CO(g)+H2O(g) CO2(g)+H2(g)∆H=-43kJ/mol CO2(g)+H2(g)∆H=-43kJ/mol |
| I | II | III |
| A.由图I知,反应在T1、T3处达到平衡,且该反应的ΔH<0 |
| B.由图II知,t1-t6时间段内反应在t6时刻,NH3体积分数最小 |
| C.由图II知,t3时采取降低反应体系温度的措施 |
| D.图III表示在10L容器、850℃时的反应,由图知,到4min时,反应放出5.16kJ的热量 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列事实能用勒夏特列原理解释的是
| A.铁触媒有利于N2和H2反应合成氨 |
| B.H2(g)+I2(g)⇌2HI(g)的平衡体系,加压后颜色变深 |
| C.N2(g)+3H2(g)⇌2NH3(g) ΔH<0高温有利于合成氨 |
| D.Fe3++3SCN-⇌Fe(SCN)3的平衡体系,加入少量KSCN固体后溶液颜色加深 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】某温度下,将2mol A和3mol B充入一密闭容器中,发生反应:aA(g)+ B(g) C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是
C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是
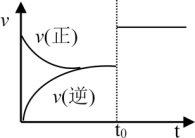
 C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是
C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是
| A.a=2 |
| B.达到平衡时A的转化率为60% |
| C.速率随时间变化关系如图所示 |
| D.为提高A的转化率,可采取升高温度的措施 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】氨和二氧化碳合成尿素的合成反应分两步进行:
第一步:2NH3(l)+CO2(g)⇌NH2COONH4 (l) △H1=﹣100.5 kJ·mol-1
第二步:NH2COONH4 (l)⇌CO(NH2)2(s)+H2O(l) △H2=﹢27.6 kJ·mol-1
下列说法中不正确 的是
第一步:2NH3(l)+CO2(g)⇌NH2COONH4 (l) △H1=﹣100.5 kJ·mol-1
第二步:NH2COONH4 (l)⇌CO(NH2)2(s)+H2O(l) △H2=﹢27.6 kJ·mol-1
下列说法中
| A.第一步反应随着温度的升高,平衡常数增大 |
| B.1 mol H2O和1 mol NH3中含有的质子数相等 |
| C.通入过量的CO2可提高NH3的转化率 |
| D.合成尿素的总的热化学方程式为:2NH3(l)+CO2(g)⇌CO(NH2)2(s)+H2O(l) △H=﹣72.9 kJ·mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】一种制备蓝氢的原理是 。向一体积为1L的恒容密闭容器中充入1mol
。向一体积为1L的恒容密闭容器中充入1mol 和2mol
和2mol ,在一定条件下发生上述反应,测得
,在一定条件下发生上述反应,测得 的物质的量与时间的关系如表所示。下列叙述错误的是
的物质的量与时间的关系如表所示。下列叙述错误的是
 。向一体积为1L的恒容密闭容器中充入1mol
。向一体积为1L的恒容密闭容器中充入1mol 和2mol
和2mol ,在一定条件下发生上述反应,测得
,在一定条件下发生上述反应,测得 的物质的量与时间的关系如表所示。下列叙述错误的是
的物质的量与时间的关系如表所示。下列叙述错误的是| t/min | 0 | 5 | 10 | 15 | 20 | 25 |
 /mol /mol | 0 | 0.5 | 0.75 | 0.85 | 0.9 | 0.9 |
A.0~10min, |
| B.CO的体积分数不变时,反应达到平衡状态 |
C.上述反应中, 的转化率大于 的转化率大于 的转化率 的转化率 |
D.其他条件不变。若加入高效催化剂,则 的转化率达到45%时所用时间小于20min 的转化率达到45%时所用时间小于20min |
您最近一年使用:0次

 转化为
转化为
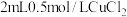 溶液的试管,溶液由蓝绿色变为黄绿色
溶液的试管,溶液由蓝绿色变为黄绿色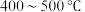 进行而非室温条件
进行而非室温条件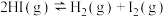 达到平衡后,缩小容器体积可使体系颜色变深
达到平衡后,缩小容器体积可使体系颜色变深 2CO(g)
2CO(g)