一定量的 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应: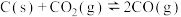 。平衡时,体系中气体体积分数与温度的关系如图所示:
。平衡时,体系中气体体积分数与温度的关系如图所示:
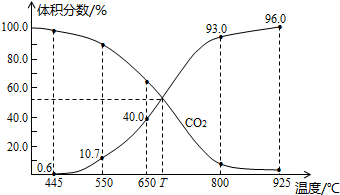
已知:气体分压(p分)=气体总压(p总)×体积分数
下列说法正确的是
 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应: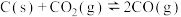 。平衡时,体系中气体体积分数与温度的关系如图所示:
。平衡时,体系中气体体积分数与温度的关系如图所示:
已知:气体分压(p分)=气体总压(p总)×体积分数
下列说法正确的是
A. 时,若充入惰性气体,V正,V逆均减小,平衡不移动 时,若充入惰性气体,V正,V逆均减小,平衡不移动 |
B. 时,反应达平衡后 时,反应达平衡后 的转化率为 的转化率为 |
C. 时,若充入等体积的 时,若充入等体积的 和 和 ,平衡向逆反应方向移动 ,平衡向逆反应方向移动 |
D.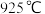 时,化学平衡常数 时,化学平衡常数 |
更新时间:2021-09-29 14:20:55
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】一种捕获并资源化利用CO2的方法是将CO2催化加氢合成CH3OCH3,其过程中主要发生如下反应:
I:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g) ΔH1=-122.5kJ•mol-1
II:CO2(g)+H2(g)═CO(g)+H2O(g) ΔH2=+41.2kJ•mol-1
向恒压密闭容器中充入1molCO2和3molH2,CO2的平衡转化率和平衡时CH3OCH3的选择性[CH3OCH3的选择性= ×100%]随温度的变化如图所示。下列说法正确的是
×100%]随温度的变化如图所示。下列说法正确的是

I:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g) ΔH1=-122.5kJ•mol-1
II:CO2(g)+H2(g)═CO(g)+H2O(g) ΔH2=+41.2kJ•mol-1
向恒压密闭容器中充入1molCO2和3molH2,CO2的平衡转化率和平衡时CH3OCH3的选择性[CH3OCH3的选择性=
 ×100%]随温度的变化如图所示。下列说法正确的是
×100%]随温度的变化如图所示。下列说法正确的是
| A.由图可知,210℃时以反应II为主,300℃时,以反应I为主 |
| B.其他条件不变,增加氢气的投入量,一定能提高CH3OCH3的产率 |
C.反应状态达A点时,容器中n(CH3OCH3)为 mol mol |
| D.要提高CH3OCH3选择性,可增大反应体系压强或使用对反应I催化活性更高的催化剂 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】H2S与CO2在高温下发生反应:CO2 (g) + H2S (g)  COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
 COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是| A.升高温度,H2S浓度增加,表明该反应是放热反应 |
| B.通入CO2后,正反应速率先增大后减小 |
| C.H2S的平衡转化率α = 4.5 % |
| D.反应平衡常数K = 2.8×10-3 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】已知某化学反应的平衡常数表达式为K=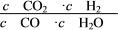 ,在不同的温度下该反应的平衡常数如下表:
,在不同的温度下该反应的平衡常数如下表:
下列有关叙述不 正确的是
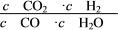 ,在不同的温度下该反应的平衡常数如下表:
,在不同的温度下该反应的平衡常数如下表:t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A.若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态 |
| B.上述反应的正反应是放热反应 |
C.该反应的化学方程式是CO(g)+H2O(g)  CO2(g)+H2 (g) CO2(g)+H2 (g) |
D.若平衡浓度符合下列关系式: = = ,则此时的温度为1000 ℃ ,则此时的温度为1000 ℃ |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g) CH3OH(g)。在2L的恒容密闭容器中,按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g)。在2L的恒容密闭容器中,按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
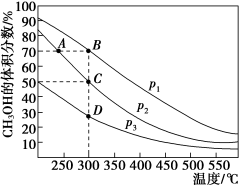
 CH3OH(g)。在2L的恒容密闭容器中,按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g)。在2L的恒容密闭容器中,按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
| A.该反应的△H<0,且P1<P2 |
| B.反应速率:v逆(状态A)>v逆(状态B) |
| C.在C点时,CO转化率为75% |
| D.B点时,测得混合气体总浓度为0.625mol/L,保持温度不变,向该恒容容器中再充入CO、H2和CH3OH各0.1mol,平衡逆向移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】乙二醇在生产、生活中有着广泛的用途,某工艺制取乙二醇所涉及的反应如下:
反应Ⅰ

反应Ⅱ

在压强一定的条件下,将 、
、 按1:3进料比通入装有催化剂的反应器中,测得
按1:3进料比通入装有催化剂的反应器中,测得 的转化率与
的转化率与 、
、 的选择性[
的选择性[ ]。
]。
反应Ⅰ


反应Ⅱ


在压强一定的条件下,将
 、
、 按1:3进料比通入装有催化剂的反应器中,测得
按1:3进料比通入装有催化剂的反应器中,测得 的转化率与
的转化率与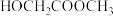 、
、 的选择性[
的选择性[ ]。
]。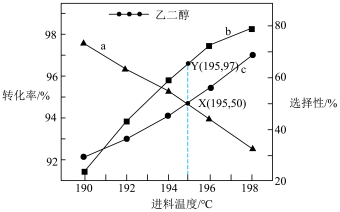
A.曲线a表示 转化率 转化率 |
| B.195℃时,反应Ⅰ的平衡常数约为2904 |
C.190~198℃范围内,温度升高,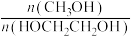 的值减小 的值减小 |
D.其它条件相同时,增大压强和升高温度均可以提高平衡时 的产量 的产量 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】将1 mol N2和 3 mol H2充入体积可变的恒温密闭容器中,在380 ℃下发生反应:N2(g)+3H2(g) 2NH3(g),平衡时,体系中氨的体积分数
2NH3(g),平衡时,体系中氨的体积分数 (NH3)随压强变化的情况如下表:
(NH3)随压强变化的情况如下表:
下列说法正确的是( )
 2NH3(g),平衡时,体系中氨的体积分数
2NH3(g),平衡时,体系中氨的体积分数 (NH3)随压强变化的情况如下表:
(NH3)随压强变化的情况如下表:| 压强/MPa | 10 | 20 | 30 | 40 |
 (NH3) (NH3) | 0.30 | 0.45 | 0.54 | 0.60 |
| A.10 MPa时,H2的转化率为75% |
| B.20 MPa时,NH3的物质的量浓度是10 MPa时的1.5倍 |
C.40 MPa时,若容器的体积为V L,则平衡常数K=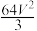 |
| D.30 MPa时,若向容器中充入惰性气体,则平衡向正反应方向移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】在1 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
下列说法错误的是
 M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
| A.实验①中,若5 min时测得n(M) =0.05 mol,则0至5 min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min) |
| B.实验②中,该反应的平衡常数K=1.0 |
| C.实验③中,达到平衡时,X的转化率为60% |
| D.实验④中,达到平衡时,b>0.06 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列图示与对应的叙述相符的是
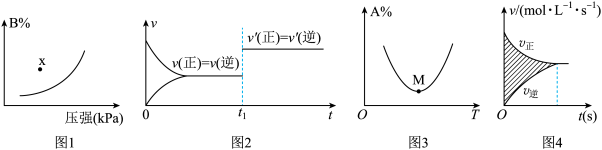

A.图1表示反应: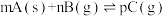  在一定温度下B的百分含量与压强变化的关系如图所示,则x点正反应速率小于逆反应速率 在一定温度下B的百分含量与压强变化的关系如图所示,则x点正反应速率小于逆反应速率 |
B.图2是可逆反应:  的速率时间图像,在 的速率时间图像,在 时刻改变条件只能是加入催化剂 时刻改变条件只能是加入催化剂 |
C.图3表示对于化学反应 ,A的百分含量与温度(T)的变化情况,则该反应的 ,A的百分含量与温度(T)的变化情况,则该反应的 |
| D.图4所示图中的阴影部分面积的含义是该物质物质的量的变化量 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】关于下列各图的叙述,正确的是
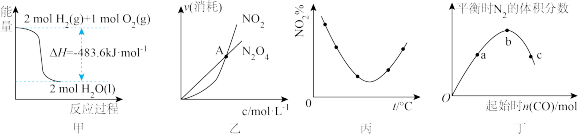
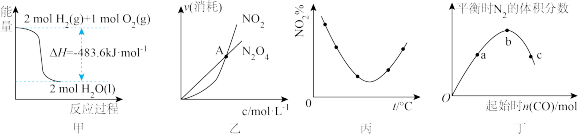
| A.甲表示H2与O2发生反应过程中的能量变化,则H2的摩尔燃烧焓为483.6 kJ·mol-1 |
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C.丙表示等量NO2在恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g)相同时间后测得NO2体积分数的曲线。则该反应的正反应ΔH<0 N2O4(g)相同时间后测得NO2体积分数的曲线。则该反应的正反应ΔH<0 |
D.丁表示反应4CO(g)+2NO2(g) N2(g)+4CO2(g) △H<0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c N2(g)+4CO2(g) △H<0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c |
您最近一年使用:0次

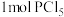 ,发生反应
,发生反应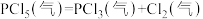 ,达平衡后,保持温度不变,作如下几种改变;①体积增大一倍;②增大体积至总压强减为原来的一半;③恒容下增加
,达平衡后,保持温度不变,作如下几种改变;①体积增大一倍;②增大体积至总压强减为原来的一半;③恒容下增加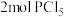 :④恒压增加
:④恒压增加 转化率都增大,且增大倍数一样
转化率都增大,且增大倍数一样 恒容密闭容器中充入
恒容密闭容器中充入 :
: ,反应经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
,反应经过一段时间后达到平衡。反应过程中测定的部分数据见下表: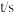



 后向该容器中再充入
后向该容器中再充入 、
、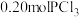 和
和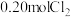 ,反应达到平衡前v(正)<v(逆)
,反应达到平衡前v(正)<v(逆) 和
和 ,达到平衡时,
,达到平衡时, 的转化率小于80%
的转化率小于80% 的恒容密闭容器中发生反应
的恒容密闭容器中发生反应 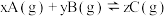 ,图Ⅰ表示
,图Ⅰ表示  时容器中
时容器中  、
、 、
、 物质的量随时间的变化,图Ⅱ表示不同温度下平衡时
物质的量随时间的变化,图Ⅱ表示不同温度下平衡时 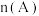 :
: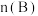 的变化关系.则下列结论正确的是
的变化关系.则下列结论正确的是
 和
和 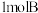 ,达到平衡时
,达到平衡时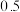
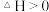 ,且
,且 
 ,重新达到平衡前
,重新达到平衡前 


