下列有关电解质溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小 减小 |
| B.一定温度下,氢氧化钙达到溶解平衡,向此溶液中加入少量氧化钙粉末,则溶液中c(Ca2+)增大 |
C.向盐酸中加入氨水至恰好完全反应,溶液中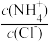 <1 <1 |
D.向AgCl、AgBr饱和的混合溶液中加入少量AgNO3,溶液中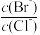 减小 减小 |
21-22高二上·吉林松原·阶段练习 查看更多[5]
吉林省长岭县第三中学2021-2022学年高二上学期第一次考试化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.4.1 难溶电解质的沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)重庆市南开中学校2021-2022学年高二上学期期末考试化学试题
更新时间:2021-10-01 10:36:14
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,下列说法正确的是


| A.a、b、c三点对应溶液中,c(H+)最大的是a点 |
| B.a、b、c三点对应溶液中,CH3COOH电离程度最大的是b点 |
C.若使b点对应的溶液中c(CH3COO-)增大、c(H+)减小,可向溶液中加入 固体 固体 |
| D.加水稀释过程中醋酸的电离常数逐渐增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列有关电解质溶液的说法正确的是
| A.用CH3COOH溶液做导电实验,灯泡很暗,证明CH3COOH是弱电解质 |
| B.pH相同的醋酸和盐酸,取等体积的两种酸溶液分别稀释至原溶液体积的m倍和n倍,稀释后两溶液的pH仍然相同,则m<n |
| C.常温下,CH3COOH的Ka=1.7×10-5,NH3•H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3•H2O的溶液中的c(OH-)相等 |
D.常温下,在0.10mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体, 的值增大且能使溶液的pH减小 的值增大且能使溶液的pH减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】已知25℃时有关弱酸的电离平衡常数如表:
下列说法不正确的是
| 弱酸 |  |  |  |  |
| 电离平衡常数 |  |  | 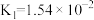 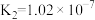 |  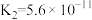 |
A. 溶液中通少量 溶液中通少量 : :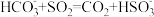 |
B.等体积等浓度的 和 和 溶液中的离子总数大小:前者<后者 溶液中的离子总数大小:前者<后者 |
C.25℃时,等物质的量浓度的各溶液 关系为: 关系为: |
D. 溶液与 溶液与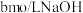 溶液等体积混合后,所得溶液中 溶液等体积混合后,所得溶液中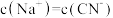 ,则a一定大于b ,则a一定大于b |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法中正确的是
| A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 |
| B.常温下,c(NH4+)相等的①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| C.0.1 mol/L NH4HSO4溶液与0.1mol/L NaOH溶液等体积混合后,溶液中离子浓度关系为:c(Na+)=c(SO42-)>c(H+)>c(NH4+)>c(OH-) |
| D.当溶液中存在的离子只有Cl-、OH-、NH4+、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】下列说法正确的是
| A.25℃时,pH均为1的盐酸和醋酸加水稀释1000倍,所得溶液的pH:醋酸>盐酸 |
| B.等体积、等物质的量浓度的NH4HSO4和KOH 溶液混合:c(K+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+) |
| C.25℃时,pH=12 的氨水和pH=2 的盐酸等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.浓度均为0.1 mol•L-1的HClO溶液和NaClO溶液等体积混合,溶液中有下列关系:c(HClO)+2c(H+)=c(C1O-)+2c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】一定温度下将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是( )
①20mL 0.01 mol·L-1KCl溶液 ②30 mL 0.02 mol·L-1CaCl2溶液③40mL 0.03 mol·L-1HCl溶液 ④10 mL蒸馏水 ⑤50 mL 0.05 mol·L-1AgNO3溶液
①20mL 0.01 mol·L-1KCl溶液 ②30 mL 0.02 mol·L-1CaCl2溶液③40mL 0.03 mol·L-1HCl溶液 ④10 mL蒸馏水 ⑤50 mL 0.05 mol·L-1AgNO3溶液
| A.①>②>③>④>⑤ | B.④>①>③>②>⑤ |
| C.⑤>④>②>①>③ | D.④>③>⑤>②>① |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+: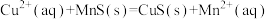 ,一定温度下,下列有关该反应的推理正确的是
,一定温度下,下列有关该反应的推理正确的是
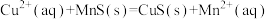 ,一定温度下,下列有关该反应的推理正确的是
,一定温度下,下列有关该反应的推理正确的是| A.该反应达到平衡时c(Cu2+)=c(Mn2+) |
| B.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
C.该反应的平衡常数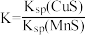 |
| D.平衡体系中加入少量CuS(s)后,c(Mn2+)变小 |
您最近一年使用:0次



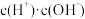 ④
④


