Ⅰ.金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如图所示。
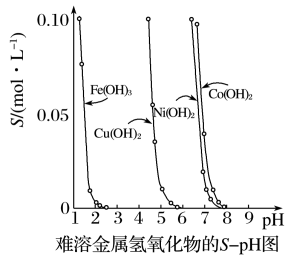
(1)pH=3时溶液中铜元素的主要存在形式是___ (写化学式)。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为___ 。
A.3左右 B.4左右 C.2左右
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___ 。
(4)已知一些难溶物的溶度积常数如表:
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的___ 除去它们。
A.NaOH B.FeS C.Na2S
Ⅱ.某小组同学进行如图实验探究:
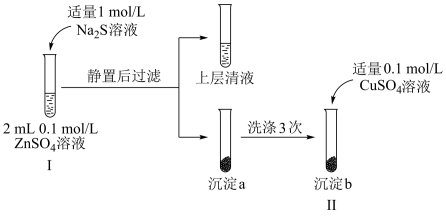
(5)预通过实验Ⅰ和实验Ⅱ证明Ksp(ZnS)<Ksp(CuS),实验Ⅰ中加入1mol•L-1Na2S的体积范围为:___ 。
(6)试管Ⅱ中观察到白色沉淀转化为黑色沉淀。请结合化学用语,从平衡移动的角度进行解释___ 。
(7)若将沉淀a洗涤3次后,加适量0.1mol/LFeSO4溶液,是否能看到白色沉淀转化为黑色沉淀,请结合计算予以说明___ 。

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.3左右 B.4左右 C.2左右
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,
(4)已知一些难溶物的溶度积常数如表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的
A.NaOH B.FeS C.Na2S
Ⅱ.某小组同学进行如图实验探究:

(5)预通过实验Ⅰ和实验Ⅱ证明Ksp(ZnS)<Ksp(CuS),实验Ⅰ中加入1mol•L-1Na2S的体积范围为:
| 难溶电解质 | 颜色 | Ksp的数值(18~25℃) |
| ZnS | 白色 | 1.6×10-24 |
| CuS | 黑色 | 1.3×10-36 |
| FeS | 黑色 | 6.3×10-18 |
(6)试管Ⅱ中观察到白色沉淀转化为黑色沉淀。请结合化学用语,从平衡移动的角度进行解释
(7)若将沉淀a洗涤3次后,加适量0.1mol/LFeSO4溶液,是否能看到白色沉淀转化为黑色沉淀,请结合计算予以说明
更新时间:2021-10-15 10:34:23
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】某研究性学习小组对肾结石在人体中的溶解平衡进行初步探究,进一步认识肾结石产生并利用沉淀的转化进行治疗的原理。经分析肾结石主要成分有:草酸钙(CaC2O4 )90%、碳酸钙(CaCO3)8%、磷酸钙[Ca2(PO4)3]及其它2%。
实验探究一:草酸钙的溶解性
实验①

某同学观察后认为:滴加饱和Na2CO3溶液后无现象说明草酸钙不溶于水,水中不存在钙离子。另一同学认为无明显现象并不能证明不存在钙离子只是很少,并补充下列实验。
实验② 钙试剂的显色反应
实验③

(1)实验②中使用蒸馏水的目的是___________ 。
(2)实验②、③验证了___________ ,草酸钙沉淀溶解平衡的方程式是___________ 。
实验探究二:草酸钙沉淀转化
(3)人体内血清总钙含量范围2.25-2.75 m mol·L-1,当血清总钙含量达上限时,血清中 浓度达到
浓度达到___________ 时,会产生草酸钙沉淀可能会引起结石。
(4)肾结石病人不能过量食用含草酸的食物(如菠菜等),已知草酸溶液中H2C2O4、HC2O 、
、 三种微粒的物质的量分数(δ)随溶液pH的变化关系如图所示,当pH=2.7时,
三种微粒的物质的量分数(δ)随溶液pH的变化关系如图所示,当pH=2.7时,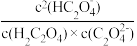 =
=___________ 。

(5)医生建议:肾结石病人口服镁制剂(主要成分为MgCl2溶液),可以减缓草酸钙结石患者的病痛。解释医生建议的合理性___________ 。
实验探究一:草酸钙的溶解性
实验①

某同学观察后认为:滴加饱和Na2CO3溶液后无现象说明草酸钙不溶于水,水中不存在钙离子。另一同学认为无明显现象并不能证明不存在钙离子只是很少,并补充下列实验。
实验② 钙试剂的显色反应
| 钙试剂 | 蒸馏水+钙试剂 | 矿泉水+钙试剂 | |
| 实验现象 | 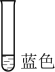 |  |  |

(1)实验②中使用蒸馏水的目的是
(2)实验②、③验证了
实验探究二:草酸钙沉淀转化
| 难溶物 | 25℃时Ksp/(mol2·L-2) |
| CaC2O4 | 2.3×10-9 |
| CaCO3 | 3.0×10-8 |
| MgC2O4 | 8.6×10-5 |
 浓度达到
浓度达到(4)肾结石病人不能过量食用含草酸的食物(如菠菜等),已知草酸溶液中H2C2O4、HC2O
 、
、 三种微粒的物质的量分数(δ)随溶液pH的变化关系如图所示,当pH=2.7时,
三种微粒的物质的量分数(δ)随溶液pH的变化关系如图所示,当pH=2.7时,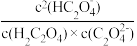 =
=
(5)医生建议:肾结石病人口服镁制剂(主要成分为MgCl2溶液),可以减缓草酸钙结石患者的病痛。解释医生建议的合理性
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知温度越高,AgI在水中的溶解度越大,现向有AgI固体的AgI饱和溶液中分别进行如下操作,有关离子浓度的变化情况是:
(1)若加入少量水,则c(I-)_______ (填“增大”、“减小”或“不变”)
(2)若加入AgNO3固体,则AgI在水中的溶解度_______ (填“增大”、“减小”或“不变”)
(3)若加入NaCl固体,则AgI的溶度积Ksp_______ (填“增大”、“减小”或“不变”)
(4)若某温度下,AgI的溶度积Ksp=9.0×10-20,则AgI在该温度下的溶解度是_______ (AgI饱和溶液的密度可近似为1g·mL-1)。
(1)若加入少量水,则c(I-)
(2)若加入AgNO3固体,则AgI在水中的溶解度
(3)若加入NaCl固体,则AgI的溶度积Ksp
(4)若某温度下,AgI的溶度积Ksp=9.0×10-20,则AgI在该温度下的溶解度是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】烟气中的 会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:
会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:
方法1(双碱法):用NaOH吸收 ,并用CaO使NaOH再生,即NaOH溶液
,并用CaO使NaOH再生,即NaOH溶液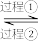
 溶液。
溶液。
(1)过程①的离子方程式为_______ 。
(2)常温下,用NaOH溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡_______ (填“向左”“向右”或“不”)移动。该溶液中由水电离出的
_______  ;
; 溶液显
溶液显_______ (填“酸”、“碱”或“中”)性。(常温下 的电离平衡常数
的电离平衡常数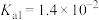 ,
, )
)
(3)CaO在水中存在如下转化: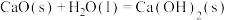 ,
,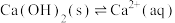
 ,从化学反应原理的角度解释过程②NaOH再生的原理:
,从化学反应原理的角度解释过程②NaOH再生的原理:_______ 。
(4)理论上,该工艺中NaOH只作为启动碱,实际主要消耗的是生石灰。实际吸收过程中,由于存在一定氧气,会发生副反应:_______ (填化学方程式),因副产物_______ (填化学式)在工艺中较难循环再生成NaOH,需要不断向系统中补充NaOH。
方法2:用氨水除去。
(5)已知常温时 的
的 ,若氨水的浓度为
,若氨水的浓度为 ,溶液中
,溶液中
_______  。将
。将 通入该氨水中,当溶液恰好呈中性时,溶液中
通入该氨水中,当溶液恰好呈中性时,溶液中
_______ 。
 会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:
会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:方法1(双碱法):用NaOH吸收
 ,并用CaO使NaOH再生,即NaOH溶液
,并用CaO使NaOH再生,即NaOH溶液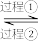
 溶液。
溶液。(1)过程①的离子方程式为
(2)常温下,用NaOH溶液吸收
 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡
 ;
; 溶液显
溶液显 的电离平衡常数
的电离平衡常数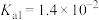 ,
, )
)(3)CaO在水中存在如下转化:
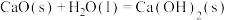 ,
,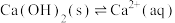
 ,从化学反应原理的角度解释过程②NaOH再生的原理:
,从化学反应原理的角度解释过程②NaOH再生的原理:(4)理论上,该工艺中NaOH只作为启动碱,实际主要消耗的是生石灰。实际吸收过程中,由于存在一定氧气,会发生副反应:
方法2:用氨水除去。
(5)已知常温时
 的
的 ,若氨水的浓度为
,若氨水的浓度为 ,溶液中
,溶液中
 。将
。将 通入该氨水中,当溶液恰好呈中性时,溶液中
通入该氨水中,当溶液恰好呈中性时,溶液中
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】化学在生产生活中有着广泛的应用,请回答下列问题:
(1)家里常用的物品有①厕所清洁剂 ②厨房清洁剂 ③食醋 ④肥皂 ⑤苏打水,其中呈碱性的有________ (填序号)。
(2)浓度均为0.1mol/L的5种溶液:①氨水 ② ③
③ ④
④ ⑤
⑤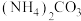 ,其中
,其中 由大到小的顺序为
由大到小的顺序为_________ (用序号表示)。
(3)水垢中含有 ,难用酸除去,可先用
,难用酸除去,可先用 溶液浸泡处理后转化为疏松、易溶于酸的
溶液浸泡处理后转化为疏松、易溶于酸的 ,再用酸处理。用
,再用酸处理。用 溶液浸泡处理的反应为
溶液浸泡处理的反应为__________ (用离子方程式表示)。
(4)牙齿表面有一层坚硬的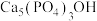 (羟基磷灰石)物质保护着。它在唾液中存在下列平衡:
(羟基磷灰石)物质保护着。它在唾液中存在下列平衡: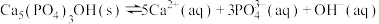 。当人进食后,口腔中的细菌在分解食物的过程中会产生有机酸,这时牙齿就会受到腐蚀,其原因是
。当人进食后,口腔中的细菌在分解食物的过程中会产生有机酸,这时牙齿就会受到腐蚀,其原因是_________________ 。
(1)家里常用的物品有①厕所清洁剂 ②厨房清洁剂 ③食醋 ④肥皂 ⑤苏打水,其中呈碱性的有
(2)浓度均为0.1mol/L的5种溶液:①氨水 ②
 ③
③ ④
④ ⑤
⑤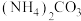 ,其中
,其中 由大到小的顺序为
由大到小的顺序为(3)水垢中含有
 ,难用酸除去,可先用
,难用酸除去,可先用 溶液浸泡处理后转化为疏松、易溶于酸的
溶液浸泡处理后转化为疏松、易溶于酸的 ,再用酸处理。用
,再用酸处理。用 溶液浸泡处理的反应为
溶液浸泡处理的反应为(4)牙齿表面有一层坚硬的
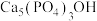 (羟基磷灰石)物质保护着。它在唾液中存在下列平衡:
(羟基磷灰石)物质保护着。它在唾液中存在下列平衡: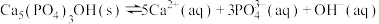 。当人进食后,口腔中的细菌在分解食物的过程中会产生有机酸,这时牙齿就会受到腐蚀,其原因是
。当人进食后,口腔中的细菌在分解食物的过程中会产生有机酸,这时牙齿就会受到腐蚀,其原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶性金属氢氧化物在不同pH下的溶解度[S(mol·L-1)]如图所示。

(1)pH=6时溶液中铜元素的主要存在形式是________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,下列最适宜的pH 范围是_____ (选填序号)。
A.<2 B. 3.5〜4.2 C. >6.3
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,_______ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是______ .
(4)可用加入氨水的方法使Cu(OH)2沉淀溶解,生成的产物之一为[Cu(NH3)4]2+。该反应的离子方程式为______ .
已知一些难溶物的溶度积常数如下表:
(5)某工业废水中含有Cu2+、Pb2+、Hg2+,为除去这些离子,最适宜向此工业废水中加入过量的______ (选填序号)。
A.NaOH B.FeS C.Na2S

(1)pH=6时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,下列最适宜的pH 范围是
A.<2 B. 3.5〜4.2 C. >6.3
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,
(4)可用加入氨水的方法使Cu(OH)2沉淀溶解,生成的产物之一为[Cu(NH3)4]2+。该反应的离子方程式为
已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
(5)某工业废水中含有Cu2+、Pb2+、Hg2+,为除去这些离子,最适宜向此工业废水中加入过量的
A.NaOH B.FeS C.Na2S
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】医学上在进行胃肠疾病的检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视。
(1)用离子方程式说明钡餐透视时为什么不用BaCO3?____________________________________________ 。
(2)某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:① 5 mL水② 20 mL 0.5 mol·L-1的Na2SO4溶液③ 40 mL 0.2mol·L-1的Ba(OH)2溶液④ 40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和以上各溶液中,c(Ba2+)的大小顺序正确的是________ ,BaSO4的溶解度的大小顺序为______________
A.③ >① >④ >② B.③ >① >② >④ C.① >④ >③ >② D.① >③ >④ >②
(3)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO42-)为______________ ,溶液②中c(Ba2+)为 __________________ 。
(4)取溶液③和溶液④直接混合,则混合溶液的pH为__________ (假设混合后溶液的体积为混合前两溶液的体积之和)。
(1)用离子方程式说明钡餐透视时为什么不用BaCO3?
(2)某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:① 5 mL水② 20 mL 0.5 mol·L-1的Na2SO4溶液③ 40 mL 0.2mol·L-1的Ba(OH)2溶液④ 40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和以上各溶液中,c(Ba2+)的大小顺序正确的是
A.③ >① >④ >② B.③ >① >② >④ C.① >④ >③ >② D.① >③ >④ >②
(3)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO42-)为
(4)取溶液③和溶液④直接混合,则混合溶液的pH为
您最近一年使用:0次
【推荐1】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:
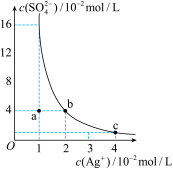
(1)a点表示Ag2SO4________ (填“饱和”或“不饱和”)溶液。
(2)b点对应的Ksp________ (填“<”“>”或“=”)c点对应的Ksp。
(3)现将足量的Ag2SO4分别放入:
a.40 mL 0.01 mol·L-1 K2SO4溶液
b.10 mL蒸馏水
c.10 mL 0.02 mol·L-1 H2SO4溶液
则Ag2SO4的溶解度由大到小的排列顺序为________ (填字母)。
(4)下列有关Ag2SO4的说法中正确的是________ 。
A.含有大量SO 的溶液中肯定不存在Ag+
的溶液中肯定不存在Ag+
B.Ag2SO4的溶度积常数Ksp=1.6×10-5 (mol·L-1)3
C.0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
(5)往Ag2SO4固体中加入足量的Na2CrO4溶液,可观察到砖红色沉淀(Ag2CrO4为砖红色),写出沉淀转化的离子方程式:________ 。

(1)a点表示Ag2SO4
(2)b点对应的Ksp
(3)现将足量的Ag2SO4分别放入:
a.40 mL 0.01 mol·L-1 K2SO4溶液
b.10 mL蒸馏水
c.10 mL 0.02 mol·L-1 H2SO4溶液
则Ag2SO4的溶解度由大到小的排列顺序为
(4)下列有关Ag2SO4的说法中正确的是
A.含有大量SO
 的溶液中肯定不存在Ag+
的溶液中肯定不存在Ag+B.Ag2SO4的溶度积常数Ksp=1.6×10-5 (mol·L-1)3
C.0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
(5)往Ag2SO4固体中加入足量的Na2CrO4溶液,可观察到砖红色沉淀(Ag2CrO4为砖红色),写出沉淀转化的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知在25 ℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)= 8.7×10-17。
(1)根据以上信息,判断AgX、AgY、AgZ的溶解度S(AgX)、S(AgY)、S(AgZ)的大小顺序为_________ 。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)_____ (填“增大”、“减小”或“不变”)。
(3)在25 ℃时,若取0.188 g的AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的浓度为______ 。
(4)由上述Ksp判断,在上述(3)的体系中,____ (填“能”或“不能”)实现AgY向AgZ的转化,理由为______ 。
(1)根据以上信息,判断AgX、AgY、AgZ的溶解度S(AgX)、S(AgY)、S(AgZ)的大小顺序为
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)
(3)在25 ℃时,若取0.188 g的AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的浓度为
(4)由上述Ksp判断,在上述(3)的体系中,
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】电解质在水溶液中可能存在电离平衡、水解平衡、溶解平衡等。
(1)已知部分弱酸的电离常数如下表:
①室温下,一定浓度的HCOONa溶液 ,用离子方程式表示溶液呈碱性的原因
,用离子方程式表示溶液呈碱性的原因___________ 。
②0.1 mol·L-1 NaCN溶液和0.1 mol·L-1 溶液中,
溶液中,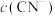
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
③将 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是___________ 。
(2)常温时,向20 mL 0.1 mol/L 水溶液中逐滴滴加0.1 mol/L NaOH溶液,混合溶液中
水溶液中逐滴滴加0.1 mol/L NaOH溶液,混合溶液中 、
、 和
和 的物质的量分数(δ)随pH变化的关系如图所示。
的物质的量分数(δ)随pH变化的关系如图所示。

则曲线Ⅱ表示___________ 微粒,弱酸 的
的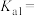
___________
(3)已知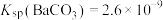 ,
,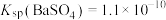 。
。
①将浓度为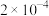 mol⋅L-1
mol⋅L-1  溶液与
溶液与 溶液
溶液等体积混合 ,则生成 沉淀所需
沉淀所需 溶液的最小浓度为
溶液的最小浓度为___________ mol⋅L-1。
②向含有 固体的溶液中滴加
固体的溶液中滴加 溶液,当有
溶液,当有 沉淀生成时,溶液中,写出沉淀转化的离子方程式
沉淀生成时,溶液中,写出沉淀转化的离子方程式___________ ,求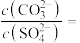
___________ (保留三位有效数字)。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | HCOOH | HCN |  |
| 电离常数(25℃) | 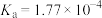 | 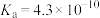 | 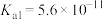 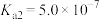 |
 ,用离子方程式表示溶液呈碱性的原因
,用离子方程式表示溶液呈碱性的原因②0.1 mol·L-1 NaCN溶液和0.1 mol·L-1
 溶液中,
溶液中,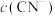
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。③将
 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是(2)常温时,向20 mL 0.1 mol/L
 水溶液中逐滴滴加0.1 mol/L NaOH溶液,混合溶液中
水溶液中逐滴滴加0.1 mol/L NaOH溶液,混合溶液中 、
、 和
和 的物质的量分数(δ)随pH变化的关系如图所示。
的物质的量分数(δ)随pH变化的关系如图所示。
则曲线Ⅱ表示
 的
的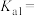
(3)已知
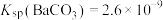 ,
,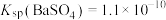 。
。①将浓度为
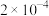 mol⋅L-1
mol⋅L-1  溶液与
溶液与 溶液
溶液 沉淀所需
沉淀所需 溶液的最小浓度为
溶液的最小浓度为②向含有
 固体的溶液中滴加
固体的溶液中滴加 溶液,当有
溶液,当有 沉淀生成时,溶液中,写出沉淀转化的离子方程式
沉淀生成时,溶液中,写出沉淀转化的离子方程式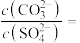
您最近一年使用:0次
【推荐1】铬及其化合物在工业上用途广泛,回答下列问题:
(1)铁铬液流电池是一种酸性介质中,正、负极活性物质均为液体的化学电池,放电时电池的总反应为: ,电池结构原理如图所示,a和b代表电极。电池放电时a级的电势
,电池结构原理如图所示,a和b代表电极。电池放电时a级的电势_______ b级电势(填“高于”“低于”或“等于”),电池充电时阴极的电极反应为_______ .

(2)含 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含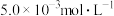 的
的 .为了使废水的排放达标;进行如下处理:
.为了使废水的排放达标;进行如下处理:
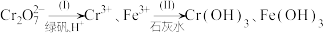
若处理后的废水中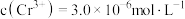 ,则废水中
,则废水中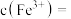
_______  .
.
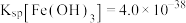 ;
;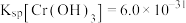 )
)
(3)以铬酸钠( )为原料,用电化学法可制备重铬酸钠(
)为原料,用电化学法可制备重铬酸钠( ),实验装置如图所示
),实验装置如图所示

①阳极的电极反应式为_______
②电解一段时间后,测得阳极区溶液中 物质的量由
物质的量由 变为
变为 ,则生成重铬酸钠的物质的量为
,则生成重铬酸钠的物质的量为_______  。
。
(1)铁铬液流电池是一种酸性介质中,正、负极活性物质均为液体的化学电池,放电时电池的总反应为:
 ,电池结构原理如图所示,a和b代表电极。电池放电时a级的电势
,电池结构原理如图所示,a和b代表电极。电池放电时a级的电势
(2)含
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含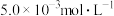 的
的 .为了使废水的排放达标;进行如下处理:
.为了使废水的排放达标;进行如下处理: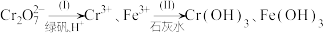
若处理后的废水中
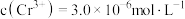 ,则废水中
,则废水中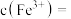
 .
.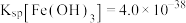 ;
;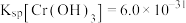 )
)(3)以铬酸钠(
 )为原料,用电化学法可制备重铬酸钠(
)为原料,用电化学法可制备重铬酸钠( ),实验装置如图所示
),实验装置如图所示
①阳极的电极反应式为
②电解一段时间后,测得阳极区溶液中
 物质的量由
物质的量由 变为
变为 ,则生成重铬酸钠的物质的量为
,则生成重铬酸钠的物质的量为 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是________ 。
(2)已知Ksp(AgCl)=1.8×10-10,向VmL0.018mol/L 的AgNO3溶液加VmL0.020mol/L 的盐酸,混合后溶液中的Ag+的浓度为______ mol/L,pH 为________ 。
(3)AgNO3溶液光照易分解,生成Ag 和红棕色气体等物质,其光照分解的化学方程式为________ 。
(4)如图所示原电池正极的反应式为_________ 。
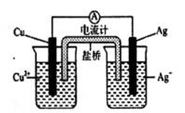
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是
(2)已知Ksp(AgCl)=1.8×10-10,向VmL0.018mol/L 的AgNO3溶液加VmL0.020mol/L 的盐酸,混合后溶液中的Ag+的浓度为
(3)AgNO3溶液光照易分解,生成Ag 和红棕色气体等物质,其光照分解的化学方程式为
(4)如图所示原电池正极的反应式为

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】以工业制立德粉后的铅锌废渣(主要成分为ZnO和PbSO4,杂质含Si、Fe、Cu、Cd等元素)为原料,可以制活性氧化锌和黄色颜料铅铬黄,工艺流程如图所示:
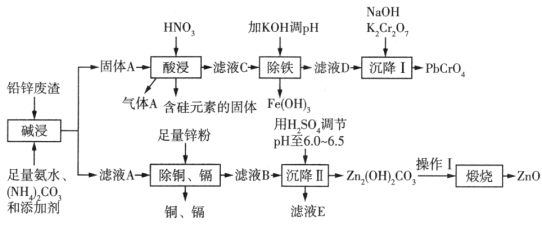
已知:①PbSO4难溶于 ;
;
②常温下,Ksp(PbCO3)=8×10-14,Ksp(PbSO4)=1.6×10-8,Ksp(PbCrO4)=2.8×10-13, Ksp[Pb(OH)2]=1.0×10-16,Ksp[Fe(OH)3]=1.0×10-38。
常温下,若测得“酸浸”后所得溶液中c(Pb2+)=0.1mol/L,则“除铁”过程中需要控制溶液pH的范围为_______ [c(Fe3+)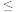 110-5mol/L时,认为Fe3+完全沉淀]。
110-5mol/L时,认为Fe3+完全沉淀]。

已知:①PbSO4难溶于
 ;
;②常温下,Ksp(PbCO3)=8×10-14,Ksp(PbSO4)=1.6×10-8,Ksp(PbCrO4)=2.8×10-13, Ksp[Pb(OH)2]=1.0×10-16,Ksp[Fe(OH)3]=1.0×10-38。
常温下,若测得“酸浸”后所得溶液中c(Pb2+)=0.1mol/L,则“除铁”过程中需要控制溶液pH的范围为
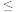 110-5mol/L时,认为Fe3+完全沉淀]。
110-5mol/L时,认为Fe3+完全沉淀]。
您最近一年使用:0次



