硒(Se)是动物体必需的营养元素。也可用作光敏材料、电解锰的催化剂。
(1)硒是第34号元素,在元素周期表中位于第四周期ⅥA族,则其原子结构示意图为___________ 。
(2)硒与碲为伴生元素,其矿物经处理后可获得SeO2和TeO2的混合物,二者的物理性质如下表。则分离该混合物最适宜的方法是___________ 。
(3)已知常温下亚硒酸和硒酸的电离常数如下表:
①亚硒酸中硒元素的化合价为___________ 。
②亚硒酸的二级电离常数Ka2=___________ (写出表达式),从结构与性质的关系解释,亚硒酸的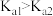 的原因是
的原因是___________ 。
③亚硒酸溶液中通入SO2可发生反应制取硒单质,反应的离子方程式为___________ 。
④电解亚硒酸溶液可制得硒酸,则电解时阳极的电极反应式为___________ 。
⑤亚硒酸钠溶液中滴加少量硒酸氢钠溶液,反应的离子方程式为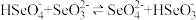 ,此反应的平衡常数K=
,此反应的平衡常数K=___________ 。
(1)硒是第34号元素,在元素周期表中位于第四周期ⅥA族,则其原子结构示意图为
(2)硒与碲为伴生元素,其矿物经处理后可获得SeO2和TeO2的混合物,二者的物理性质如下表。则分离该混合物最适宜的方法是
| 物质 | 熔点/℃ | 沸点/℃ | 升华/℃ | 溶解性 |
| SeO2 | 340 | 684 | 315 | 易溶于水 |
| TeO2 | 733 | 1260 | 450 | 微溶于水 |
(3)已知常温下亚硒酸和硒酸的电离常数如下表:
| 名称 | 分子式 | Ka1 | Ka2 |
| 亚硒酸 | H2SeO3 | 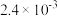 | 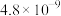 |
| 硒酸 | H2SeO4 | 完全电离 |  |
①亚硒酸中硒元素的化合价为
②亚硒酸的二级电离常数Ka2=
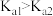 的原因是
的原因是③亚硒酸溶液中通入SO2可发生反应制取硒单质,反应的离子方程式为
④电解亚硒酸溶液可制得硒酸,则电解时阳极的电极反应式为
⑤亚硒酸钠溶液中滴加少量硒酸氢钠溶液,反应的离子方程式为
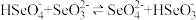 ,此反应的平衡常数K=
,此反应的平衡常数K=
更新时间:2021-11-19 10:59:24
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
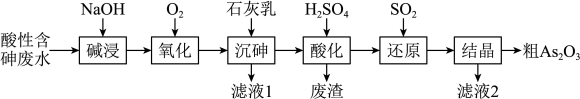
【推荐1】含砷物质是常见的污染物,有色金属冶炼废水中的砷元素主要以亚砷酸( )和砷酸(
)和砷酸( )形式存在,酸性废水中砷元素回收再利用的工业流程如图所示。回答下列问题:
)形式存在,酸性废水中砷元素回收再利用的工业流程如图所示。回答下列问题:
已知:室温时, ,
,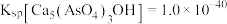 ,
, 的逐级电离平衡常数分别用
的逐级电离平衡常数分别用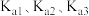 表示,水的离子积常数用
表示,水的离子积常数用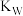 表示。
表示。
(1)先“碱浸”、“沉砷”后“酸化”的目的是___________ ;“氧化”过程发生的离子方程式是___________ 。
(2)“沉砷”选择石灰乳实现如下沉淀转化: ,室温时,此反应的平衡常数为
,室温时,此反应的平衡常数为___________ (用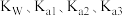 和
和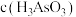 表示)。实验表明,“沉砷”选择的最佳温度为
表示)。实验表明,“沉砷”选择的最佳温度为 ,请用沉淀溶解平衡原理解释温度高于
,请用沉淀溶解平衡原理解释温度高于 后,随着温度的升高,沉淀率下降的原因是
后,随着温度的升高,沉淀率下降的原因是___________ 。
(3)“还原”过程发生的化学方程式是___________ 。
(4)“结晶”时需加热 使其分解获得
使其分解获得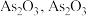 在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,结合图像分析,“结晶”的具体操作是:加热
在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,结合图像分析,“结晶”的具体操作是:加热 ,
,___________ ,得到粗 。
。

 )和砷酸(
)和砷酸( )形式存在,酸性废水中砷元素回收再利用的工业流程如图所示。回答下列问题:
)形式存在,酸性废水中砷元素回收再利用的工业流程如图所示。回答下列问题:
已知:室温时,
 ,
,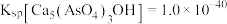 ,
, 的逐级电离平衡常数分别用
的逐级电离平衡常数分别用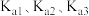 表示,水的离子积常数用
表示,水的离子积常数用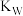 表示。
表示。(1)先“碱浸”、“沉砷”后“酸化”的目的是
(2)“沉砷”选择石灰乳实现如下沉淀转化:
 ,室温时,此反应的平衡常数为
,室温时,此反应的平衡常数为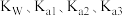 和
和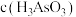 表示)。实验表明,“沉砷”选择的最佳温度为
表示)。实验表明,“沉砷”选择的最佳温度为 ,请用沉淀溶解平衡原理解释温度高于
,请用沉淀溶解平衡原理解释温度高于 后,随着温度的升高,沉淀率下降的原因是
后,随着温度的升高,沉淀率下降的原因是(3)“还原”过程发生的化学方程式是
(4)“结晶”时需加热
 使其分解获得
使其分解获得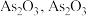 在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,结合图像分析,“结晶”的具体操作是:加热
在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,结合图像分析,“结晶”的具体操作是:加热 ,
, 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】皓矾(ZnSO4·7H2O)是重要的化工原料,可用于制造立德粉,并用作媒染剂、木材防腐剂等。利用钛白废液(含H2SO4约20%,还有少量Fe2+、TiO2+)及闪锌精矿(含有ZnS、SiO2和少量FeS杂质)联合生产ZnSO4·7H2O的流程简化如下:
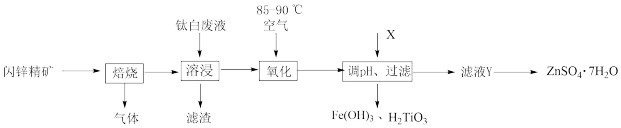
已知:TiOSO4遇水易水解。回答下列问题:
(1)溶浸时,提高浸出率的方法是_______ ,滤渣主要成分为_______ 。
(2)氧化时,发生反应的离子方程式为_______ 。
(3)TiO2+发生水解反应的离子方程式为_______ 。
(4)通常认为残留的离子浓度小于或等于1×10-5mol·L-1时,沉淀完全。25°C时,Fe(OH)3的Ksp近似为1×10-38,则Fe3+完全沉淀时溶液的pH约为_______ 。
(5)加入试剂X可以调节溶液pH,应选用的最佳试剂为_______(填字母)。
(6)由滤液Y得到ZnSO4·7H2O的操作如下_______ 、_______ 过滤,洗涤,干燥。

已知:TiOSO4遇水易水解。回答下列问题:
(1)溶浸时,提高浸出率的方法是
(2)氧化时,发生反应的离子方程式为
(3)TiO2+发生水解反应的离子方程式为
(4)通常认为残留的离子浓度小于或等于1×10-5mol·L-1时,沉淀完全。25°C时,Fe(OH)3的Ksp近似为1×10-38,则Fe3+完全沉淀时溶液的pH约为
(5)加入试剂X可以调节溶液pH,应选用的最佳试剂为_______(填字母)。
| A.NaOH | B.NH3·H2O | C.Zn(OH)2 | D.H2SO4 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】常温下,某化学小组探究硝酸银溶液的性质。
已知:AgOH是一种白色固体,常温下极不稳定,易分解为棕褐色难溶于水的氧化银固体
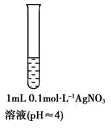
(1)常温下,0.1mol·L-1AgNO3溶液pH约为4,请用离子方程式解释原因___ 。
(2)实验I中,反应的离子方程式是___ 、___ 。
(3)实验II中,经检验,黑色沉淀的成分为Ag。有Ag产生的离子方程式是___ 。经测定,实验产生的气体体积远远大于该反应的理论值,可能的原因是___ 。
(4)实验中,产生黄色沉淀的离子方程式是___ 。有同学猜想,I-有还原性,Ag+有氧化性,AgNO3溶液与KI溶液应该可以发生氧化还原反应。他设计了如图原电池,做实验IV证明了猜想成立。其中,在A烧杯中,石墨电极表面变亮,经检测这种光亮的物质为银单质。乙溶液是___ ,检验B烧杯中产物的药品及现象是__ ,该原电池负极的电极反应方程式是___ 。
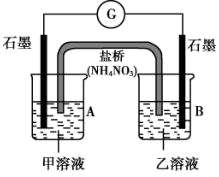
| 装置 | 实验序号 | 实验操作 | 实验现象 |
 | 实验I | 向试管中滴加2%氨水并不断振荡 | 产生白色沉淀,继续滴加沉淀消失 |
| 实验II | 1.向试管中加入0.1mol·L-1NaOH溶液1mL 2.继续滴加3%H2O2至过量 | 1.产生棕褐色沉淀 2.产生大量无色无味气体,有黑色沉淀生成 | |
| 实验III | 1.向试管中滴加1mL0.1mol·L-1 KI溶液 2.取少量上层清液于试管甲中,加入淀粉溶液 | 1.产生黄色沉淀 2.溶液无明显变化 |
(1)常温下,0.1mol·L-1AgNO3溶液pH约为4,请用离子方程式解释原因
(2)实验I中,反应的离子方程式是
(3)实验II中,经检验,黑色沉淀的成分为Ag。有Ag产生的离子方程式是
(4)实验中,产生黄色沉淀的离子方程式是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】Ⅰ:现有以下几种物质①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸钠、⑥亚硫酸氢钠、⑦氨水。请回答下列问题:
(1)以上物质属于弱电解质的是______ (填序号);
(2)常温下④的溶液pH______ 7(填>“<”或“=”),原因______ (用离子方程式表示);
(3)⑥的水溶液中呈酸性,原因是______ 。
(4)常温下,将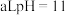 的
的 溶液与
溶液与 的
的 溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的
溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的 ,则
,则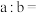
______ 。
(5)已知:
a.常温下,醋酸和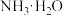 的电离平衡常数均为
的电离平衡常数均为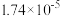 ;
;
b.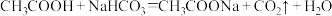
则 溶液呈
溶液呈______ 性(填“酸”、“碱”或“中”,下同), 溶液呈
溶液呈______ 性。
(6)对于醋酸溶液和醋酸钠溶液的下列说法正确的是______;
(1)以上物质属于弱电解质的是
(2)常温下④的溶液pH
(3)⑥的水溶液中呈酸性,原因是
(4)常温下,将
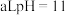 的
的 溶液与
溶液与 的
的 溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的
溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的 ,则
,则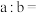
(5)已知:
a.常温下,醋酸和
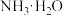 的电离平衡常数均为
的电离平衡常数均为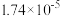 ;
;b.
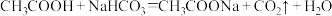
则
 溶液呈
溶液呈 溶液呈
溶液呈(6)对于醋酸溶液和醋酸钠溶液的下列说法正确的是______;
| A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。 |
| B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解。 |
| C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。 |
| D.常温下,醋酸和醋酸钠等体积等浓度混合,溶液呈碱性。 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】醋酸、盐酸是生活中常见的物质。
(1)25℃时,浓度均为0.1mol·L-1的盐酸和醋酸溶液,下列说法正确的是_____________ 。
a.两溶液的pH相同
b.两溶液的导电能力相同
c.两溶液中由水电离出的c(OH-)相同
d.中和等物质的量的NaOH,消耗两溶液的体积相同
(2)醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,下列叙述不正确的是
CH3COO-+H+,下列叙述不正确的是_____________ 。
a.CH3COOH溶液中离子浓度关系满足:c(H+)=c(OH-)+c(CH3COO‾)
b.0.1mol·L-1的CH3COOH溶液加水稀释,溶液中c(OHˉ)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后溶液的pH>7
e.室温下pH=3的醋酸溶液加水稀释,溶液中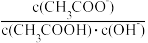 不变
不变
(3)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
a.加水稀释10倍后,醋酸溶液中的c(H+)______ (填“>”“=”或“<”)盐酸溶液中的c(H+)。
b.加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸________ (填“>”“=”或“<”)盐酸。
c.使温度都升高20℃,溶液中c(H+):醋酸________ (填“>”“=”或“<”)盐酸。
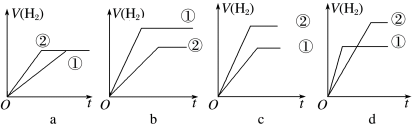
d.分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是________ (填字母)。(①表示盐酸,②表示醋酸)
(1)25℃时,浓度均为0.1mol·L-1的盐酸和醋酸溶液,下列说法正确的是
a.两溶液的pH相同
b.两溶液的导电能力相同
c.两溶液中由水电离出的c(OH-)相同
d.中和等物质的量的NaOH,消耗两溶液的体积相同
(2)醋酸溶液中存在电离平衡:CH3COOH
 CH3COO-+H+,下列叙述不正确的是
CH3COO-+H+,下列叙述不正确的是a.CH3COOH溶液中离子浓度关系满足:c(H+)=c(OH-)+c(CH3COO‾)
b.0.1mol·L-1的CH3COOH溶液加水稀释,溶液中c(OHˉ)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后溶液的pH>7
e.室温下pH=3的醋酸溶液加水稀释,溶液中
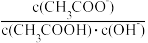 不变
不变(3)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
a.加水稀释10倍后,醋酸溶液中的c(H+)
b.加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸
c.使温度都升高20℃,溶液中c(H+):醋酸
d.分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】常温下向20.00 mL 0.10 mol/L Na2CO3溶液中逐滴加入0.10 mol/L盐酸40.00 mL,所得溶液的pH与加入盐酸体积的关系如表所示:
回答下列问题:
(1)20.00 mL 0.10 mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?______ (用等式表示)。
(2)当V(HCl)=20.00 mL时,溶液呈碱性的原因是________ (用离子方程式和必要的文字说明)此时溶液中c(H2CO3)____ (填“>”、“<”或“=”)c(CO32—)。
(3)V(HCl)=40.00 mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3—+H+的电离常数K1=
HCO3—+H+的电离常数K1=_____ 。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____ (填“变大”、“变小”或“不变”)。
(4)若向20 mL 0.10 mol/L Na2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(Ba2CO3)= 。
| 溶液的pH | 加入盐酸的总体积 |
| 12 | V(HCl)=0 |
| 8 | V(HCl)=20.00 mL |
| 5 | V(HCl)=40.00 mL |
回答下列问题:
(1)20.00 mL 0.10 mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?
(2)当V(HCl)=20.00 mL时,溶液呈碱性的原因是
(3)V(HCl)=40.00 mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3
 HCO3—+H+的电离常数K1=
HCO3—+H+的电离常数K1=(4)若向20 mL 0.10 mol/L Na2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(Ba2CO3)= 。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】熔融碳酸盐燃料电池具有联合循环发电、燃料利用率高等优点。
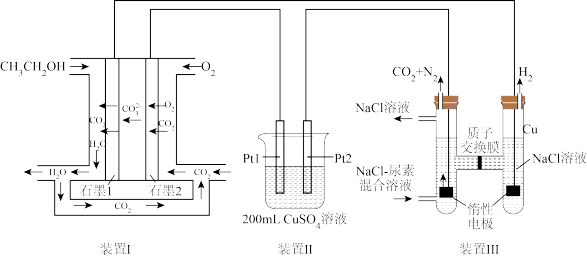
(1)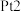 极为
极为__________ (填“阳”或“阴”)极,石墨2极发生___________ (填“氧化”或“还原”)反应。
(2)石墨1极的电极反应式为_________________ 。
(3)若装置Ⅰ中消耗标准状况下 ,则装置Ⅱ烧杯中溶液的
,则装置Ⅱ烧杯中溶液的 为
为_________ 。
(4)利用装置Ⅰ和装置Ⅱ进行电解精炼铜,则应把Pt1换成_________ (填“粗铜”或“精铜”),阴极质量增大 ,转移的电子数为
,转移的电子数为_________ 。
(5)装置Ⅲ中尿素 与
与 发生反应的化学方程式为
发生反应的化学方程式为__________________ ,除去 尿素,则产生标准状况下
尿素,则产生标准状况下 的体积为
的体积为________  。
。

(1)
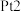 极为
极为(2)石墨1极的电极反应式为
(3)若装置Ⅰ中消耗标准状况下
 ,则装置Ⅱ烧杯中溶液的
,则装置Ⅱ烧杯中溶液的 为
为(4)利用装置Ⅰ和装置Ⅱ进行电解精炼铜,则应把Pt1换成
 ,转移的电子数为
,转移的电子数为(5)装置Ⅲ中尿素
 与
与 发生反应的化学方程式为
发生反应的化学方程式为 尿素,则产生标准状况下
尿素,则产生标准状况下 的体积为
的体积为 。
。
您最近一年使用:0次
【推荐2】燃煤烟气中的NOx、SO2经处理后可被吸收。
(1)若烟气主要成分为NO、SO2,可通过电解法除去,其原理如图1所示。阴极的电极反应式为___ 。电解过程得到产物为___ 。
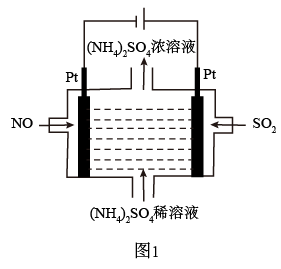
(2)若烟气主要成分为NO2、SO2,可通入NaOH溶液将NO2完全转化为NO 。则NO2、SO2与NaOH反应的离子方程式为
。则NO2、SO2与NaOH反应的离子方程式为___ 。
(3)O3氧化性强于O2,能更有效地氧化NO。
①2NO(g)+O2(g)=2NO2(g)ΔH1=-114kJ·mol-1
2O3(g)=3O2(g)ΔH2=-284.2kJ·mol-1(活化能Ea=119.2kJ·mol-1)
NO(g)+O3(g)=NO2(g)+O2(g)ΔH3=___ kJ·mol-1(活化能Ea=3.2kJ·mol-1)
②NO可经O3处理后再用碱液吸收而实现脱除。为分析氧化时温度对NO脱除率的影响,将NO与O3混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,NO脱除率随NO与O3混合反应时温度变化如图2所示。温度在50~150℃时,随着温度升高,NO脱除率无明显变化;温度超过150℃时,随着温度升高,NO脱除率下降。其可能原因是___ 。

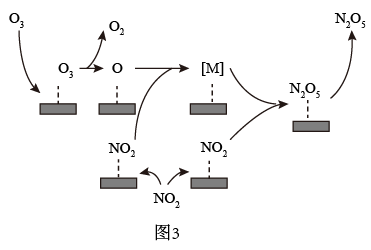
(4)用O3氧化NO2时,使用催化剂可提高氧化效率。研究发现NO2在某催化剂表面被O3氧化时反应机理如图3所示,反应过程中,氮氧化物[M]与NO2按物质的量1∶1反应生成N2O5,[M]的化学式为___ 。该催化氧化过程总反应的化学方程式为___ 。
(1)若烟气主要成分为NO、SO2,可通过电解法除去,其原理如图1所示。阴极的电极反应式为

(2)若烟气主要成分为NO2、SO2,可通入NaOH溶液将NO2完全转化为NO
 。则NO2、SO2与NaOH反应的离子方程式为
。则NO2、SO2与NaOH反应的离子方程式为(3)O3氧化性强于O2,能更有效地氧化NO。
①2NO(g)+O2(g)=2NO2(g)ΔH1=-114kJ·mol-1
2O3(g)=3O2(g)ΔH2=-284.2kJ·mol-1(活化能Ea=119.2kJ·mol-1)
NO(g)+O3(g)=NO2(g)+O2(g)ΔH3=
②NO可经O3处理后再用碱液吸收而实现脱除。为分析氧化时温度对NO脱除率的影响,将NO与O3混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,NO脱除率随NO与O3混合反应时温度变化如图2所示。温度在50~150℃时,随着温度升高,NO脱除率无明显变化;温度超过150℃时,随着温度升高,NO脱除率下降。其可能原因是

(4)用O3氧化NO2时,使用催化剂可提高氧化效率。研究发现NO2在某催化剂表面被O3氧化时反应机理如图3所示,反应过程中,氮氧化物[M]与NO2按物质的量1∶1反应生成N2O5,[M]的化学式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1平衡常数为K1
FeO(s)+CO(g) ΔH1平衡常数为K1
反应Ⅱ:Fe(s)+H2O(g) FeO(s)+H2(g) ΔH1平衡常数为K2
FeO(s)+H2(g) ΔH1平衡常数为K2
不同温度下,K1、K2的值如下表:
现有反应Ⅲ:H2(g)+CO2(g) CO(g)+H2O(g),结合上表数据,反应Ⅲ是
CO(g)+H2O(g),结合上表数据,反应Ⅲ是___ (填“放热”或“吸热”)反应,为提高CO2的转化率可采用措施有___ (写出任意两条)。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) ∆H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) ∆H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。

①图1中投料比相同,温度从高到低的顺序为______ 。
②图2中m1、m2、m3从大到小的顺序为____ 。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为____ ,T4温度时,该反应平衡常数KP的计算式为____ 。
(3)工业上常用高浓度的 K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:
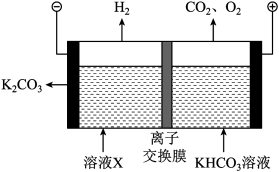
①在阳极区发生的反应包括____ 和H++HCO3- ==CO2↑+H2O
②简述CO32-在阴极区再生的原理:____ 。
(1)反应Ⅰ:Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH1平衡常数为K1
FeO(s)+CO(g) ΔH1平衡常数为K1反应Ⅱ:Fe(s)+H2O(g)
 FeO(s)+H2(g) ΔH1平衡常数为K2
FeO(s)+H2(g) ΔH1平衡常数为K2不同温度下,K1、K2的值如下表:
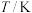 | 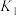 | 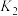 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
现有反应Ⅲ:H2(g)+CO2(g)
 CO(g)+H2O(g),结合上表数据,反应Ⅲ是
CO(g)+H2O(g),结合上表数据,反应Ⅲ是(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g) ∆H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) ∆H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
①图1中投料比相同,温度从高到低的顺序为
②图2中m1、m2、m3从大到小的顺序为
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为
(3)工业上常用高浓度的 K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:

①在阳极区发生的反应包括
②简述CO32-在阴极区再生的原理:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】正溴丁烷可用于合成麻醉药盐酸丁卡因,也用于生产染料和香料,是稀有元素萃取的溶剂及有机合成的中间体,其制备如图(夹持装置略):
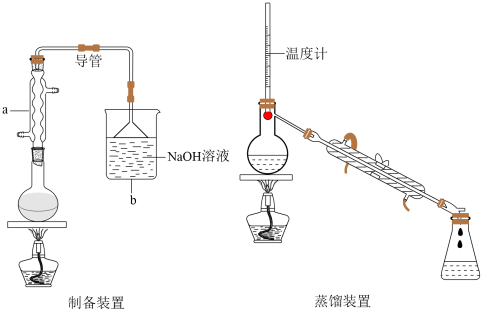
已知:i.NaBr+H2SO4(浓)=HBr↑+NaHSO4
ii.CH3CH2CH2CH2OH+HBr→CH3CH2CH2CH2Br+H2O
iii.2HBr+H2SO4(浓) Br2+SO2+2H2O
Br2+SO2+2H2O
请回答下列问题:
(1)仪器a的名称是___________ 。装置b的作用是___________ 。
(2)制备过程中,加热回流,在此期间要不断地摇动反应装置,其原因为___________ 。
(3)若选用较浓的硫酸作为反应物,得到的产品会呈黄色,为除去颜色,最好选择下列的___________ (填标号)溶液来洗涤产品。
A.四氯化碳 B.硫酸钠 C.氢氧化钠 D.亚硫酸钠
产品选择上述溶液洗涤后,还需要用蒸馏水洗涤一次,洗涤液与产品分离的操作是___________ (填操作名称)。
(4)分离得到的有机层依次用适量的水、饱和NaHCO3溶液、水洗涤、用无水CaCl2干燥。以上两次用水洗涤简化为一次用水洗涤是否合理___________ (填“合理”或“不合理”)。
(5)若投入正丁醇14.8g,得到产物15.6g,则正溴丁烷的产率为___________ %(保留一位小数)。

已知:i.NaBr+H2SO4(浓)=HBr↑+NaHSO4
ii.CH3CH2CH2CH2OH+HBr→CH3CH2CH2CH2Br+H2O
iii.2HBr+H2SO4(浓)
 Br2+SO2+2H2O
Br2+SO2+2H2O请回答下列问题:
(1)仪器a的名称是
(2)制备过程中,加热回流,在此期间要不断地摇动反应装置,其原因为
(3)若选用较浓的硫酸作为反应物,得到的产品会呈黄色,为除去颜色,最好选择下列的
A.四氯化碳 B.硫酸钠 C.氢氧化钠 D.亚硫酸钠
产品选择上述溶液洗涤后,还需要用蒸馏水洗涤一次,洗涤液与产品分离的操作是
(4)分离得到的有机层依次用适量的水、饱和NaHCO3溶液、水洗涤、用无水CaCl2干燥。以上两次用水洗涤简化为一次用水洗涤是否合理
(5)若投入正丁醇14.8g,得到产物15.6g,则正溴丁烷的产率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】 是锂离子电池中广泛应用的电解质。某工厂用LiF、
是锂离子电池中广泛应用的电解质。某工厂用LiF、 为原料,低温反应制备
为原料,低温反应制备 ,其流程如下:
,其流程如下:
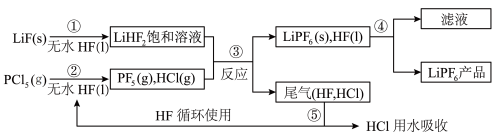
已知:HCl的沸点是-85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是做反应物和___________ 。反应设备不能用玻璃材质的原因是___________ (用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的___________ 溶液冲洗。
(2)该流程需在无水条件下进行,第②步反应中 极易水解,其产物为两种酸,写出
极易水解,其产物为两种酸,写出 水解的化学方程式:
水解的化学方程式:___________ 。
(3)第④步分离采用的方法是___________ ;第⑤步分离尾气中HF、HCl采用的方法是___________ 。
(4) 产品中通常混有少量LiF.取样品w g,测得Li的物质的量为n mol,则该样品中
产品中通常混有少量LiF.取样品w g,测得Li的物质的量为n mol,则该样品中 的物质的量为
的物质的量为___________ mol(用含有w、n的代数式表示)。
 是锂离子电池中广泛应用的电解质。某工厂用LiF、
是锂离子电池中广泛应用的电解质。某工厂用LiF、 为原料,低温反应制备
为原料,低温反应制备 ,其流程如下:
,其流程如下:
已知:HCl的沸点是-85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是做反应物和
(2)该流程需在无水条件下进行,第②步反应中
 极易水解,其产物为两种酸,写出
极易水解,其产物为两种酸,写出 水解的化学方程式:
水解的化学方程式:(3)第④步分离采用的方法是
(4)
 产品中通常混有少量LiF.取样品w g,测得Li的物质的量为n mol,则该样品中
产品中通常混有少量LiF.取样品w g,测得Li的物质的量为n mol,则该样品中 的物质的量为
的物质的量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
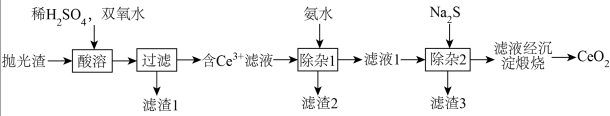
【推荐3】稀土抛光粉 有优良抛光性能。某抛光后产生的抛光渣(含
有优良抛光性能。某抛光后产生的抛光渣(含 、
、 、
、 、
、 、
、 、
、 等的化合物)进行提纯的工艺如下:
等的化合物)进行提纯的工艺如下:
已知:25℃时, ,
,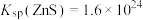 ,
, 。一定条件下,一些金属氢氧化物沉淀时的
。一定条件下,一些金属氢氧化物沉淀时的 如下表:
如下表:
(1)“酸溶”时,需控制80℃水浴加热,若温度过高浸出率降低的原因是_____ 。 发生反应的离子方程式为
发生反应的离子方程式为_____ 。
(2)“滤渣1”的主要成分为_____ 。
(3)“除杂1”中,加入氨水控制 范围为
范围为_____ ,溶液中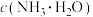
_____  (填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为
(填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为_____ 。
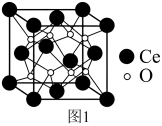
(4) 的晶胞结构如图1所示,晶胞参数为
的晶胞结构如图1所示,晶胞参数为 ,
, 原子处于
原子处于 形成的四面体间隙中。则
形成的四面体间隙中。则 原子的配位数为
原子的配位数为_____ ,晶胞密度为_____  。(列出计算式,
。(列出计算式, 的式量为
的式量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 )
)
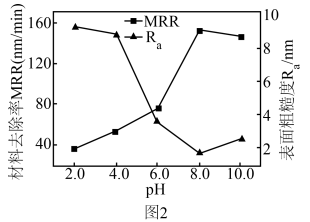
(5)纳米 分散液用于光学玻璃抛光时,
分散液用于光学玻璃抛光时, 值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中,
值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中, 纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳
纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳 值为
值为_____ ,在较低 值,抛光效果不理想的原因为
值,抛光效果不理想的原因为_____ 。
 有优良抛光性能。某抛光后产生的抛光渣(含
有优良抛光性能。某抛光后产生的抛光渣(含 、
、 、
、 、
、 、
、 、
、 等的化合物)进行提纯的工艺如下:
等的化合物)进行提纯的工艺如下:
已知:25℃时,
 ,
,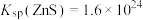 ,
, 。一定条件下,一些金属氢氧化物沉淀时的
。一定条件下,一些金属氢氧化物沉淀时的 如下表:
如下表:| 金属氢氧化物 |  |  |  | 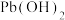 |  |
开始沉淀的 | 2.3 | 3.5 | 6.4 | 7.2 | 6.2 |
完全沉淀的 | 3.2 | 4.6 | 9.0 | 9.1 | 8.2 |
 发生反应的离子方程式为
发生反应的离子方程式为(2)“滤渣1”的主要成分为
(3)“除杂1”中,加入氨水控制
 范围为
范围为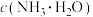
 (填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为
(填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为(4)
 的晶胞结构如图1所示,晶胞参数为
的晶胞结构如图1所示,晶胞参数为 ,
, 原子处于
原子处于 形成的四面体间隙中。则
形成的四面体间隙中。则 原子的配位数为
原子的配位数为 。(列出计算式,
。(列出计算式, 的式量为
的式量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 )
) 
(5)纳米
 分散液用于光学玻璃抛光时,
分散液用于光学玻璃抛光时, 值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中,
值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中, 纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳
纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳 值为
值为 值,抛光效果不理想的原因为
值,抛光效果不理想的原因为
您最近一年使用:0次



