下列说法正确的是
A.25℃时,水电离出的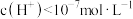 溶液,其pH>7 溶液,其pH>7 |
| B.25℃时,pH=3的HCl与pH=11的MOH溶液混合,测得pH>7,则MOH为弱碱 |
| C.25℃时,若测得HR溶液pH=a,取该溶液10.0mL,滴入10.0mLNaR浓溶液,测得pH=b,b>a,则HR是弱酸 |
D.25℃时,物质的量浓度相等的盐溶液NaX与NaY,若 ,则HX为强酸 ,则HX为强酸 |
2021·浙江温州·一模 查看更多[8]
湖南省株洲九方中学2022-2023学年高二上学期期中考试化学试题(已下线)化学预测卷(二)-预测卷(浙江专版)(已下线)2023年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷A湖南省邵阳市第二中学2021-2022学年高二下学期入学考试化学试题浙江省2022届高三考前第三次模拟考试化学试题(已下线)化学-2022年高考押题预测卷02(浙江卷)(已下线)解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)浙江省温州市2022届高三11月适应性测试化学试题
更新时间:2021-11-17 18:58:02
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,含A元素的有关微粒物质的量变化如下图所示。根据图示判断,下列说法正确的是
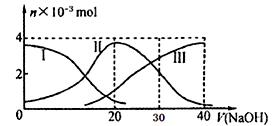
A.H2A在水中的电离方程式是:H2A == H+ +HA- ; HA-  H++A2- H++A2- |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+ c(HA-)+ 2c(H2A)=c(A2-)+2c(OH-) |
| D.当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】25℃时,向弱酸HB溶液中加入强碱MOH溶液反应后,溶液的pH=7。下列判断正确的是
| A.加入的碱过量 |
| B.生成的盐不发生水解 |
| C.混合前酸与碱溶液中溶质的物质的量相等 |
| D.反应后溶液中B-、M+物质的量浓度相等 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】室温下,将cmol/L的CH3COOH溶液1.0L与0.1molNaOH固体混合,使之充分反应后得到b点对应的溶液。然后向该混合溶液中通入HCI 气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的量的变化如下图所示。下列叙述不正确的是
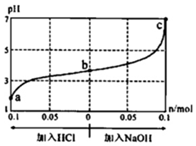

| A.a点对应的混合溶液中:c(CH3COOH)>c(Na+)=c(Cl-)>c(OH-) |
B.向b点对应的溶液中通入HCl气体,充分反应后,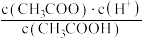 的值保持不变 的值保持不变 |
| C.c点对应的混合溶液中c(CH3COO-)=c(Na+) |
| D.起始醋酸溶液物质的量浓度c(CH3COOH)=0.2mol/L |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】25℃时,用同一较高浓度的NaOH溶液分别滴定酸HA和CuSO4溶液,pM[p 表示负对数, M表示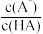 、c(Cu2+)]与溶液pH的变化关系如图。已知; CuA2 易溶于水,一般认为反应的平衡常数为K> 105时反应进行完全。下列说法错误的是
、c(Cu2+)]与溶液pH的变化关系如图。已知; CuA2 易溶于水,一般认为反应的平衡常数为K> 105时反应进行完全。下列说法错误的是

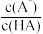 、c(Cu2+)]与溶液pH的变化关系如图。已知; CuA2 易溶于水,一般认为反应的平衡常数为K> 105时反应进行完全。下列说法错误的是
、c(Cu2+)]与溶液pH的变化关系如图。已知; CuA2 易溶于水,一般认为反应的平衡常数为K> 105时反应进行完全。下列说法错误的是
| A.HA为一元弱酸,25℃时 Ka=10-7.4 |
| B.①表示滴定CuSO4溶液时pM与溶液pH的关系 |
| C.滴定HA溶液至x点时,溶液中c(HA)> c(A-)> c(Na+) |
| D.滴定CuSO4溶液至x点时,若改为滴加HA溶液,沉淀会逐渐完全溶解 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】根据实验目的,下列实验方法及现象、结论都正确的是
| 选项 | 实验目的 | 实验方法及现象 | 结论 |
| A | 比较 和F- 的水解常数 和F- 的水解常数 | 分别测浓度均为  和NaF溶液的pH,后者大于前者 和NaF溶液的pH,后者大于前者 | Kh(CH3COO-)<Kh(F- ) |
| B | 比较HClO和CH3COOH的酸性强弱 | 室温下,用pH试纸分别测定浓度为0.1mol/L NaClO溶液和0.1mol/L CH3COONa溶液的pH,前者大于后者 | 酸性:CH3COOH>HClO |
| C | 证明HA为弱酸 | 等pH且等体积的HA溶液和盐酸分别与足量NaOH固体反应,前者消耗NaOH固体的量更多 | HA为弱酸 |
| D | 测量某溶液的酸碱性 | 某温度下,用pH计测量0.1mol/L的NaA溶液的pH值为7.0 | 该溶液为中性溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,向1L1.0mol·L-1的NaClO溶液中缓慢通入SO2气体,使其充分吸收,溶液pH与通入SO2的物质的量关系如图所示(忽略溶液体积的变化和NaClO、HClO的分解)。下列说法错误的是
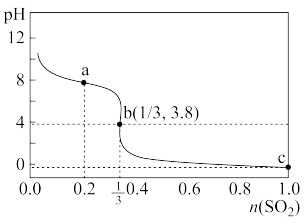

| A.常温下,HClO电离平衡常数的数量级为10—8 |
| B.水的电离程度:a>b>c |
C.b点溶液中:c(Cl—)+c(SO )=c(ClO—)+c(HClO) )=c(ClO—)+c(HClO) |
D.c点溶液中:c(Cl—)+c(ClO—)+2c(SO )+c(OH—)=c(H+)+c(Na+) )+c(OH—)=c(H+)+c(Na+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】变化观念与平衡思想分析一定温度下Mg2+在不同pH的Na2CO3体系中的可能产物。
下列说法不正确的是

图2中曲线I的离子浓度关系符合c(Mg2+)•c2(OH )=Ksp[Mg(OH)2];曲线II的离子浓度关系符合c(Mg2+)•c(CO
)=Ksp[Mg(OH)2];曲线II的离子浓度关系符合c(Mg2+)•c(CO )=Ksp(MgCO3)。
)=Ksp(MgCO3)。
下列说法不正确的是
A.饱和NaHCO3溶液中c(CO )<c(H2CO3) )<c(H2CO3) |
| B.初始状态pH=11、lg[c(Mg2+)]=-6,无沉淀生成 |
C.初始状态pH=9、lg[c(Mg2+)]=-2,平衡后溶液中存在c(H2CO3)+c(HCO )+c(CO )+c(CO )=0.1mol•L-1 )=0.1mol•L-1 |
D.初始状态pH=8、lg[c(Mg2+)]=-1,发生反应:Mg2++2HCO =MgCO3↓+CO2↑+H2O =MgCO3↓+CO2↑+H2O |
您最近一年使用:0次
单选题
|
较难
(0.4)
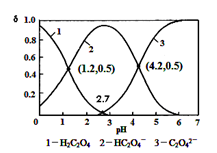
【推荐3】已知草酸为二元弱酸:H2C2O4 HC2O4-+ H+ Ka1; HC2O4-
HC2O4-+ H+ Ka1; HC2O4- C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是
C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是
 HC2O4-+ H+ Ka1; HC2O4-
HC2O4-+ H+ Ka1; HC2O4- C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是
C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是
| A.常温下,Ka1:Ka2=1000 |
| B.将相同物质的量 KHC2O4和 K2C2O4固体完全溶于水可配得 pH 为 4.2 的混合液 |
| C.pH=1.2溶液中:c(K +) + c(H +) = c(OH-) + c(H2C2O4) |
| D.向pH=1.2的溶液中加KOH 溶液将pH增大至4.2的过程中水的电离度一直增大 |
您最近一年使用:0次




