25℃时,用同一较高浓度的NaOH溶液分别滴定酸HA和CuSO4溶液,pM[p 表示负对数, M表示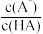 、c(Cu2+)]与溶液pH的变化关系如图。已知; CuA2 易溶于水,一般认为反应的平衡常数为K> 105时反应进行完全。下列说法错误的是
、c(Cu2+)]与溶液pH的变化关系如图。已知; CuA2 易溶于水,一般认为反应的平衡常数为K> 105时反应进行完全。下列说法错误的是

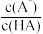 、c(Cu2+)]与溶液pH的变化关系如图。已知; CuA2 易溶于水,一般认为反应的平衡常数为K> 105时反应进行完全。下列说法错误的是
、c(Cu2+)]与溶液pH的变化关系如图。已知; CuA2 易溶于水,一般认为反应的平衡常数为K> 105时反应进行完全。下列说法错误的是
| A.HA为一元弱酸,25℃时 Ka=10-7.4 |
| B.①表示滴定CuSO4溶液时pM与溶液pH的关系 |
| C.滴定HA溶液至x点时,溶液中c(HA)> c(A-)> c(Na+) |
| D.滴定CuSO4溶液至x点时,若改为滴加HA溶液,沉淀会逐渐完全溶解 |
更新时间:2023-06-05 17:16:29
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】下列指定反应的离子方程式书写正确的是
| A.向次氯酸钠溶液中通入少量二氧化碳:2ClO- + CO2+H2O =2HClO+CO32- (已知电离常数:H2CO3 :Ka1 = 4.4×10-7、Ka2= 4.7×10-11;HClO:K=2.9×10-8) |
| B.金属钠与水反应:2Na + 2H2O = 2Na++ 2OH-+ H2↑ |
| C.硫酸铝溶液中加入过量氨水:Al3+ + 3OH-= Al(OH)3↓ |
| D.硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应:Na2S2O3 + 2H+= 2Na+ + S↓+ SO2↑+ H2O |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列过程中的化学反应,相应的离子方程式正确的是
| H2CO3 | Ka1=4.30×10-7 | Ka2=5.61×10-11 | H2SO3 | Ka1=1.54×10-2 | Ka2=1.02×10-7 |
| HClO | Ka=2.95×10-8 | H2S | Ka1=9.1×10-8 | Ka2=1.1×10-12 |
| A.CuCl2溶液中通入H2S气体:Cu2++S2-=CuS↓ |
B.NaClO溶液中通少量CO2:ClO-+CO2+H2O=HClO+HCO |
C.向Na2S溶液中通入少量SO2:S2-+SO2+H2O=SO +H2S +H2S |
D.Na2CO3溶液中通入过量SO2:CO +SO2=SO +SO2=SO +CO2 +CO2 |
您最近一年使用:0次
【推荐1】室温下,下列实验探究方案不能 达到实验目的的是
选项 | 探究方案 | 探究目的 |
A | 室温下,向一定量饱和Na2CO3溶液中通入足量CO2气体,观察是否有晶体析出 | 室温下固体在水中的溶解性: |
B | 向FeBr2溶液中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色的变化 | Fe2+的还原性比Br-的强 |
C | 用 计测量相同温度、相同浓度NaClO溶液、 计测量相同温度、相同浓度NaClO溶液、 溶液的pH,比较pH大小 溶液的pH,比较pH大小 | HClO的酸性比 的强 的强 |
D | 向 溶液中滴入2滴 溶液中滴入2滴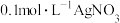 溶液,有沉淀生成,再滴入4滴 溶液,有沉淀生成,再滴入4滴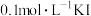 溶液,观察沉淀颜色变化 溶液,观察沉淀颜色变化 | 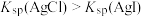 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】下列实验探究方案能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 在葡萄糖溶液中滴入少量酸性 溶液,观察 溶液,观察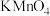 溶液是否褪色 溶液是否褪色 | 葡萄糖中是否含有醛基 |
| B | 室温下,用pH计分别测定浓度均为0.1mol· 的NaClO和 的NaClO和 溶液的pH 溶液的pH | 比较 和 和 的大小 的大小 |
| C | 将镀层破损的镀锌铁片放入酸化的3%NaCl溶液中一段时间后,取溶液于试管中,滴加KSCN溶液,观察现象 | 已破损的镀层锌是否仍对铁有保护作用 |
| D | 取两支试管,分别加入2mL0.5mol· 的 的 溶液,将其中一支试管先加热,然后置于冷水中,与另一支管对比 溶液,将其中一支试管先加热,然后置于冷水中,与另一支管对比 | 探究温度对化学平衡的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】室温下,通过下列实验探究Na2SO3溶液的性质。
下列有关说法正确的是
| 实验 | 实验操作和现象 |
| 1 | 用pH试纸测定某Na2SO3溶液的pH,测得pH约为9 |
| 2 | 向Na2SO3溶液中滴加酸性KMnO4溶液,溶液紫红色褪去 |
| 3 | 将浓度均为 的Na2SO3和Ba(OH)2溶液等体积混合,产生白色沉淀 的Na2SO3和Ba(OH)2溶液等体积混合,产生白色沉淀 |
| 4 | 向Na2SO3溶液中滴加稀盐酸,有刺激性气体产生 |
A.Na2SO3溶液中存在 |
| B.实验2说明Na2SO3溶液具有漂白性 |
C.依据实验3的现象得出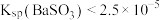 |
| D.实验4中生成的刺激性气体可能为Cl2 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】Cu2+-NH3体系中存在如下平衡: 、
、
 、
、 、
、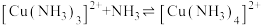 ,平衡常数依次为
,平衡常数依次为 已知
已知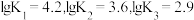 ,体系中含Cu物种的组分分布系数δ与
,体系中含Cu物种的组分分布系数δ与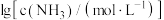 的关系如图所示,N点的横坐标为-2.2,δ(x)=
的关系如图所示,N点的横坐标为-2.2,δ(x)=  。下列说法错误的是
。下列说法错误的是
 、
、
 、
、 、
、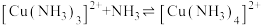 ,平衡常数依次为
,平衡常数依次为 已知
已知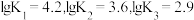 ,体系中含Cu物种的组分分布系数δ与
,体系中含Cu物种的组分分布系数δ与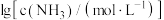 的关系如图所示,N点的横坐标为-2.2,δ(x)=
的关系如图所示,N点的横坐标为-2.2,δ(x)=  。下列说法错误的是
。下列说法错误的是
A.曲线①为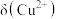 的变化曲线 的变化曲线 |
B.lg |
| C.M点的横坐标为-3.9 |
D.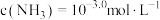 时, 时, |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】25℃时,用HCl气体调节 氨水的pH,溶液的pH与反应物的物质的量之比[
氨水的pH,溶液的pH与反应物的物质的量之比[ ]关系如图所示。若已知P1所示溶液中
]关系如图所示。若已知P1所示溶液中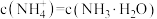 ,且忽略通入气体后溶液体积的变化,下列有关说法正确的是
,且忽略通入气体后溶液体积的变化,下列有关说法正确的是

 氨水的pH,溶液的pH与反应物的物质的量之比[
氨水的pH,溶液的pH与反应物的物质的量之比[ ]关系如图所示。若已知P1所示溶液中
]关系如图所示。若已知P1所示溶液中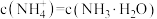 ,且忽略通入气体后溶液体积的变化,下列有关说法正确的是
,且忽略通入气体后溶液体积的变化,下列有关说法正确的是
A.P1所示溶液: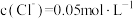 |
B.P2所示溶液: |
C.P3所示溶液: mol/L mol/L |
D.25℃时, 的电离平衡常数为 的电离平衡常数为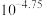 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】下列有关说法正确的是
A.已知电离平衡常数(25℃),Ka(HClO)=2.95×l0–8;H2CO3Ka1=4.3×l0–7、Ka2=5.6×l0–11,将少量的CO2通入NaClO溶液中反应离子方程式为:2ClO-+CO2+H2O=2HClO+CO |
| B.已知常温下A-的水解常数K=1.61×10-5。含等物质的量浓度HA、NaA的混合液中则有:c(HA)>c(Na+)>c(A-)>c(OH-)>c(H+) |
| C.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
D.在25℃,Ksp(AgCl)约为1×10-10,Ksp(Ag2CrO4)约为4×10-12,向均为0.1mol/L的NaCl和Na2CrO4混合液中滴加0.1mol/LAgNO3溶液,CrO 先沉淀 先沉淀 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】 时,某酸
时,某酸 溶液中存在的各种含R元素微粒在总浓度中所占分数
溶液中存在的各种含R元素微粒在总浓度中所占分数 随溶液
随溶液 的变化关系如图所示。下列叙述不正确的是
的变化关系如图所示。下列叙述不正确的是

 时,某酸
时,某酸 溶液中存在的各种含R元素微粒在总浓度中所占分数
溶液中存在的各种含R元素微粒在总浓度中所占分数 随溶液
随溶液 的变化关系如图所示。下列叙述不正确的是
的变化关系如图所示。下列叙述不正确的是
A. 的数量级为 的数量级为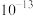 |
B. 溶液中, 溶液中, |
C.若 ,则 ,则 |
D. 易与溶液中的 易与溶液中的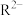 形成沉淀, 形成沉淀, 时 时 恰好沉淀完全 恰好沉淀完全 ,此时 ,此时 ( ( 的 的 为 为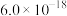 ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】一定温度下, 和
和 的沉淀溶解平衡曲线如图所示。
的沉淀溶解平衡曲线如图所示。
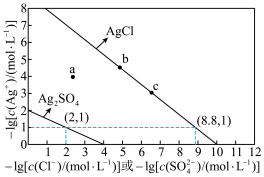
下列说法正确的是
 和
和 的沉淀溶解平衡曲线如图所示。
的沉淀溶解平衡曲线如图所示。
下列说法正确的是
A.a点条件下能生成 沉淀,也能生成 沉淀,也能生成 沉淀 沉淀 |
B.加适量 固体可使溶液由 固体可使溶液由 点变到 点变到 点 点 |
C.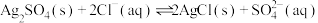 的平衡常数很大,反应趋于完全 的平衡常数很大,反应趋于完全 |
D.向 、 、 均为 均为 的混合溶液中滴加 的混合溶液中滴加 溶液,先产生 溶液,先产生 沉淀 沉淀 |
您最近一年使用:0次


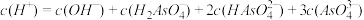
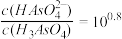
 时,
时, 和
和 的饱和溶液中,金属阳离子的物质的量浓度的负对数
的饱和溶液中,金属阳离子的物质的量浓度的负对数 与溶液
与溶液 下列说法正确的是
下列说法正确的是


 ,可转化为Y点对应的溶液
,可转化为Y点对应的溶液 溶液中含有的少量
溶液中含有的少量 ,可加入适量
,可加入适量


