实验题。
I.现使用酸碱中和滴定法测定某市售白醋(含CH3COOH,是一元弱酸)的总酸量。实验步骤如下:
(1)用___ (填仪器名称)量取10.00mL市售白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得稀释白醋溶液,取该稀释白醋溶液20.00mL于锥形瓶中,向其中滴加2滴___ 作指示剂。
(2)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为___ mL。

(3)滴定。当___ 时,停止滴定,并记录NaOH溶液的最终读数。重复滴定4次。
(4)实验记录如表:
按上述数处理,可得c(市售白醋)=___ mol/L。
(5)在本实验的滴定过程中,下列操作会使实验结果偏高的是___ (填字母)。
A.碱式滴定管在滴定时未用NaOH标准溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测稀释白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体测出
E.滴定终点读数时俯视
II.某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。
已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
(6)表中V1=___ mL。
(7)探究反应物浓度对化学反应速率影响的实验编号是___ 。
I.现使用酸碱中和滴定法测定某市售白醋(含CH3COOH,是一元弱酸)的总酸量。实验步骤如下:
(1)用
(2)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为

(3)滴定。当
(4)实验记录如表:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(稀释白醋)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V消耗(NaOH)/mL | 15.00 | 15.04 | 14.96 | 16.52 |
(5)在本实验的滴定过程中,下列操作会使实验结果偏高的是
A.碱式滴定管在滴定时未用NaOH标准溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测稀释白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体测出
E.滴定终点读数时俯视
II.某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。
已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
| 实验编号 | 0.1mol•L-1酸性KMnO4溶液的体积/mL | 0.6mol•L-1H2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
| ① | 10 | V1 | 35 | 25 | |
| ② | 10 | 10 | 30 | 25 | |
| ③ | 10 | 10 | V2 | 50 |
(7)探究反应物浓度对化学反应速率影响的实验编号是
更新时间:2022-01-04 14:04:58
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】合成氨是人类科学技术发展史上的一项重大突破,解决了地球上因粮食不足而导致的饥饿与死亡。
(1)在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g),反应中NH3的物质的量浓度的变化情况如图。
2NH3(g),反应中NH3的物质的量浓度的变化情况如图。
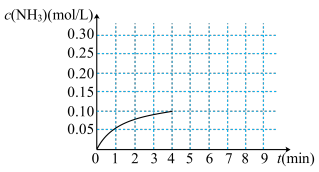
根据图,计算从反应开始到平衡时,氢气的平均反应速率为______ 。
(2)写出该反应的平衡常数表达式______ 若只改变一个影响化学平衡的因素,则下列关于平衡常数K与化学平衡移动关系的叙述正确的是______ 。
a.K值不变,平衡不移动 b.K值变化,平衡一定移动
c.平衡移动,K值可能不变 d.平衡移动,K值一定变化
(3)合成氨工业中采用循环操作,主要是为了______ 。
a.增大化学反应速率 b.提高平衡混合物中氨的含量
c.降低氨的沸点 d.提高氮气和氢气的利用率
工业上以黄铁矿(主要成分FeS2)制备硫酸,要经煅烧、氧化、吸收三个阶段。已知氧化阶段发生如下反应2SO2(g)+O2(g)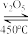 2SO3(g) △H<0。
2SO3(g) △H<0。
(4)黄铁矿煅烧时需粉碎,其目的是______ 。
(5)催化氧化设备内构造如图1所示,其中1—4表示催化剂层。图2所示进程中表示热交换过程的是______ 。
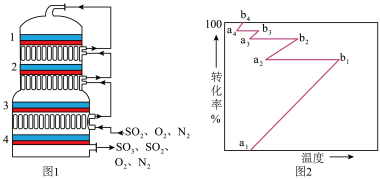
A.a1→b1 B.b1→a2 C.a2→b2 D.b2→a3 E.a3→b3 F.b3→a4
使用热交换器的目的是______ 。
为研究催化氧化时温度对SO2平衡转化率的影响,进行如表试验。取100L原料气(体积分数为SO28%、O212%、N280%)使之发生反应,平衡时得到如表数据:
(6)平衡时,随温度升高N2的体积分数______ (填“增大”、“减小”或“不变”);600℃达平衡时,SO3的体积分数为______ (保留两位小数)。
(1)在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)
 2NH3(g),反应中NH3的物质的量浓度的变化情况如图。
2NH3(g),反应中NH3的物质的量浓度的变化情况如图。
根据图,计算从反应开始到平衡时,氢气的平均反应速率为
(2)写出该反应的平衡常数表达式
a.K值不变,平衡不移动 b.K值变化,平衡一定移动
c.平衡移动,K值可能不变 d.平衡移动,K值一定变化
(3)合成氨工业中采用循环操作,主要是为了
a.增大化学反应速率 b.提高平衡混合物中氨的含量
c.降低氨的沸点 d.提高氮气和氢气的利用率
工业上以黄铁矿(主要成分FeS2)制备硫酸,要经煅烧、氧化、吸收三个阶段。已知氧化阶段发生如下反应2SO2(g)+O2(g)
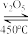 2SO3(g) △H<0。
2SO3(g) △H<0。(4)黄铁矿煅烧时需粉碎,其目的是
(5)催化氧化设备内构造如图1所示,其中1—4表示催化剂层。图2所示进程中表示热交换过程的是

A.a1→b1 B.b1→a2 C.a2→b2 D.b2→a3 E.a3→b3 F.b3→a4
使用热交换器的目的是
为研究催化氧化时温度对SO2平衡转化率的影响,进行如表试验。取100L原料气(体积分数为SO28%、O212%、N280%)使之发生反应,平衡时得到如表数据:
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| SO2平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 74.0 |
您最近一年使用:0次
【推荐2】近年来,随着化石燃料的大量消耗和CO2等温室气体的大量排放,氨的无碳燃料属性引起重视。低能耗高效率合成氨技术的开发是实现氨燃料化利用的基础,基于Al2O3载氮体的碳基化学链合成氨技术示意图如下。
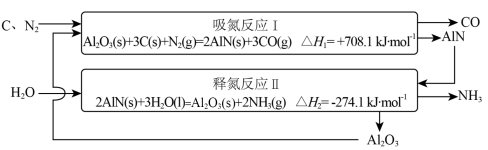
(1)总反应的热化学方程式为_______ ;
(2)有利于提高反应Ⅱ平衡转化率的条件为_______(填标号)。
(3)在温度为T、固定容积为VL、p0=100 kPa条件下进行反应Ⅰ,平衡时氮气转化率为50%,则N2压强为_______ ,分压平衡常数Kp=_______ kPa2。
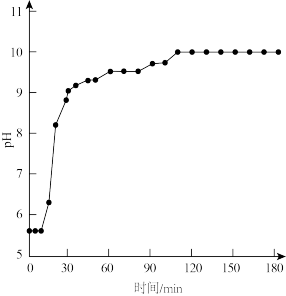
(4)60 C、100 kPa条件下,反应Ⅱ中溶液pH随时间变化如图,120 min~180 min持续收集到氨气,但溶液pH几乎不变的原因是_______ 。
(5)为探究反应Ⅱ中15min时反应速率突然加快的原因,利用计算机模拟反应Ⅱ的反应路径如下。
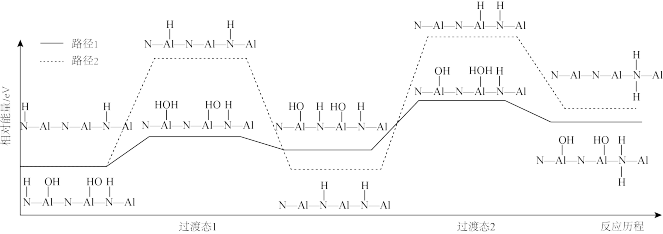
①比较不同路径,路径1能垒较低的原因是_______ 的键能大于_______ 的键能。
②15min时反应速率突然加快的原因是_______ 。
(6)与传统的催化合成氨反应相比,碳基化学链合成氨的优势有_______(填标号)。

(1)总反应的热化学方程式为
(2)有利于提高反应Ⅱ平衡转化率的条件为_______(填标号)。
| A.高温高压 | B.高温低压 | C.低温高压 | D.低温低压 |
(3)在温度为T、固定容积为VL、p0=100 kPa条件下进行反应Ⅰ,平衡时氮气转化率为50%,则N2压强为

(4)60 C、100 kPa条件下,反应Ⅱ中溶液pH随时间变化如图,120 min~180 min持续收集到氨气,但溶液pH几乎不变的原因是
(5)为探究反应Ⅱ中15min时反应速率突然加快的原因,利用计算机模拟反应Ⅱ的反应路径如下。

①比较不同路径,路径1能垒较低的原因是
②15min时反应速率突然加快的原因是
(6)与传统的催化合成氨反应相比,碳基化学链合成氨的优势有_______(填标号)。
| A.能够规避N2和H2在催化剂表面竞争吸附的问题 |
| B.原料成本低,能耗低,产物无需分离,可获得CO副产物 |
| C.规避了催化合成氨的热力学和动力学矛盾,兼顾较高的反应速率和较大的反应限度 |
| D.释氮反应对温度要求不高,相对低的温度能够缓解NH3分解,有利于NH3的收集 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
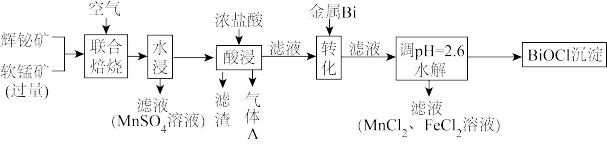
【推荐3】某工厂采用辉铋矿(主要成分为 ,含有
,含有 、
、 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为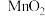 )联合焙烧法制各BiOCl和
)联合焙烧法制各BiOCl和 ,工艺流程如下:
,工艺流程如下:
已知:①焙烧时过量的 分解为
分解为 ,
, 转变为
转变为 ;
;
②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围如下:
回答下列问题:
(1)为提高焙烧效率,可采取的措施为_________ 。
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2) 在空气中单独焙烧生成
在空气中单独焙烧生成 ,反应的化学方程式为
,反应的化学方程式为_________ 。
(3)滤渣的主要成分为_________ (填化学式)。
(4)生成气体A的离子方程式为_________ 。
(5)加入金属Bi的目的是_________ 。
(6)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量BiOCl产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为_________ (保留四位有效数字)。
 ,含有
,含有 、
、 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为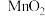 )联合焙烧法制各BiOCl和
)联合焙烧法制各BiOCl和 ,工艺流程如下:
,工艺流程如下:
已知:①焙烧时过量的
 分解为
分解为 ,
, 转变为
转变为 ;
;②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围如下:
| 开始沉淀pH | 完全沉淀pH | |
 | 6.5 | 8.3 |
 | 1.6 | 2.8 |
 | 8.1 | 10.1 |
(1)为提高焙烧效率,可采取的措施为
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2)
 在空气中单独焙烧生成
在空气中单独焙烧生成 ,反应的化学方程式为
,反应的化学方程式为(3)滤渣的主要成分为
(4)生成气体A的离子方程式为
(5)加入金属Bi的目的是
(6)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量BiOCl产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】处理含硫烟气(主要成分为SO2)备受关注,主要有以下两种方法,请回答下列问题:
Ⅰ.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应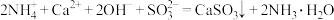 。
。
(1)已知:25℃时,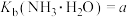 ;
;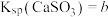 。该温度下,步骤2中反应的平衡常数K=
。该温度下,步骤2中反应的平衡常数K=___________ (用含a、b的代数式表示)。
Ⅱ.水煤气还原法
已知:ⅰ.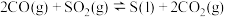
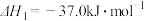
ⅱ.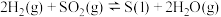
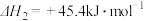
(2)写出 与
与 反应生成
反应生成 、
、 的热化学方程式为
的热化学方程式为___________ 。
Ⅲ.(3)将组成(物质的量分数)为m% SO2(g)、2m% H2(g)、和q%He(g)的气体通入密闭反应器,使反应:H2(g)+ SO2(g)
SO2(g)
 S(s)+H2O(g),在温度t、压强p条件下进行反应,平衡时,若H2转化率为a,则平衡常数Kp=
S(s)+H2O(g),在温度t、压强p条件下进行反应,平衡时,若H2转化率为a,则平衡常数Kp=___________ (以分压表示,分压=总压×物质的量分数)。
Ⅳ.常温下将NaOH溶液滴加到一定浓度的H2SO3溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
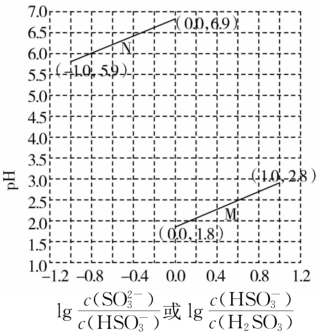
(4)Ka1(H2SO3)=___________ 。
(5)当滴加NaOH溶液使混合溶液呈中性时,溶液中各离子浓度大小关系为:___________ 。
Ⅰ.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应
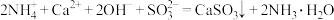 。
。(1)已知:25℃时,
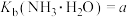 ;
;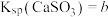 。该温度下,步骤2中反应的平衡常数K=
。该温度下,步骤2中反应的平衡常数K=Ⅱ.水煤气还原法
已知:ⅰ.
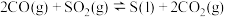
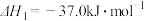
ⅱ.
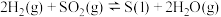
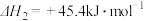
(2)写出
 与
与 反应生成
反应生成 、
、 的热化学方程式为
的热化学方程式为Ⅲ.(3)将组成(物质的量分数)为m% SO2(g)、2m% H2(g)、和q%He(g)的气体通入密闭反应器,使反应:H2(g)+
 SO2(g)
SO2(g)
 S(s)+H2O(g),在温度t、压强p条件下进行反应,平衡时,若H2转化率为a,则平衡常数Kp=
S(s)+H2O(g),在温度t、压强p条件下进行反应,平衡时,若H2转化率为a,则平衡常数Kp=Ⅳ.常温下将NaOH溶液滴加到一定浓度的H2SO3溶液中,混合溶液的pH与离子浓度变化的关系如图所示。

(4)Ka1(H2SO3)=
(5)当滴加NaOH溶液使混合溶液呈中性时,溶液中各离子浓度大小关系为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.某学生用 溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
①移取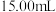 待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
②用标准溶液润洗碱式滴定管2~3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴部分充满溶液
④取标准 溶液注入碱式滴定管至0刻度以上
溶液注入碱式滴定管至0刻度以上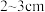
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准 溶液滴定至终点,记下滴定管液面的刻度
溶液滴定至终点,记下滴定管液面的刻度
回答以下填空:
(1)正确操作的顺序是(填序号)②___________ →___________ →___________ →①→___________ 。
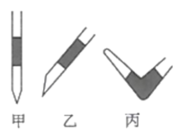
(2)盛 标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用如图中的
标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用如图中的___________ 操作(填“甲”、“乙”、“丙”)。
(3)下列情况可能造成测定结果偏高的是___________ (填标号)。
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.碱式滴定管用蒸馏水洗净后,未用标准液润洗
E.配制标准溶液所用 固体中含少量
固体中含少量 杂质
杂质
Ⅱ.与酸碱中和滴定类似,氧化还原滴定也是测定样品含量常用方法。
(4)某实验室有瓶混有泥沙的乙二酸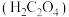 样品,欲测定样品中乙二酸的含量。准确称量
样品,欲测定样品中乙二酸的含量。准确称量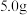 乙二酸样品,配成
乙二酸样品,配成 溶液。量取
溶液。量取 所配溶液于锥形瓶中,加少量硫酸酸化,将
所配溶液于锥形瓶中,加少量硫酸酸化,将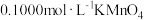 溶液装入
溶液装入___________ (填“酸式”或“碱式”)滴定管,进行滴定操作,当___________ 时,证明达到滴定终点。
(5)滴定过程中发生反应的离子方程式为___________ 。
(6)计算再重复上述操作2次,记录实验数据如下:
则此样品的纯度为___________ 。
 溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
溶液滴定未知浓度的盐酸,其操作可分解为如下几步:①移取
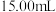 待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞②用标准溶液润洗碱式滴定管2~3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴部分充满溶液
④取标准
 溶液注入碱式滴定管至0刻度以上
溶液注入碱式滴定管至0刻度以上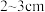
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准
 溶液滴定至终点,记下滴定管液面的刻度
溶液滴定至终点,记下滴定管液面的刻度回答以下填空:
(1)正确操作的顺序是(填序号)②
(2)盛
 标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用如图中的
标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用如图中的
(3)下列情况可能造成测定结果偏高的是
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.碱式滴定管用蒸馏水洗净后,未用标准液润洗
E.配制标准溶液所用
 固体中含少量
固体中含少量 杂质
杂质Ⅱ.与酸碱中和滴定类似,氧化还原滴定也是测定样品含量常用方法。
(4)某实验室有瓶混有泥沙的乙二酸
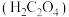 样品,欲测定样品中乙二酸的含量。准确称量
样品,欲测定样品中乙二酸的含量。准确称量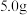 乙二酸样品,配成
乙二酸样品,配成 溶液。量取
溶液。量取 所配溶液于锥形瓶中,加少量硫酸酸化,将
所配溶液于锥形瓶中,加少量硫酸酸化,将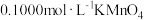 溶液装入
溶液装入(5)滴定过程中发生反应的离子方程式为
(6)计算再重复上述操作2次,记录实验数据如下:
| 序号 | 滴定前读数( ) ) | 滴定后读数( ) ) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 22.10 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,再通过滴定测量。已知:NH3+ H3BO3=NH3·H3BO3;NH3·H3BO3+ HCl = NH4Cl + H3BO3。
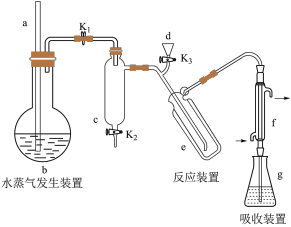
回答下列问题:
(1)a的作用是___________________________ 。
(2)b中放入少量碎瓷片的目的是____________ 。f的名称是_______________ 。
(3)清洗仪器:g中加蒸馏水;打开k1,关闭k2、k3,加热b,蒸气充满管路;停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是________________________________________ 。打开k2放掉水,重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水。打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是____________________________ 。
②e中主要反应的离子方程式为.____________________________________________ ,e采用中空双层玻璃瓶的作用是___________________________________ 。
(5)取某甘氨酸(C2H5NO2)样品mg进行测定,滴定g中吸收液时消耗浓度为cmol·L-1的盐酸VmL,则样品中氮的质量分数为__________________________ (不需化简),选择指示剂为____________________ 。

回答下列问题:
(1)a的作用是
(2)b中放入少量碎瓷片的目的是
(3)清洗仪器:g中加蒸馏水;打开k1,关闭k2、k3,加热b,蒸气充满管路;停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水。打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是
②e中主要反应的离子方程式为.
(5)取某甘氨酸(C2H5NO2)样品mg进行测定,滴定g中吸收液时消耗浓度为cmol·L-1的盐酸VmL,则样品中氮的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】I 充满HCl(标准状况)的烧瓶做完喷泉实验后得到的稀盐酸溶液,用标准氢氧化钠溶液滴定,以确定该稀盐酸的准确物质的量浓度。回答下列问题:
(1)该滴定实验盛装标准液的仪器是__________ , 若该仪器的量程为50mL,调液面为0,将该仪器中所有液体放出,则放出的溶液体积_______ 50mL。(填“>”,“=”,“<”)
(2)若该滴定实验用酚酞做指示剂,达到滴定终点时,溶液颜色从____ 色变为____ 色且保持30s内不变色。
(3)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第______ 种。
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(4)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
求测得的稀盐酸的物质的量浓度为_________________________ 。
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________ 。
(2)判断滴定终点的方法是______ 。
(3)计算:血液中含钙离子的浓度为____ g·mL-1。
(1)该滴定实验盛装标准液的仪器是
(2)若该滴定实验用酚酞做指示剂,达到滴定终点时,溶液颜色从
(3)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(4)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
| 实验编号 | 待测盐酸的体积(mL) | 滴入氢氧化钠溶液的体积(mL) |
| 1 | 20.00 | 17.30 |
| 2 | 20.00 | 17.02 |
| 3 | 20.00 | 16.98 |
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式
(2)判断滴定终点的方法是
(3)计算:血液中含钙离子的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。某草酸亚铁样品(不含结晶水)中含有少量草酸,现用滴定法测定该样品中FeC2O4的含量。实验方案如下:
①将0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol·L-1的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol·L-1的H2SO4溶液,煮沸5~8 min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.020 00 mol·L-1的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 mL。
试回答下列问题:
(1)高锰酸钾标准液用________ 滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为______________________________________________________ 。
(3)滴定过程中眼睛应注视__________________ ,滴定终点现象是 ___________________
(4)在步骤②中,下列操作会引起测定结果偏高的是_____________ 。
a 滴定管在盛装高锰酸钾前未润洗
b 滴定过程中,锥形瓶振荡的太剧烈,以致部分液体溅出
c 滴定前读数正确,滴定终点时俯视读数
d 滴定前尖嘴有气泡,滴定后气泡消失
(5)0.20 g样品中FeC2O4的质量分数为____ 。(保留3位有效数字,不考虑步骤②中的损耗)
①将0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol·L-1的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol·L-1的H2SO4溶液,煮沸5~8 min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.020 00 mol·L-1的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 mL。
试回答下列问题:
(1)高锰酸钾标准液用
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为
(3)滴定过程中眼睛应注视
(4)在步骤②中,下列操作会引起测定结果偏高的是
a 滴定管在盛装高锰酸钾前未润洗
b 滴定过程中,锥形瓶振荡的太剧烈,以致部分液体溅出
c 滴定前读数正确,滴定终点时俯视读数
d 滴定前尖嘴有气泡,滴定后气泡消失
(5)0.20 g样品中FeC2O4的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】实验室有一瓶未知浓度的稀盐酸,某兴趣小组通过滴定法测定其浓度,具体操作如下:
用0.10 mol/L KOH溶液滴定盐酸的浓度,操作可分解为如下几步:
A.移取20.00 mL待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞作指示剂
B.用标准溶液润洗碱式滴定管2~3次
C.排气泡,使碱式滴定管尖嘴充满溶液
D.取KOH标准溶液注入碱式滴定管至0刻度以上2~3 cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下方,用KOH标准溶液滴定至终点,
记下滴定管液面的读数
(1)正确操作的顺序是B→_______→_______→E→_______→______________
a.D C A F b. D C F A c.C D A F
(2)步骤E调节液面后位置如图所示,则此时的读数为_______ mL。
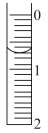
(3)排除碱式滴定管中气泡的方法应采用如图所示操作中的_______ ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
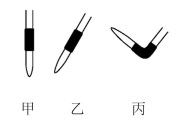
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______ 。
(5)选用酚酞作指示剂,如何判断滴定终点_______ 。
用0.10 mol/L KOH溶液滴定盐酸的浓度,操作可分解为如下几步:
A.移取20.00 mL待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞作指示剂
B.用标准溶液润洗碱式滴定管2~3次
C.排气泡,使碱式滴定管尖嘴充满溶液
D.取KOH标准溶液注入碱式滴定管至0刻度以上2~3 cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下方,用KOH标准溶液滴定至终点,
记下滴定管液面的读数
(1)正确操作的顺序是B→_______→_______→E→_______→_______
a.D C A F b. D C F A c.C D A F
(2)步骤E调节液面后位置如图所示,则此时的读数为

(3)排除碱式滴定管中气泡的方法应采用如图所示操作中的

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______ 。
| A.滴定终点读数时俯视读数 |
| B.酸式滴定管使用前,水洗后未用待测盐酸润洗 |
| C.碱式滴定管尖嘴部分有气泡,滴定后消失 |
| D.锥形瓶水洗后未干燥 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】实验室模拟用工业废弃固体(含有Cu2S、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(FeSO4·7H2O)和明矾[KAl(SO4)2·12H2O]的操作流程如下:
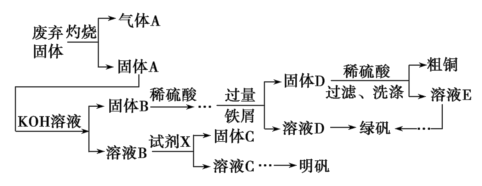
(1)试剂X是________ (写化学式)。
(2)配平下列方程式:_____  +
+_____ SO2+_____ H2O===_____ Mn2++____  +
+____ H+
(3)为了分析产品(绿矾)中铁元素的含量,某同学称取 20.0 g样品配成100 mL溶液,移取25.00 mL于锥形瓶中,用0.100 0 mol·L-1的KMnO4标准溶液进行滴定( 被还原为Mn2+)。
被还原为Mn2+)。
请回答下列问题:
①滴定时,KMnO4标准溶液应盛放在_______ 中(填仪器名称)。
②若到达滴定终点消耗KMnO4标准溶液的体积为25.00 mL,则该产品中铁元素的质量分数为__ 。

(1)试剂X是
(2)配平下列方程式:
 +
+ +
+(3)为了分析产品(绿矾)中铁元素的含量,某同学称取 20.0 g样品配成100 mL溶液,移取25.00 mL于锥形瓶中,用0.100 0 mol·L-1的KMnO4标准溶液进行滴定(
 被还原为Mn2+)。
被还原为Mn2+)。请回答下列问题:
①滴定时,KMnO4标准溶液应盛放在
②若到达滴定终点消耗KMnO4标准溶液的体积为25.00 mL,则该产品中铁元素的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某化学小组用50ml 0.50mol/L NaOH溶液和30ml 0.50mol/L硫酸溶液进行中和热的测定实验。
(1)实验中大约要使用230mL NaOH溶液,配制溶液时至少需要称量NaOH固体__ g。
(2)做中和热的测定实验时:桌上备有大、小两个烧杯、泡沫塑料、硬纸板、胶头滴管、环形玻璃搅拌棒.实验尚缺少的玻璃仪器(用品)是______ 、______ 。
(3)他们记录的实验数据如下:
①请填写表中的空白:
②已知:溶液的比热容c为4.18 J·℃-1·g-1,溶液的密度均为1 g·cm-3。写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式____________ (用该实验的数据,取小数点后一位)。
(4)若用氨水代替NaOH做实验,测定结果ΔH会___ (填“偏大”、“偏小”、“无影响”)。
(1)实验中大约要使用230mL NaOH溶液,配制溶液时至少需要称量NaOH固体
(2)做中和热的测定实验时:桌上备有大、小两个烧杯、泡沫塑料、硬纸板、胶头滴管、环形玻璃搅拌棒.实验尚缺少的玻璃仪器(用品)是
(3)他们记录的实验数据如下:
①请填写表中的空白:
| 实验次数 | 起始温度t1 | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | |
| H2SO4 | NaOH | |||
| 1 | 25.0℃ | 25.0℃ | 29.1 | Δt= |
| 2 | 25.0℃ | 25.0℃ | 29.8 | |
| 3 | 25.0℃ | 25.0℃ | 28.9 | |
| 4 | 25.0℃ | 25.0℃ | 29.0 | |
(4)若用氨水代替NaOH做实验,测定结果ΔH会
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】用 标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
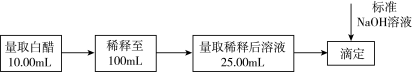

已知:国家标准规定酿造白醋中醋酸含量不得低于 。
。
(1)仪器甲的名称为___________ ,滴定管使用前除用水洗涤外,还应___________ 。
(2)准确量取20.00mL醋酸溶液于锥形瓶中,加入___________ 作指示剂,滴定终点的判断方法为___________ 。
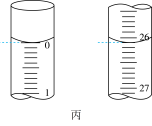
(3)某次实验滴定开始和结束时。碱式滴定管中的液面如图丙所示,则消耗NaOH溶液的体积为___________ mL,由此数值计算出原白醋中醋酸的浓度为_________  (保留两位有效数字)。
(保留两位有效数字)。
(4)下列操作中,可能使所测白醋中醋酸的浓度数值偏高的是___________ (填编号)。
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中摇动锥形瓶时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
(5)室温下,浓度均为 、体积均为
、体积均为 的酸HX、HY溶液,分别加水稀释至体积V,pH随
的酸HX、HY溶液,分别加水稀释至体积V,pH随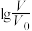 的变化如图所示。
的变化如图所示。

①HX的酸性___________ HY(填“<”、“>”或“=”)。
②a、b、c点对应溶液,水的电离程度由大到小的关系为___________ 。
 标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:


已知:国家标准规定酿造白醋中醋酸含量不得低于
 。
。(1)仪器甲的名称为
(2)准确量取20.00mL醋酸溶液于锥形瓶中,加入
(3)某次实验滴定开始和结束时。碱式滴定管中的液面如图丙所示,则消耗NaOH溶液的体积为
 (保留两位有效数字)。
(保留两位有效数字)。(4)下列操作中,可能使所测白醋中醋酸的浓度数值偏高的是
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中摇动锥形瓶时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
(5)室温下,浓度均为
 、体积均为
、体积均为 的酸HX、HY溶液,分别加水稀释至体积V,pH随
的酸HX、HY溶液,分别加水稀释至体积V,pH随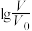 的变化如图所示。
的变化如图所示。
①HX的酸性
②a、b、c点对应溶液,水的电离程度由大到小的关系为
您最近一年使用:0次



