(1)H2S与CO2发生如下反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)△H相关的化学键键能数据如表:
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H—O | H—S |
| E/kJ•mol-1 | 803 | 739 | 577 | 465 | 399 |
(2)高温下CO可将SO2还原成硫蒸气:4CO(g)+2SO2(g)⇌4CO2(g)+S2(g) △H1<0。平衡时CO的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。

T1、T2、T3由大到小的关系是
(3)沥青混凝土可作为反应:2CO(g)+O2(g)
 2CO2(g)的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
①在a、b、c、d四点中,未达到平衡状态的是
②已知c点时容器中O2浓度为0.04mol·L-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=
③下列关于图象的说法正确的是
A.CO转化反应的平衡常数K(a)<K(c)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
相似题推荐
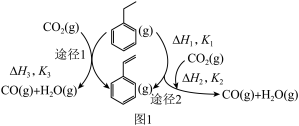

(1)以
 和乙苯为原料合成苯乙烯,其过程如图1,有“一步”途径1和“二步”途径2的两种推测:则CO2(g)+
和乙苯为原料合成苯乙烯,其过程如图1,有“一步”途径1和“二步”途径2的两种推测:则CO2(g)+ (g)
(g)
 (g)+CO(g)+H2O(g)的
(g)+CO(g)+H2O(g)的
 的代数式表达)。
的代数式表达)。(2)向刚性容器中充入
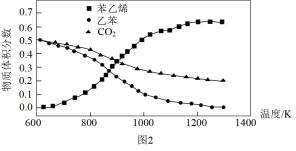
 和
和 乙苯,发生途径1的反应,在不同温度下测得平衡时各物质的体积分数如图2.可知
乙苯,发生途径1的反应,在不同温度下测得平衡时各物质的体积分数如图2.可知
 转化率低于乙苯,推知发生了副反应
转化率低于乙苯,推知发生了副反应 ,由图象知该反应
,由图象知该反应
(3)某研究团队找到乙苯直接脱氢的高效催化剂,反应原理如图:
 (g)
(g) H2(g)+
H2(g)+ (g)
(g)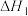
①已知部分化学键键能数据如表所示:则

| 共价键 |  |  |  |  |
键能/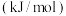 | 347.7 | 413.4 | 615 | 436 |
 的条件下进行。乙苯平衡转化率与温度、投料比
的条件下进行。乙苯平衡转化率与温度、投料比 的关系如图3.则投料比
的关系如图3.则投料比 由大到小的关系为
由大到小的关系为③若
 ,则
,则 点温度下,该反应的平衡常数
点温度下,该反应的平衡常数
 点对应的乙苯的平衡转化率
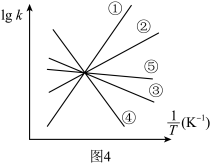
点对应的乙苯的平衡转化率(4)实验测得,乙苯脱氢的速率方程为
 ,
, (
( 为关系的是速率常数,只与温度有关),图4中③代表
为关系的是速率常数,只与温度有关),图4中③代表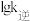 随
随 的变化关系,则能代表
的变化关系,则能代表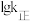 随
随 的变化关系的是
的变化关系的是Ⅰ.CO2加氢可以合成甲醇,该过程主要发生如下反应:
反应①:CO2(g)+H2(g)
 CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1反应②:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2=-41.1kJ•mol-1
CH3OH(g)+H2O(g) △H2=-41.1kJ•mol-1反应③:CO(g)+2H2(g)
 CH3OH(g) △H3
CH3OH(g) △H3(1)反应②的活化能Ea(正)
| 化学键 | H-H | C≡O | O-H | C=O |
| 键能/(kJ•mol-1) | 436 | 1071 | 464 | 803 |
Ⅱ.清洁能源的开发利用是实现“碳中和”的途径,乙醇—水催化重整可获得H2。其主要反应为:
反应①:C2H5OH(g)+3H2O=2CO2(g)+6H2(g) △H=+173.3kJ•mol-1
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.2kJ•mol-1
在1.0×105Pa、n始(C2H5OH):n始(H2O)=1:3时,若仅考虑上述反应,平衡时CO2和CO的生成选择性及H2的产率随温度的变化如图所示。CO的选择性=
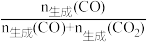 ×100%
×100%
(3)图中表示平衡时CO2的选择性及H2的产率随温度的变化的曲线分别是曲线
(4)光催化甲烷重整技术也是研究热点。以Rh/SrTiO3为光催化剂,光照时,价带失去电子并产生空穴(h+,具有强氧化性),CO2在导带获得电子生成CO和O2-,价带上CH4直接转化为CO和H2,反应机理如图所示:

当价带产生1mol空穴(h+)时,在Rh表面生成的CO数目为
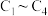 小分子化合物的研究产生了很多有实际意义的应用。
小分子化合物的研究产生了很多有实际意义的应用。(1)
 氯代反应可以得到
氯代反应可以得到 、
、 ……氯代甲烷,反应的机理为自由基(带有单电子的原子或原子团,如
……氯代甲烷,反应的机理为自由基(带有单电子的原子或原子团,如 、
、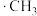 )反应,步骤如下:
)反应,步骤如下:| I.链引发 | II.链传递 | III.链终止 |
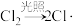 | 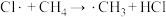 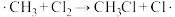 …… |   |
 生成
生成 过程中链传递的方程式为:
过程中链传递的方程式为: 、
、②不同卤原子自由基(X·)均可夺取
 中的H,反应通式:
中的H,反应通式: ,
, 。已知:25℃,101kPa时,
。已知:25℃,101kPa时, 中C—H和HCl中H—Cl的键能分别是
中C—H和HCl中H—Cl的键能分别是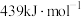 和
和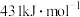 。
。A.当X为Cl时,

 。
。B.若X依次为F、Cl、Br、I,则
 随着原子序数增大逐渐
随着原子序数增大逐渐③实验证实,若先将
 光照,然后迅速在黑暗中与
光照,然后迅速在黑暗中与 混合,可得到氯代甲烷;但先将
混合,可得到氯代甲烷;但先将 光照,然后迅速在黑暗中与
光照,然后迅速在黑暗中与 混合,则几乎无反应。可见光照
混合,则几乎无反应。可见光照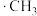 。
。(2)一定条件下,
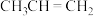 与HCl发生反应有①、②两种可能,反应进程中的能量变化如图所示。反应①、②中速率较快的是
与HCl发生反应有①、②两种可能,反应进程中的能量变化如图所示。反应①、②中速率较快的是 的比例,可采用的措施是
的比例,可采用的措施是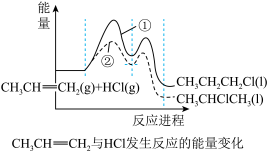
A.适当提高反应温度 B.适当调换催化剂
C.适当降低反应温度 D.适当改变反应物浓度
(3)甲烷部分催化氧化制备乙炔是目前研究的热点之一、反应原理为:
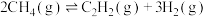 。一定温度下,将
。一定温度下,将 充入10L的固定容积容器中发生上述反应,实验测得反应前容器内压强为
充入10L的固定容积容器中发生上述反应,实验测得反应前容器内压强为 ,容器内各气体分压与时间的关系如图所示。反应的平衡常数
,容器内各气体分压与时间的关系如图所示。反应的平衡常数
Fe2+
 Fe3+
Fe3+
 (高铁酸根离子)
(高铁酸根离子)回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净。可选用的试剂是
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。
则下列说法正确的是
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1mol电子时,有46 g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2:1,试配平下列方程式:

 FeSO4+
FeSO4+ K2O2
K2O2
 K2FeO4+
K2FeO4+ K2O+
K2O+ K2SO4+
K2SO4+ O2↑
O2↑(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是
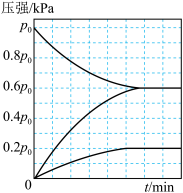
Ⅱ.在100℃时,将0.100 mol的四氧化二氮气体充入1 L恒容抽真空的密闭容器中,发生反应:N2O4
 2NO2,隔一定时间对该容器内的物质浓度进行分析得到下表数据:
2NO2,隔一定时间对该容器内的物质浓度进行分析得到下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol/L | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol/L | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(6)在下图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线

(7)在上述条件下,从反应开始至达到化学平衡时,N2O4的平均反应速率为
(8)达平衡后下列条件的改变可使NO2气体浓度增大的是
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
(9)若起始时充入NO2气体0.080 mol,则达到平衡时NO2气体的转化率为
 的制备方法较多,例如:一是单质铁与有关气体氧化剂[如
的制备方法较多,例如:一是单质铁与有关气体氧化剂[如 、
、 、
、 等]反应;二是利用溶液之间的反应,如铁酸盐与亚铁酸盐的作用或铁盐与亚铁盐在强碱性条件下的作用;三是水热法制备
等]反应;二是利用溶液之间的反应,如铁酸盐与亚铁酸盐的作用或铁盐与亚铁盐在强碱性条件下的作用;三是水热法制备 (纳米颗粒),反应为
(纳米颗粒),反应为 ;四是某一种工业上制取
;四是某一种工业上制取 (见如下流程)等等:
(见如下流程)等等: 纳米四氧化三铁。试分析并回答:
纳米四氧化三铁。试分析并回答:(1)单质铁与
 在一定条件下反应,生成
在一定条件下反应,生成 与
与 (2)铁酸盐与亚铁酸盐反应后,其溶液酸碱性测定的简便方法:用洁净玻璃棒
(3)水热法制备
 的反应中,常采用
的反应中,常采用  (纳米颗粒),不能用减压过滤实现固液分离,其理由是
(纳米颗粒),不能用减压过滤实现固液分离,其理由是 (4)上述工业制法中①氯化铁转化为铁黄
 后①环丙胺的作用,可用离子方程式表示为
后①环丙胺的作用,可用离子方程式表示为 (5)①人教版教材(化学必修
 )中,有关铁与水蒸气反应实验的主要步骤如下,按规范组装完仪器后其正确操作的顺序是
)中,有关铁与水蒸气反应实验的主要步骤如下,按规范组装完仪器后其正确操作的顺序是 A.将酒精灯固定在铁粉部位加热
B.在湿棉花部位加热(使水汽化)
C.导管插入肥皂液中,用火柴点燃肥皂泡(气体先试纯)
D.先从肥皂液中撤出导管,再移去酒精灯后盖灭
②该实验关键点主要是
 温度控制,
温度控制, 铁粉纯度(不被氧化)
铁粉纯度(不被氧化) 安全点燃,
安全点燃, 肥皂液不宜太稀,
肥皂液不宜太稀, .
. (1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在200℃和10MPa的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和CH3OH的燃烧热分别784kJ/mol和628kJ/mol则2CH4(g)+O2(g)=2CH3OH(g) △H=
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)⇌CH3OCH3(g) +H2O(g) △H<0。
①某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是

A.P3>P2,T3>T2
B.P1>P3,T1>T3
C.P1>P4,T2>T3
D.P2>P4,T4>T2
②在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是
A.氢气的转化率减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
 2CO2(g) +N2(g)
2CO2(g) +N2(g)①200K、pPa时,在一个容积为2L的恒温密闭容器中充入1.5molNO和2.0molCO,开始反应至2min时测得CO转化率为30%,则用N2表示的平均反应速率为υ(N2)=
②该反应在低温下能自发进行,该反应的ΔH
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2)则下列说法不正确的是

A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:t1~t2 > t2~t3
 SO2Cl2(g)△H针对该反应回答下列问题:
SO2Cl2(g)△H针对该反应回答下列问题:(1)已知:①SO2(g)+Cl2(g)+SCl2(g)
 2SOCl2(g)△H1=﹣akJ•mol﹣1
2SOCl2(g)△H1=﹣akJ•mol﹣1②SO2Cl2+SCl2(g)=2SOCl2(g)△H2=﹣bkJ•mol﹣1
③a>b>0则△H=
(2)为了提高该反应中Cl2的平衡转化率,下列措施合理的是
a.缩小容器体积 b.使用催化剂 c.增加SO2浓度 d.升高温度
(3)若在绝热、恒容的密闭体系中,投入一定量SO2和Cl2,发生该反应,下列示意图能说明t1时刻反应达到平衡状态的是

(4)若在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P.起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L.
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示.则υ(SO2)=
②此温度下,该反应的K=
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是
(5)该反应的产物SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式
 C2H4(g)+4H2O(g) ΔH。
C2H4(g)+4H2O(g) ΔH。已知:①C2H4(g)+3O2(g)=2CO2(g)+2H2 ΔH1=a kJ/mol;
②2H2(g)+O2(g)=2H2O(1)ΔH2=bkJ/mol;
③H2O(1)=H2O(g) ΔH3=c kJ/mol;
请回答:
(1)ΔH=
(2)在催化剂[Fe3(CO)12/ZSM-5]、空速1200 h-1 条件下,温度、压强、氢碳比[n(H2)/n(CO2)=x]对CO2平衡转化率及温度对催化效率影响如图1所示。
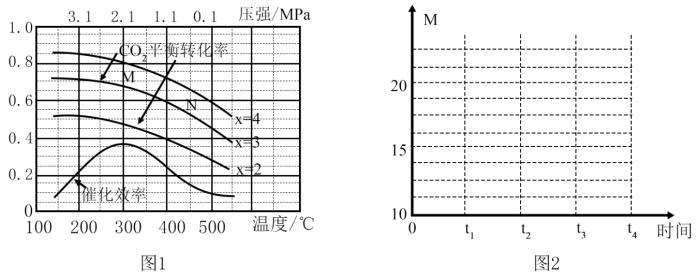
①下列有关说法正确的是
A.ΔH>0
B.增大氢碳比,可以提高CO2的平衡转化率
C.温度低于300℃时,随温度升高乙烯的产率增大
D.平衡常数:K(M)>K(N)
E.为提高CO2的平衡转化率,工业生产中应在尽可能低的温度下合成乙烯
②M点时,CO2的平衡转化率为2/3,则此时平衡体系中乙烯的体积分数为
③工业生产中压强一般控制在2.1~2.6 MPa之间,理由是
(3)恒温(300℃),在体积为1L的恒容容器中以n(H2)/n(CO2)=3的投料比加入反应物,至t1时达到平衡。t2时将容器体积瞬间扩大至2 L并保持不变,t3时重新达平衡。在图2中绘制0~t4时间段内,容器内混合气体的平均相对分子质量(M)随时间(t)变化的图象。
(1)机动车尾气随意排放会造成CO、NO对大气的污染,尾气中CO、NO的含量是机动车年检的重要指标之一、已知热化学方程式如下:
I.2CO(g) +O2(g)= 2CO2(g) ΔH1= -556.0kJ·mol-1;
Ⅱ.N2(g) +O2(g)= 2NO(g) ΔH2= +180.5 kJ·mol-1 ;
Ⅲ.2NO(g) +2CO(g)=N2(g) +2CO2(g) ΔH3 。
①ΔH3 =
②在某容积为2.00L的密闭容器中按照
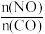 =1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
=1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图: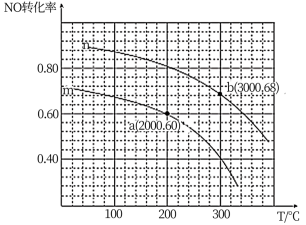
曲线n所代表的压强
(2)在容积为1.00 L的密闭容器中,充入4 mol H2和1 mol CO2,发生下列可逆反应:CO2(g) +4H2(g)
 CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:
CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:| T/℃ | 100 | 150 | 200 | 250 | 300 | 350 |
| 转化率/% | 0.64 | 0.58 | 0.53 | 0.50 | 0.48 | 0.47 |
①N2(g)+O2(g)=2NO(g) △H1= +180.5 kJ•mol-1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H2=-905 kJ•mol-1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6 kJ•mol-1
请写出N2和H2在高温、高压、催化剂条件下生成NH3的热化学方程式
(2)在一定温度下,某恒容密闭容器中,发生反应:2X(g)+Y(g)
 2Z(g) △H<0,各物质的浓度随时间变化如图所示。
2Z(g) △H<0,各物质的浓度随时间变化如图所示。
①从反应开始到4min时平衡,Y的平均反应速率为
②根据图中数据,4min时的平衡常数K=
③若使重新平衡时体系中c(X)=c(Z),则改变的条件为
④若某时刻,V正(Y)=2V逆(Z),则反应
⑤图中a、b点对应的正反应速率大小关系为Va
【推荐2】甲醇是一种可再生能源,具有开发和应用的广阔前景,用Pt/Al2O3、Pd/C、Rh/SiO2作催化剂都可以采用如下反应来合成甲醇:2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
(1)下表所列数据是各化学键的键能:
化学键 | H-H | C=O | C-H | C-O | O-H |
键能/(kJ●mol-1) | a | b | c | d | e |
则反应2H2(g)+CO(g) CH3OH(g)的△H=
CH3OH(g)的△H=
(2)三种不同催化剂作用时,CO的转化率如图1所示,则最适合作催化剂的是

(3)某化学研究性学习小组模拟工业合成甲醇的反应,在2 L的恒容密闭容器内充入2 mol H2和1molCO,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20 min时,CO的平均反应速率为
(4)近日,美国Neah和Novellusnn公司宣布,两家公司合作开发了多孔硅甲醇直接燃料电池,其工作原理如图所示。

①石墨2为
②石墨1极发生的电极反应式为
【推荐3】利用Ag作催化剂可实现乙烯高选择性制备环氧乙烷( ),涉及反应如下:
),涉及反应如下:
主反应: (
( )
)



(1)已知
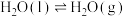
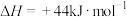 ,(
,( )
)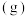 的燃烧焓为
的燃烧焓为 ,则
,则
(2)一定条件下,向1L密闭容器中通入
 和
和 ,平衡时
,平衡时 的选择性[n(
的选择性[n( )/n(参加反应的CH2=CH2)]为0.6,乙烯的平衡转化率为0.6,则该温度下主反应的平衡常数K=
)/n(参加反应的CH2=CH2)]为0.6,乙烯的平衡转化率为0.6,则该温度下主反应的平衡常数K= 平衡产率的措施有
平衡产率的措施有(3)以上过程反应机理如下:
反应Ⅰ:
 慢
慢反应Ⅱ: (
( )
)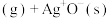 快
快
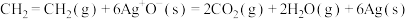 快
快一定能够提高主反应反应速率的措施有___________(填标号)。
| A.升高温度 | B.通入惰性气体 |
C.增大 浓度 浓度 | D.增大 浓度 浓度 |
(4)加入1,2-二氯乙烷会发生
 。一定条件下,反应经过一定时间后,
。一定条件下,反应经过一定时间后, 产率及选择性与1,2-二氯乙烷浓度关系如图。
产率及选择性与1,2-二氯乙烷浓度关系如图。
1,2-二氯乙烷能使 产量先增加后降低的原因是
产量先增加后降低的原因是
 ,
,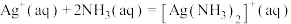

①
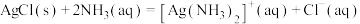

②1L氨水中至少含有
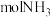 才能回收1molAgCl。
才能回收1molAgCl。



