金属镍及其化合物在合金材料以及催化剂等方面应用广泛。回答下列问题:
(1)镍元素在周期表中的位置为___________ ,基态镍原子未成对电子数为___________ 。
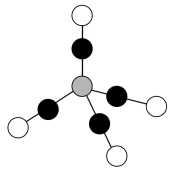
(2)区分晶体和非晶体最可靠的科学方法为___________ ;配合物Ni(CO)4熔点−19.3℃,沸点42.1℃,难溶于水,易溶于有机溶剂,结构见下图,则固态Ni(CO)4属于___________ 晶体,1mol Ni(CO)4含有___________ mol配位键。
(3)NiO的晶体结构类型与NaCl相似,离子半径如下表所示:NiO晶胞中Ni2+的配位数为____ ,NiO的熔点比NaCl高的原因是______ 。
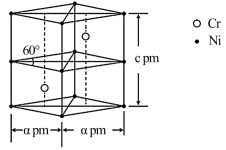
(4)某铬镍合金晶胞如图所示,Cr、Ni原子个数比为__ ,该晶胞中Cr、Ni原子最近距离为__ pm(用含a、c的代数式表示)。
(1)镍元素在周期表中的位置为
(2)区分晶体和非晶体最可靠的科学方法为

(3)NiO的晶体结构类型与NaCl相似,离子半径如下表所示:NiO晶胞中Ni2+的配位数为
| Na+ | 102pm | Cl- | 181pm |
| Ni2+ | 69pm | O2− | 140pm |

21-22高二上·广东东莞·期末 查看更多[2]
更新时间:2022-01-20 19:36:21
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】已知A、B、C、D、E、F是前四周期的核电荷数依次增大主族元素,A的最外层电子数是其电子层数的2倍,C、D同一主族,D元素原子M层有两对成对电子,E在前四周期主族元素中原子半径最大,F的基态原子中有4个未成对电子。
(1)基态Fe2+的电子排布式是_____ 。
(2)B、C、D的第一电离能由大到小的顺序是_____ 。(填字母对应的元素符号)
(3)BC 离子的空间构型为
离子的空间构型为_____ 。
(4)某F的配合物化学式是[F(H2O)5Cl]Cl2·H2O,与中心F3+的形成配位键的原子或离子是_____ 。
(5)F(AC)5常温下是一种浅黄色液体,熔点-20℃,不溶于水、易溶于苯。
每个AC分子与F原子间均有1个配位键。
①1 mol F(AC)5中所含σ键的数目为_____ 。
②F(AC)5分子的结构可能为下图中的_____ (填“甲”或“乙”)
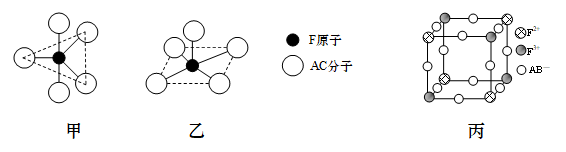
(6)由A、B、E、F元素形成的一种蓝色晶体,其晶体结构示意图如图丙所示(图中E的离子未画出)。该蓝色晶体的化学式为_____ 。
(1)基态Fe2+的电子排布式是
(2)B、C、D的第一电离能由大到小的顺序是
(3)BC
 离子的空间构型为
离子的空间构型为(4)某F的配合物化学式是[F(H2O)5Cl]Cl2·H2O,与中心F3+的形成配位键的原子或离子是
(5)F(AC)5常温下是一种浅黄色液体,熔点-20℃,不溶于水、易溶于苯。
每个AC分子与F原子间均有1个配位键。
①1 mol F(AC)5中所含σ键的数目为
②F(AC)5分子的结构可能为下图中的

(6)由A、B、E、F元素形成的一种蓝色晶体,其晶体结构示意图如图丙所示(图中E的离子未画出)。该蓝色晶体的化学式为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐2】碳是形成单质和化合物种类最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)碳有多种单质,其中石墨烯与金刚石的晶体结构如图1、图2所示。
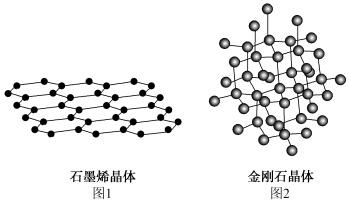
①石墨烯是石墨分离出的单独一层,石墨烯非常稳定,属于厚度只有一个直径大小的“二维材料”,写出一个石墨烯所拥有的特性_____ 。
②求出12g金刚石中含σ键数目为_____ 。
(2)碳的主要氧化物有CO,能与金属Fe形成一种浅黄色液体Fe(CO)5,Fe(CO)5是配合物其熔点为−20℃,沸点为103℃,热稳定性较高,易溶于苯等有机溶剂,不溶于水。据此判断:
①该化合物的晶体中涉及的作用力有_____ 。
A.离子键 B.极性键 C.非极性键 D.范德华力 E.配位键
②算出1molFe(CO)5配合物中含有σ键数目_____ 。
(3)CH 是重要的有机反应中间体,其空间构型为
是重要的有机反应中间体,其空间构型为______ 。
(4)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图3所示。配位体中碳原子的杂化方式有______ 。
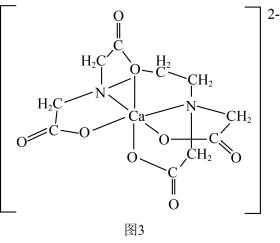
(1)碳有多种单质,其中石墨烯与金刚石的晶体结构如图1、图2所示。

①石墨烯是石墨分离出的单独一层,石墨烯非常稳定,属于厚度只有一个直径大小的“二维材料”,写出一个石墨烯所拥有的特性
②求出12g金刚石中含σ键数目为
(2)碳的主要氧化物有CO,能与金属Fe形成一种浅黄色液体Fe(CO)5,Fe(CO)5是配合物其熔点为−20℃,沸点为103℃,热稳定性较高,易溶于苯等有机溶剂,不溶于水。据此判断:
①该化合物的晶体中涉及的作用力有
A.离子键 B.极性键 C.非极性键 D.范德华力 E.配位键
②算出1molFe(CO)5配合物中含有σ键数目
(3)CH
 是重要的有机反应中间体,其空间构型为
是重要的有机反应中间体,其空间构型为(4)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图3所示。配位体中碳原子的杂化方式有

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】Fe、Co、Ni是几种重要的金属元素。请回答下列问题。
(1)基态Co原子的价电子轨道表示式为___________ 。
(2)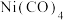 常温下为无色液体,沸点为42.1℃,熔点为-19.3℃,难溶于水,易溶于有机溶剂。推测
常温下为无色液体,沸点为42.1℃,熔点为-19.3℃,难溶于水,易溶于有机溶剂。推测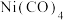 是
是___________ 分子(填“极性”或“非极性”)。
(3)实验室常用KSCN溶液或苯酚(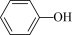 )检验
)检验 。第一电离能:N
。第一电离能:N___________ O(填“>”或“<”),KSCN的配位原子有___________ 。苯酚中碳原子和氧原子的杂化类型分别为___________ ;___________ 。
(4)配位化合物 中心原子Co的配位数为
中心原子Co的配位数为___________ ,配体为___________ 。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,S原子的配位数是___________ ,其晶胞边长为540.0pm,密度为___________ (列式并计算)。Zn:65 S:32
(1)基态Co原子的价电子轨道表示式为
(2)
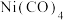 常温下为无色液体,沸点为42.1℃,熔点为-19.3℃,难溶于水,易溶于有机溶剂。推测
常温下为无色液体,沸点为42.1℃,熔点为-19.3℃,难溶于水,易溶于有机溶剂。推测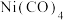 是
是(3)实验室常用KSCN溶液或苯酚(
 )检验
)检验 。第一电离能:N
。第一电离能:N(4)配位化合物
 中心原子Co的配位数为
中心原子Co的配位数为(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,S原子的配位数是
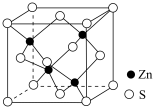
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐1】一种电合成技术可以将 转化为甲酸盐,为减少
转化为甲酸盐,为减少 排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。研究表明,许多金属如Pb、In、Bi、Cd和Sn,都可催化
排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。研究表明,许多金属如Pb、In、Bi、Cd和Sn,都可催化 转化为甲酸盐的反应。回答下列问题:
转化为甲酸盐的反应。回答下列问题:
(1)Sn位于元素周期表中第五周期第IVA族,基态Sn原子的d轨道与p轨道上的电子数之比为_______ 。
(2)比较键能:C−H_______ Si−H(填“>”“<”或“=”)。
(3) 晶体的熔点高于干冰的原因是
晶体的熔点高于干冰的原因是_______ 。
(4) 分子的空间结构为
分子的空间结构为_______ 。
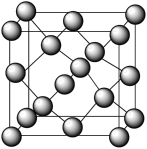
(5)Sn有三种同素异形体,其中灰锡是金刚石型立方晶体,如图所示。在灰锡中Sn原子的配位数是_______ ,Sn原子围成的最小环上有_______ 个Sn原子。已知灰锡中Sn原子之间的最小距离为d pm,则灰锡的密度为_______  。(写出计算式即可,不用化简)。
。(写出计算式即可,不用化简)。
 转化为甲酸盐,为减少
转化为甲酸盐,为减少 排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。研究表明,许多金属如Pb、In、Bi、Cd和Sn,都可催化
排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。研究表明,许多金属如Pb、In、Bi、Cd和Sn,都可催化 转化为甲酸盐的反应。回答下列问题:
转化为甲酸盐的反应。回答下列问题:(1)Sn位于元素周期表中第五周期第IVA族,基态Sn原子的d轨道与p轨道上的电子数之比为
(2)比较键能:C−H
(3)
 晶体的熔点高于干冰的原因是
晶体的熔点高于干冰的原因是(4)
 分子的空间结构为
分子的空间结构为(5)Sn有三种同素异形体,其中灰锡是金刚石型立方晶体,如图所示。在灰锡中Sn原子的配位数是
 。(写出计算式即可,不用化简)。
。(写出计算式即可,不用化简)。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐2】钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为_______ 。
(2)Ti的四卤化物熔点如下表所示:
TiF4熔点高于其他三种卤化物,写出TiF4的电子式_______ ;TiCl4至TiI4熔点依次升高,其原因是_______ 。
(3)CaTiO3的晶胞如图(a)所示,金属离子与氧离子间的作用力为_______ 。
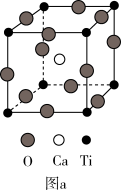
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为anm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图b所示。K与O间的最短距离为_______ nm(用含a的代数式表示),与K紧邻的O个数为_______ 。
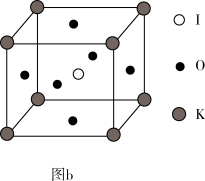
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则O处于_______ 位置,K处于_______ 位置。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如下表所示:
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
TiF4熔点高于其他三种卤化物,写出TiF4的电子式
(3)CaTiO3的晶胞如图(a)所示,金属离子与氧离子间的作用力为

(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为anm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图b所示。K与O间的最短距离为

(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则O处于
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐3】铁及其化合物在生活中有广泛应用。
(1)Fe3+基态价电子排布式为_______ 。
(2)实验室用KSCN溶液、苯酚检验Fe3+。
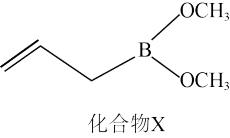
①1mol化合物X分子(结构如图)中含有σ键的数目为_______ 。
②类卤素离子SCN-可用于Fe2+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_______ 。
(3)氮化铁晶体的晶胞结构如图1所示。该晶体化合物的化学式为_______ 。

图1
(4)某铁的化合物结构简式如图2所示。
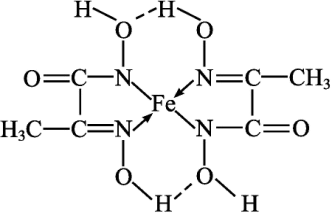
图2
①上述化合物中所含有的非金属元素的电负性由小到大的顺序为_______ (用元素符号表示)。
②上述化合物中碳原子的杂化方式为_______ 。
(1)Fe3+基态价电子排布式为
(2)实验室用KSCN溶液、苯酚检验Fe3+。
①1mol化合物X分子(结构如图)中含有σ键的数目为

②类卤素离子SCN-可用于Fe2+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是
(3)氮化铁晶体的晶胞结构如图1所示。该晶体化合物的化学式为

图1
(4)某铁的化合物结构简式如图2所示。

图2
①上述化合物中所含有的非金属元素的电负性由小到大的顺序为
②上述化合物中碳原子的杂化方式为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】硅因为具有半导体的性质被认为是一种比较特殊的非金属元素,它的单质是硬度较大的非金属单质。铬单质为钢灰色金属,是自然界硬度最大的金属。
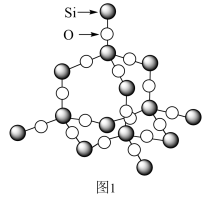
(1)若铬的一种同位素原子核内有28个中子,试写出该同位素原子的原子符号,写出基态铬原子的核外电子排布_______ 。
(2)与硅同周期的金属第一电离能由大到小排列:_______ 。与硅同周期的非金属电负性由小到大排列:_______ 。
(3)图2为二氧化硅的晶胞示意图,由图可知,二氧化硅是_______ (选填“原子晶体”、“分子晶体”或“离子晶体”,下同)。与硅同主族的元素碳的氧化物干冰是_______ 。1mol二氧化硅晶体所含有的σ键个数为_______ 。1mol的乙炔含有π键的个数为_______ 。
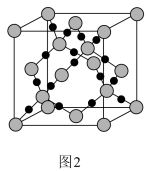
(4)已知二氧化硅的晶胞参数为anm,计算SiO2的密度_______ g/cm3。(列出计算式)

(1)若铬的一种同位素原子核内有28个中子,试写出该同位素原子的原子符号,写出基态铬原子的核外电子排布
(2)与硅同周期的金属第一电离能由大到小排列:
(3)图2为二氧化硅的晶胞示意图,由图可知,二氧化硅是

(4)已知二氧化硅的晶胞参数为anm,计算SiO2的密度
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐2】(1)在下列物质中___________ 是晶体,___________ 是非晶体。
①塑料 ②明矾 ③松香 ④玻璃⑤CuSO4·5H2O ⑥冰糖 ⑦糖果 ⑧单晶硅 ⑨铝块 ⑩橡胶
(2)晶体和非晶体在外形上有差别,晶体都具有___________ ,而非晶体___________ ;另外非晶体的多种物理性质,在各个方向都是___________ 的,而晶体的多种物理性质在各个方向都是___________ 的。
(3)判断物质是晶体还是非晶体,比较正确的方法是___________ 。
①从外形上来判断
②从各向异性或各向同性上来判断
③从导电性能来判断
④从有无固定熔点来判断
①塑料 ②明矾 ③松香 ④玻璃⑤CuSO4·5H2O ⑥冰糖 ⑦糖果 ⑧单晶硅 ⑨铝块 ⑩橡胶
(2)晶体和非晶体在外形上有差别,晶体都具有
(3)判断物质是晶体还是非晶体,比较正确的方法是
①从外形上来判断
②从各向异性或各向同性上来判断
③从导电性能来判断
④从有无固定熔点来判断
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】下图中A~D是中学化学教科书中常见的几种晶体结构模型:
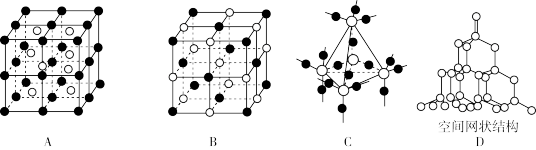
(1)请填写相应物质的名称:A___________ ;B.___________ ;C.___________ ;D.___________ 。
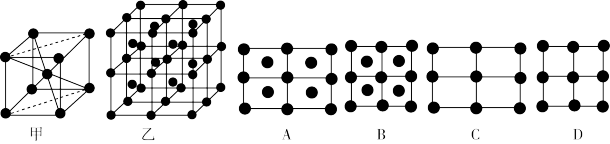
(2)铜元素位于元素周期表___________ 区。单质铜及镍都是由___________ 键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959 kJ∙mol−1,INi=1753 kJ∙mol−1,ICu>INi的原因是___________ 。
(3)单质铁的一种晶体如图甲、乙所示,若按甲虚线方向切乙得到的截面图是___________ (填字母序号)。

(1)请填写相应物质的名称:A
(2)铜元素位于元素周期表
(3)单质铁的一种晶体如图甲、乙所示,若按甲虚线方向切乙得到的截面图是

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】元素A、B、C、D、E、F、G在元素周期表中的位置如图所示,回答下列问题:
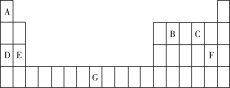
(1)G的基态原子价层电子排布式为_______ 。原子的第一电离能:D_____ E(填“>”或“<”)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l—l>l—b>b—b(l为孤对电子对,b为键合电子对),则关于A2C中的A—C—A键角可得出的结论是________。
(3)化合物G(BC)5的熔点为-20℃,沸点为103℃,其固体属于_______ 晶体,该物质中存在的化学键类型有_________ 。
(4)化合物BCF2的立体构型为________ ,其中B原子的杂化轨道类型是________ 。
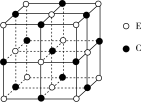
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。则EC晶体的密度(g·cm-3)_______ 。(写出表达式)


(1)G的基态原子价层电子排布式为
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l—l>l—b>b—b(l为孤对电子对,b为键合电子对),则关于A2C中的A—C—A键角可得出的结论是________。
| A.180° | B.接近120°,但小于120° |
| C.接近120°,但大于120° | D.接近109°28’,但小于109°28’ |
(4)化合物BCF2的立体构型为
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。则EC晶体的密度(g·cm-3)
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】镓(Ga)是一种重要的金属,镓的化合物广泛应用于半导体、太阳能、液态合金、医疗化工等诸多领域,被称为电子工业的“脊梁”。
(1)基态Ga原子的价层电子的轨道表示式是___________________ 。
(2) 在270°C左右以二聚体
在270°C左右以二聚体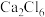 存在,结构式如图。
存在,结构式如图。
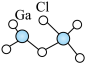
① 可以形成二聚体的原因是
可以形成二聚体的原因是__________________________ 。
② 和
和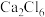 中Ga原子采用的杂化方式分别是
中Ga原子采用的杂化方式分别是_________________ 。
③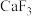 的熔点为1000℃,
的熔点为1000℃, 的熔点为77.9℃,
的熔点为77.9℃,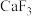 的熔点远远高于
的熔点远远高于 的熔点,从结构角度解释原因
的熔点,从结构角度解释原因_____ 。
(3) 可与
可与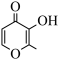 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga( )3。甲基麦芽酚的分子式是
)3。甲基麦芽酚的分子式是______________ ,甲基麦芽酚中,与 形成配位键的原子是
形成配位键的原子是________ 。
(1)基态Ga原子的价层电子的轨道表示式是
(2)
 在270°C左右以二聚体
在270°C左右以二聚体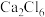 存在,结构式如图。
存在,结构式如图。
①
 可以形成二聚体的原因是
可以形成二聚体的原因是②
 和
和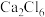 中Ga原子采用的杂化方式分别是
中Ga原子采用的杂化方式分别是③
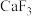 的熔点为1000℃,
的熔点为1000℃, 的熔点为77.9℃,
的熔点为77.9℃,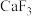 的熔点远远高于
的熔点远远高于 的熔点,从结构角度解释原因
的熔点,从结构角度解释原因(3)
 可与
可与 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga( )3。甲基麦芽酚的分子式是
)3。甲基麦芽酚的分子式是 形成配位键的原子是
形成配位键的原子是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐3】硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。某些硅酸盐具有筛选分子的功能,一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期。两元素原子的质子数之和为24。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为_______ ;写出M原子核外能量最高的电子的电子排布式为_______ ;
(2)常温下,不能与R单质发生反应的是_______ (选填序号);
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.Na2CO3溶液
(3)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式_______ 。
(4) 氮化硅(Si3N4)陶瓷材料硬度大、熔点高。Si3N4晶体中只有极性共价键,则氮原子的化合价为_______ 。
(5)C3N4的结构与Si3N4相似。请比较二者熔点高低并说明理由:_______ 。
(6)可由下列反应制得Si3N4,配平该反应并标出电子转移的数目和方向:_______ 。
_______SiO2+_______C+_______N2 _______Si3N4+_______CO
_______Si3N4+_______CO
(7)如果上述反应在10L的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L,则制得的Si3N4质量为_______ 。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为
(2)常温下,不能与R单质发生反应的是
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.Na2CO3溶液
(3)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式
(4) 氮化硅(Si3N4)陶瓷材料硬度大、熔点高。Si3N4晶体中只有极性共价键,则氮原子的化合价为
(5)C3N4的结构与Si3N4相似。请比较二者熔点高低并说明理由:
(6)可由下列反应制得Si3N4,配平该反应并标出电子转移的数目和方向:
_______SiO2+_______C+_______N2
 _______Si3N4+_______CO
_______Si3N4+_______CO(7)如果上述反应在10L的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L,则制得的Si3N4质量为
您最近一年使用:0次



