将浓度均为0.01mol/L的 、
、 、KI、
、KI、 溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。资料:该“碘钟实验”的总反应为
溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。资料:该“碘钟实验”的总反应为 。反应分两步进行,反应A为
。反应分两步进行,反应A为 ,反应B为……
,反应B为……
(1)反应B的离子方程式是___________ 。对于总反应,I-的作用相当于___________ 。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的 溶液中加入KI溶液和试剂X,溶液变为蓝色。
溶液中加入KI溶液和试剂X,溶液变为蓝色。
b.再向得到的蓝色溶液中加入 溶液,溶液的蓝色褪去。
溶液,溶液的蓝色褪去。
试剂X是___________ 。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ.(溶液浓度均为0.01mol/L)
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30min,实验Ⅲ是40min。
①实验Ⅲ中,x、y、z所对应的数值分别是___________ 。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是___________ 。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。(溶液浓度均为0.01mol/L)
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:___________ 。
 、
、 、KI、
、KI、 溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。资料:该“碘钟实验”的总反应为
溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。资料:该“碘钟实验”的总反应为 。反应分两步进行,反应A为
。反应分两步进行,反应A为 ,反应B为……
,反应B为……(1)反应B的离子方程式是
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的
 溶液中加入KI溶液和试剂X,溶液变为蓝色。
溶液中加入KI溶液和试剂X,溶液变为蓝色。b.再向得到的蓝色溶液中加入
 溶液,溶液的蓝色褪去。
溶液,溶液的蓝色褪去。试剂X是
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ.(溶液浓度均为0.01mol/L)
| 用量/mL 实验序号 |  溶液 溶液 |  溶液 溶液 |  溶液 溶液 | KI溶液(含淀粉) |  |
| 实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
| 实验Ⅲ | 5 | 2 | x | y | z |
①实验Ⅲ中,x、y、z所对应的数值分别是
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。(溶液浓度均为0.01mol/L)
| 用量/mL 实验序号 |  溶液 溶液 |  溶液 溶液 |  溶液 溶液 | KI溶液(含淀粉) |  |
| 实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:
18-19高一下·北京西城·期末 查看更多[20]
北京市第十四中学2022-2023学年高一下学期期中化学试题河南省驻马店市2022-2023学年高一下学期4月期中考试化学试题重庆文理学院附属中学校2022-2023学年高二上学期第一次月考化学试题 江西省景德镇一中2021-2022学年高一下学期期中质量检测(17)班化学试题湖北省武汉市华中师范大学第一附属中学2021-2022学年高一下学期期中考试化学试题江西省遂川中学2021-2022学年高二上学期第二次月考化学(B卷)试题江西省赣州市赣县第七中学2020-2021学年高二上学期10月月考化学试题黑龙江省哈尔滨市第九中学校2020-2021学年高一下学期6月月考化学试题黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题四川省成都市蒲江县蒲江中学2019-2020学年高二上学期10月月考化学试题湖南师范大学附属中学2020-2021学年高一下学期第一次月考化学试题江苏省启东中学2020-2021学年高一下学期第一次阶段测试化学试题人教版2019必修第二册 第六章 第二节 第1课时 化学反应的速率高中化学苏教2019版必修第二册-专题6 第一单元 第1课时 化学反应速率高一必修第二册(人教2019版)第六章 第二节 化学反应的速率与限度 综合训练(已下线)第六单元 化学反应速率和化学平衡测试题-2021年高考化学一轮复习名师精讲练【学科网名师堂】北京市海淀区首师大附属育新学校中部2019-2020学年高一下学期期末考试化学试题内蒙古赤峰二中2019-2020学年高一下学期第二次月考(6月)化学试题北京市西城区高一化学下学期前三章综合阶段性试卷北京市西城区2018-2019学年高一第二学期期末考试化学试题
更新时间:2022-01-08 10:09:27
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某同学设计实验探究丙酮碘化反应中,丙酮、 、
、 浓度对化学反应速率的影响。
浓度对化学反应速率的影响。
已知: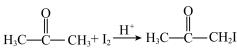 +2HI
+2HI
(1)研究丙酮浓度对反应速率的影响,应选择的实验组为___________
(2)实验④中,
___________  ,加
,加 蒸馏水的目的是
蒸馏水的目的是___________ 。
(3)计算实验③中,以 表示的反应速率为
表示的反应速率为___________  (列出表达式)。
(列出表达式)。
(4)通过计算发现规律:丙酮碘化反应的速率与丙酮和 的浓度有关,而与
的浓度有关,而与 的浓度无关,查阅资料发现丙酮碘化反应的历程为:
的浓度无关,查阅资料发现丙酮碘化反应的历程为:
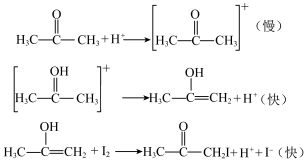
请依据反应历程,解释丙酮碘化反应速率与 浓度无关的原因
浓度无关的原因___________ 。
(5)温度升高至100℃时,纯水的pH=6,此时溶液呈___________ (填“酸”、“碱”或“中”)性;100℃时,0.1 NaOH溶液的pH=
NaOH溶液的pH=___________ 。
 、
、 浓度对化学反应速率的影响。
浓度对化学反应速率的影响。已知:
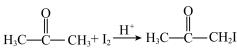 +2HI
+2HI| 编号 | 丙酮溶液(4mol/L) |  溶液(0.0025mol/L) 溶液(0.0025mol/L) | 盐酸(2mol/L) | 蒸馏水 | 溶液褪色时间(s) |
| ① | 2mL | 2mL | 2mL | 0mL |  |
| ② | 1mL | 2mL | 2mL | 1mL |  |
| ③ | 2mL | 1mL | 2mL | 1mL |  |
| ④ | 2mL | 2mL | a_mL | 1mL |  |
(1)研究丙酮浓度对反应速率的影响,应选择的实验组为
(2)实验④中,

 ,加
,加 蒸馏水的目的是
蒸馏水的目的是(3)计算实验③中,以
 表示的反应速率为
表示的反应速率为 (列出表达式)。
(列出表达式)。(4)通过计算发现规律:丙酮碘化反应的速率与丙酮和
 的浓度有关,而与
的浓度有关,而与 的浓度无关,查阅资料发现丙酮碘化反应的历程为:
的浓度无关,查阅资料发现丙酮碘化反应的历程为:
请依据反应历程,解释丙酮碘化反应速率与
 浓度无关的原因
浓度无关的原因(5)温度升高至100℃时,纯水的pH=6,此时溶液呈
 NaOH溶液的pH=
NaOH溶液的pH=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.某课外活动小组利用如图1装置探究Zn与酸反应速率的影响因素。记录生成氢气的体积及时间。
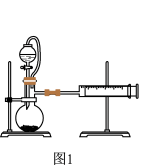
(1)阴离子对反应速率的影响
实验药品:500mL0.4mol•L-1盐酸、500mLamol•L-1硫酸,等质量、等大小的过量Zn片。记录数据绘制成图2。回答下列问题:
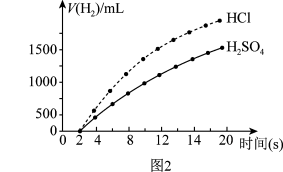
①实验中所用硫酸的浓度为______ 。
②反应开始的0~2s内,未产生氢气,可能的原因是______ 。
③根据实验数据绘制的图像可知,在相同时间段内,锌与500mL0.4mol•L-1盐酸反应速率_____ (填“大于”或“小于”)锌与500mLamol•L-1硫酸反应速率。
(2)温度对反应速率的影响
取2L1mol/LHCl溶液于图一装置中,分别加入同等大小的锌粒,在不同温度下反应,记录相同时间内产生的H2的体积,实验数据记录如表(换算成标况):
①计算308K时在0s~40s时间内氯化氢的平均反应速率v(HCl)=______ (忽略溶液体积变化)。
②根据表中数据可知,温度越高,化学反应速率越______ (填“快”或“慢”)。
(3)催化剂对反应速率的影响
该研究小组的同学为研究Fe3+对H2O2分解的催化效果,设计了如图所示的实验。
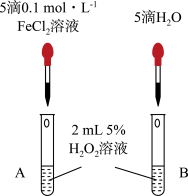
产生气泡更快的是______ (填“A”或“B”)。
Ⅱ.回答下列问题:
(4)某实验小组在温度为T时,向烧杯中加入10mL0.1mol/LFeCl3溶液和20mL0.1mol/LKI溶液,发生反应2Fe3++2I- 2Fe2++I2一段时间后达到平衡。下列不能判断反应达到平衡状态的是
2Fe2++I2一段时间后达到平衡。下列不能判断反应达到平衡状态的是______ 。

(1)阴离子对反应速率的影响
实验药品:500mL0.4mol•L-1盐酸、500mLamol•L-1硫酸,等质量、等大小的过量Zn片。记录数据绘制成图2。回答下列问题:

①实验中所用硫酸的浓度为
②反应开始的0~2s内,未产生氢气,可能的原因是
③根据实验数据绘制的图像可知,在相同时间段内,锌与500mL0.4mol•L-1盐酸反应速率
(2)温度对反应速率的影响
取2L1mol/LHCl溶液于图一装置中,分别加入同等大小的锌粒,在不同温度下反应,记录相同时间内产生的H2的体积,实验数据记录如表(换算成标况):
| 实验① | 298K | 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积(mL) | 14.5 | 36.6 | 61.6 | 141.6 | 224 | 389 | 450 | 496 | 517.6 | 534 | ||
| 实验② | 308K | 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积(mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
①计算308K时在0s~40s时间内氯化氢的平均反应速率v(HCl)=
②根据表中数据可知,温度越高,化学反应速率越
(3)催化剂对反应速率的影响
该研究小组的同学为研究Fe3+对H2O2分解的催化效果,设计了如图所示的实验。

产生气泡更快的是
Ⅱ.回答下列问题:
(4)某实验小组在温度为T时,向烧杯中加入10mL0.1mol/LFeCl3溶液和20mL0.1mol/LKI溶液,发生反应2Fe3++2I-
 2Fe2++I2一段时间后达到平衡。下列不能判断反应达到平衡状态的是
2Fe2++I2一段时间后达到平衡。下列不能判断反应达到平衡状态的是| A.溶液颜色不再发生变化 | B.v(Fe3+)=2v(I2) |
| C.Fe2+浓度不再发生变化 | D.消耗1molFe3+的同时生成1molI- |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】I.现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1000 mL,供选择的电极材料有纯铜片和纯锌片。请回答下列问题:
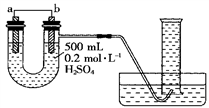
(1)b电极材料为__________ ,其电极反应式为_________________________ 。
(2)当量筒中收集到672 mL(标准状况下)气体时,通过导线的电子的物质的量为__________ ,此时a电极质量减少__________ g。
II.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有:_____________________________________________ ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是_________________________________________ ;
(3)要加快上述实验中气体产生的速率,还可采取的措施有_____________________ (答两种);

(1)b电极材料为
(2)当量筒中收集到672 mL(标准状况下)气体时,通过导线的电子的物质的量为
II.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有:
(2)硫酸铜溶液可以加快氢气生成速率的原因是
(3)要加快上述实验中气体产生的速率,还可采取的措施有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某实验小组制备高铁酸钾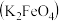 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)
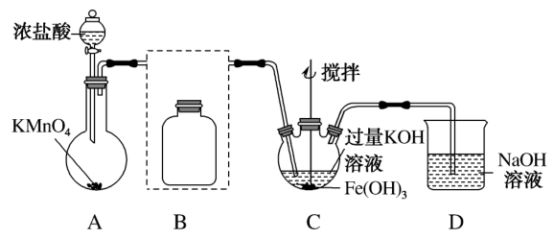
①A为氯气发生装置。
②装置B中盛放的试剂是_______ ,其作用是_______ 。
③C中通入 做氧化剂,制备得到紫色固体和溶液的化学方程式是
做氧化剂,制备得到紫色固体和溶液的化学方程式是_______ .此外C中 发生的反应还有
发生的反应还有_______ (写离子方程式)
(2)探究 的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
①由方案Ⅰ中溶液变红反应的离子方程式是_______ ,该金属离子_______ (填“一定是”、“一定不是”、“无法确定是”)由 将
将 氧化所得。
氧化所得。
②方案Ⅱ可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是_______ 。
 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
①A为氯气发生装置。
②装置B中盛放的试剂是
③C中通入
 做氧化剂,制备得到紫色固体和溶液的化学方程式是
做氧化剂,制备得到紫色固体和溶液的化学方程式是 发生的反应还有
发生的反应还有(2)探究
 的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a,滴加 溶液至过量,溶液呈红色。 溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。 产生。 |
 将
将 氧化所得。
氧化所得。②方案Ⅱ可证明
 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】从分金渣(主要成分为:AgCl、Ag2S、PbSO4、BaSO4)中获取高纯银的流程如图所示:

已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50。
(1)“预处理”时主要反应的化学方程式为___________ 。
(2)“分银”时AgCl与Na2SO3反应生成[Ag(SO3) 2]3-的离子方程式为___________ ,该反应的K=___________ 。(已知:Ag++2SO
 [Ag(SO3)2]3- K=1.0×108.68)
[Ag(SO3)2]3- K=1.0×108.68)
(3)“分银渣”主要成分为PbSO4、BaSO4、___________ (填化学式)。
(4)“分银”时c{[Ag(SO3)2]3-}浓度与溶液pH的关系如图1;SO 及其与H+形成的微粒的浓度分数a随溶液pH变化的关系如图2。
及其与H+形成的微粒的浓度分数a随溶液pH变化的关系如图2。
①“分银”pH应控制在___________ 范围。
②“沉银”的终点pH应控制在___________ 范围内。

(5)“还原”时HCHO转化为HCOOH,其化学方程式为___________ 。

已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50。
(1)“预处理”时主要反应的化学方程式为
(2)“分银”时AgCl与Na2SO3反应生成[Ag(SO3) 2]3-的离子方程式为

 [Ag(SO3)2]3- K=1.0×108.68)
[Ag(SO3)2]3- K=1.0×108.68)(3)“分银渣”主要成分为PbSO4、BaSO4、
(4)“分银”时c{[Ag(SO3)2]3-}浓度与溶液pH的关系如图1;SO
 及其与H+形成的微粒的浓度分数a随溶液pH变化的关系如图2。
及其与H+形成的微粒的浓度分数a随溶液pH变化的关系如图2。①“分银”pH应控制在
②“沉银”的终点pH应控制在

(5)“还原”时HCHO转化为HCOOH,其化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】S2Cl2是一种有毒的液体,熔点-76℃,沸点138℃,蒸气有腐蚀性,易溶解硫磺,遇水分解。主要用于杀虫剂、硫化染料、气相下橡胶的硫化等。兴趣小组同学用下图所示装置(夹持和部分加热装置略去)制取 S2Cl2,并测定所得S2Cl2的纯度。
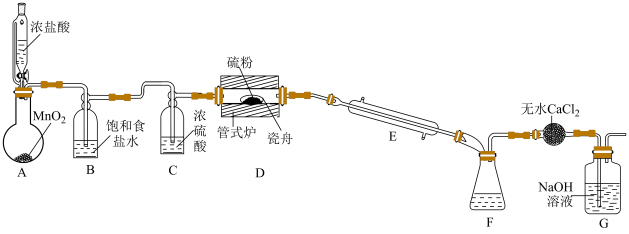
已知:S的熔点112.8 ℃,沸点444 ℃。
(1)E装置中仪器的名称为___________ 。
(2)实验时,先加热___________ (填装置序号),装置A中发生反应的化学方程式为:___________ 。
(3)锥形瓶F中实际收集到的是___________ ,要从F中得到的产物获得较纯净的S2Cl2应采用的实验方法是___________ 。
(4)无水 CaCl2的作用是___________ 。
(5)测定S2Cl2的纯度
①取m g实验所得S2Cl2,缓缓通入足量NH3搅拌、静置。向其中加入足量甲醛充分反应后,用c mol·L-1 NaOH标准溶液滴定,达到滴定终点时消耗 NaOH 标准液V mL。实验所得S2Cl2的质量分数为___________ 。[已知:6S2Cl2+16NH3=S4N4+8S+12NH4Cl;6HCHO+4NH =(CH2)6N4+4H+ +6H2O]
=(CH2)6N4+4H+ +6H2O]
②下列滴定操作中,会导致S2Cl2质量分数测定值偏高的是___________ 。
a. 锥形瓶洗涤干净后未干燥
b. 滴定前平视滴定管刻度线,滴定后俯视
c. 滴定前碱式滴定管内有气泡,滴定结束后无气泡
d. 碱式滴定管用蒸馏水洗净后,未用NaOH 标准溶液润洗

已知:S的熔点112.8 ℃,沸点444 ℃。
(1)E装置中仪器的名称为
(2)实验时,先加热
(3)锥形瓶F中实际收集到的是
(4)无水 CaCl2的作用是
(5)测定S2Cl2的纯度
①取m g实验所得S2Cl2,缓缓通入足量NH3搅拌、静置。向其中加入足量甲醛充分反应后,用c mol·L-1 NaOH标准溶液滴定,达到滴定终点时消耗 NaOH 标准液V mL。实验所得S2Cl2的质量分数为
 =(CH2)6N4+4H+ +6H2O]
=(CH2)6N4+4H+ +6H2O]②下列滴定操作中,会导致S2Cl2质量分数测定值偏高的是
a. 锥形瓶洗涤干净后未干燥
b. 滴定前平视滴定管刻度线,滴定后俯视
c. 滴定前碱式滴定管内有气泡,滴定结束后无气泡
d. 碱式滴定管用蒸馏水洗净后,未用NaOH 标准溶液润洗
您最近一年使用:0次



