草酸(H2C2O4)是一种二元弱酸。常温下,向 液中逐滴加入
液中逐滴加入 溶液,混合溶液中
溶液,混合溶液中 [X为
[X为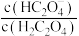 或
或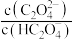 ]与
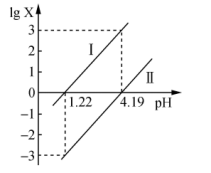
]与 的变化关系如图所示。下列说法错误的是
的变化关系如图所示。下列说法错误的是
 液中逐滴加入
液中逐滴加入 溶液,混合溶液中
溶液,混合溶液中 [X为
[X为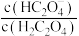 或
或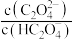 ]与
]与 的变化关系如图所示。下列说法错误的是
的变化关系如图所示。下列说法错误的是
A.曲线Ⅰ表示 与 与 的变化关系 的变化关系 |
B. 溶液中: 溶液中: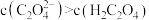 |
C.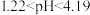 的溶液中: 的溶液中: |
D.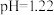 的溶液中: 的溶液中: |
2022·广东·模拟预测 查看更多[3]
广东省(梅县东山中学 广州五中 珠海二中 佛山三中)四校2021-2022学年高三下学期第二次联考化学试题(已下线)押广东卷化学第8题 电解质溶液-备战2022年高考化学临考题号押题(广东卷)广东省四校2022届高三第二次联考化学试卷
更新时间:2022-02-24 22:51:40
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】25 ℃时,用0.1 mol/L的CH3COOH溶液滴定20 mL 0.1 mol/L的NaOH溶液,当滴加V mL CH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确的是( )
A.Ka= | B.V=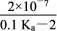 |
C.Ka=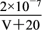 | D.Ka=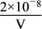 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】H3A是一种多元酸,25℃时,向1mol·L-1H3A溶液中逐滴加入NaOH稀溶液至过量,滴加过程中各种含A微粒的物质的量分数随溶液pH的变化曲线如图所示。下列叙述正确的是

| A.1 mol·L-1的H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-) |
| B.25℃时H3A的第一级电离平衡常数数量级为10-3 |
| C.1 mol·L-1的NaH2A溶液中存在:c(Na+)>c(OH-)>c(H2A-)>c(HA2-) |
| D.NaH2A溶液中存在:c(H3A)+c(H+)=c(OH-)+c(HA2-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
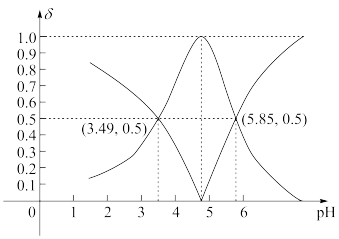
【推荐3】H2A为二元酸,其电离过程为:H2A H++HA-,HA-
H++HA-,HA- H++A2-。常温时,向20mL0.1mol/LH2A水溶液中逐滴滴加0.1mol/LNaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
H++A2-。常温时,向20mL0.1mol/LH2A水溶液中逐滴滴加0.1mol/LNaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是

 H++HA-,HA-
H++HA-,HA- H++A2-。常温时,向20mL0.1mol/LH2A水溶液中逐滴滴加0.1mol/LNaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
H++A2-。常温时,向20mL0.1mol/LH2A水溶液中逐滴滴加0.1mol/LNaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
| A.H2A的Kal的数量级为10-1.2 |
| B.曲线Ⅱ表示A2- |
| C.当溶液中c(H2A)=c(A2-)时,pH=2.7 |
| D.向pH=4.2的溶液中继续滴加NaOH溶液,水的电离程度持续变大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
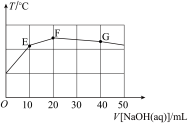
【推荐1】已知:某二元酸H2XO4在水中电离分两步:H2XO4=H++HXO ,HXO
,HXO
 H++XO
H++XO 。常温下,在20.00mL0.01mol·L−1NaHXO4溶液中滴加cmol·L−1NaOH溶液,溶液温度与溶液体积关系如图所示。下列说法不正确的是
。常温下,在20.00mL0.01mol·L−1NaHXO4溶液中滴加cmol·L−1NaOH溶液,溶液温度与溶液体积关系如图所示。下列说法不正确的是
 ,HXO
,HXO
 H++XO
H++XO 。常温下,在20.00mL0.01mol·L−1NaHXO4溶液中滴加cmol·L−1NaOH溶液,溶液温度与溶液体积关系如图所示。下列说法不正确的是
。常温下,在20.00mL0.01mol·L−1NaHXO4溶液中滴加cmol·L−1NaOH溶液,溶液温度与溶液体积关系如图所示。下列说法不正确的是
| A.Kw=10−12时,该NaOH溶液的pH=10 |
B.E点溶液中2c(Na+)=3c(H2XO4)+3c(HXO )+3c(XO )+3c(XO ) ) |
C.对应曲线上F、G之间的某一点,溶液中存在:c(Na+)>c(XO )=c(OH−)>c(HXO )=c(OH−)>c(HXO )>c(H+) )>c(H+) |
D.F点存在:c(OH−)+c(HXO )+2c(XO )+2c(XO )>0.005mol/L )>0.005mol/L |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】25℃时,浓度均为0.1mol·L-1的溶液,其pH如表所示。有关说法正确的是
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A.酸性强弱:H2CO3>HF | B.①和②中水的电离程度相同 |
| C.离子的总浓度:①>③ | D.④中:c(HCO3-)+2c(CO32-)+c(H2CO3)=0.1mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
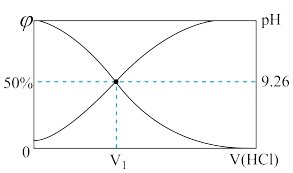
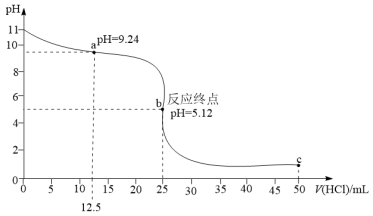
【推荐1】某同学在容器中加入25mL0.1mol·L-1的氨水,再用0.1mol·L-1的盐酸滴定,所得溶液的pH、溶液中NH 和NH3•H2O的物质的量分数φ与加入盐酸的体积V的关系如图所示,下列说法不正确的是
和NH3•H2O的物质的量分数φ与加入盐酸的体积V的关系如图所示,下列说法不正确的是
 和NH3•H2O的物质的量分数φ与加入盐酸的体积V的关系如图所示,下列说法不正确的是
和NH3•H2O的物质的量分数φ与加入盐酸的体积V的关系如图所示,下列说法不正确的是
A.NH 的水解平衡常数为10-9.26 的水解平衡常数为10-9.26 |
| B.应选用甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为橙色 |
C.当加入盐酸体积为12.5mL时,溶液中c(NH3•H2O)>c(Cl-)>c(NH ) ) |
| D.当加入盐酸体积为V1mL时,c(H+)+c(NH3•H2O)=c(Cl-)+c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】25℃时,将1 mol NH4NO3溶于水,再向该溶液滴加b L氨水后溶液呈中性,据此判断下列说法中不正确的是(NH3·H2O的电离平衡常数取Kb=2×10-5)
A.水的电离先受到促进,后受到抑制,最终水电离的c(OH-)=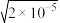 |
| B.滴加b L氨水后的溶液中,n(NH4+)=200n(NH3·H2O)=1 mol |
| C.所滴加氨水的浓度为0.005/b mol/L |
| D.滴加b L氨水后的溶液中各离子浓度大小是:c(NH4+)=c(NO3-)>c(H+)=c(OH-) |
您最近一年使用:0次
【推荐3】金属及其化合物在生产生活中应用广泛。2011年云南的“乌铜走银”制作技艺列入国家级非物质文化遗产名录。制作中的走银工序是将氧化变黑的银丝嵌入铜器表面已錾刻好的花纹内,再经揉黑工序,用手边焐边搓揉铜器,直到铜器表面变成乌黑、银丝变得光亮。铜、硫酸铜、硝酸银、银氨溶液是实验室常用的含铜或银的化学试剂。从废定影液[主要含有H+、Ag(S2O3)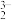 、H2SO3、Br-等微粒]中回收Ag和Br2的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量Na2S溶液沉银,过滤、洗涤及干燥,灼烧Ag2S制Ag;滤液中通入Cl2氧化Br-,用苯萃取分液。下列有关从废定影液中回收Ag和Br2的说法正确的是
、H2SO3、Br-等微粒]中回收Ag和Br2的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量Na2S溶液沉银,过滤、洗涤及干燥,灼烧Ag2S制Ag;滤液中通入Cl2氧化Br-,用苯萃取分液。下列有关从废定影液中回收Ag和Br2的说法正确的是
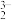 、H2SO3、Br-等微粒]中回收Ag和Br2的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量Na2S溶液沉银,过滤、洗涤及干燥,灼烧Ag2S制Ag;滤液中通入Cl2氧化Br-,用苯萃取分液。下列有关从废定影液中回收Ag和Br2的说法正确的是
、H2SO3、Br-等微粒]中回收Ag和Br2的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量Na2S溶液沉银,过滤、洗涤及干燥,灼烧Ag2S制Ag;滤液中通入Cl2氧化Br-,用苯萃取分液。下列有关从废定影液中回收Ag和Br2的说法正确的是| A.过滤时,为加快滤液流下,可以用玻璃棒搅拌漏斗中的液体 |
B.配制Na2S溶液时,向其中加入少量NaOH溶液, 的值增大 的值增大 |
| C.灼烧Ag2S生成Ag和SO2,该反应每生成1molAg转移3mol电子 |
| D.分液时,先放出水层,再从分液漏斗下口放出含有苯和溴的有机层 |
您最近一年使用:0次

 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)

