钛(Ti)被称为“未来金属”,其化合物广泛用于国防、电讯器材、医疗器械和化工设备等领域。回答下列问题:
(1)基态钛原子的价电子排布式为___________ ,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有___________ 种。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其它三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___________ 。
(3)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示:___________ 。
②请在图中标出配位键___________ (用“→”表示);
③配合物中非金属元素的含氧酸根的中心原子杂化轨道类型是sp2的是___________ 。
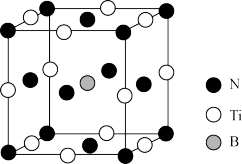
(4)用B掺杂TiN后(晶胞结构中只是B原子部分代替钛原子),其晶胞结构如图所示,距离Ti最近的B有___________ 个,Ti与B的最近距离为___________ nm;掺杂B后的晶体密度是TiN晶体的___________ 倍。(已知掺杂B后的晶体密度为ρg/cm3,阿伏加德罗常数的值为NA)
(1)基态钛原子的价电子排布式为
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其它三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(3)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示:

②请在图中标出配位键
③配合物中非金属元素的含氧酸根的中心原子杂化轨道类型是sp2的是
(4)用B掺杂TiN后(晶胞结构中只是B原子部分代替钛原子),其晶胞结构如图所示,距离Ti最近的B有
更新时间:2022-03-22 16:55:24
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】第二代半导体材料[(III~V)A族化合物]的特殊性能使之成为科学家的研究热点之一、
(1)镓位于元素周期表的第四周期,第___________ 族,基态镓原子价层电子排布式为___________ 。
(2)氨、磷位于同一主族。已知有关氮磷的单键和三键的键能(kJ∙mol-1)如下表:
从能最角度看,氮以N2形式存在更稳定。请分析白磷以P4(结构式可表示为 ,)而不以P2形式存在的原因
,)而不以P2形式存在的原因________ 。 的空间构型为
的空间构型为_______ ,中心原子的杂化方式为________ 。
(3)基态砷原子的核外共有___________ 种不同空间运动状态的电子。
(4)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表所示:
试从结构的角度分析它们熔点不同的原因___________ 。
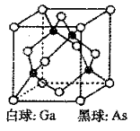
(5)砷化镓晶胞如图所示,砷(As)原子的配位数为___________ 若两个镓原子之间的最近距离为d pm,NA代表阿伏加德罗常数的值,则砷化镓晶体的密度ρ=___________ g·cm-3
(1)镓位于元素周期表的第四周期,第
(2)氨、磷位于同一主族。已知有关氮磷的单键和三键的键能(kJ∙mol-1)如下表:
化学键 | N-N | N≡N | PP | P≡P |
| 键能(kJ∙mol-1) | 193 | 946 | 197 | 489 |
从能最角度看,氮以N2形式存在更稳定。请分析白磷以P4(结构式可表示为
 ,)而不以P2形式存在的原因
,)而不以P2形式存在的原因 的空间构型为
的空间构型为(3)基态砷原子的核外共有
(4)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表所示:
物质 | BN | AlN | GaN |
| 熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因
(5)砷化镓晶胞如图所示,砷(As)原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】X、Y、Z、W、R、I、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,I的原子序数是W的两倍,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为___________ ,Y的电子排布图为_________________________
(2)化合物ZX3中Z原子的杂化方式为___________ ,ZW2- 离子的立体构型是___________ ;
(3)①Y、R的最高价氧化物的沸点较高的是___________ (填化学式),原因是___________ ;
②W与I的简单氢化物中W的熔沸点更高,原因是______________________
(4)向Q元素的硫酸盐溶液中通入足量ZX3,充分反应后溶液呈深蓝色,该反应的离子方程式为__________________________________________________ ;
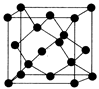
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________ ,Y原子的配位数为___________ ,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏伽德罗常数的数值为___________ (用含a和ρ的代数式表示)。
(1)Q+核外电子排布式为
(2)化合物ZX3中Z原子的杂化方式为
(3)①Y、R的最高价氧化物的沸点较高的是
②W与I的简单氢化物中W的熔沸点更高,原因是
(4)向Q元素的硫酸盐溶液中通入足量ZX3,充分反应后溶液呈深蓝色,该反应的离子方程式为
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为

您最近一年使用:0次
【推荐3】中国科学院化学研究所有机固体院重点实验室合成了适用于非卤溶剂加工的“巨分子受体”,对于推动聚合物太阳电池受体光伏材料的发展具有重要意义。目前可做太阳电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。
(1) 在元素周期表中的位置为
在元素周期表中的位置为_______ ,其基态原子有_______ 种不同运动状态的电子。
(2)Te位于元素周期表第五周期第ⅥA族,其基态原子的价层电子轨道表示式为_______ ,其核外电子占据的最高能级的电子云轮廓图为_______ 。
(3)第一电子亲和能 是指基态的气态原子得到一个电子形成气态
是指基态的气态原子得到一个电子形成气态 价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
_______ (填“ ”或“
”或“ ”)
”)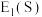 。
。
(4) 和
和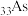 (与
(与 同主族)两种元素中第一电离能较大的是
同主族)两种元素中第一电离能较大的是_______ (填元素符号),试解释其原因:_______ 。
(5)根据对角线规则可知, 与铝在性质上具有相似性。已知
与铝在性质上具有相似性。已知 ,
, 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为_______ 。
(1)
 在元素周期表中的位置为
在元素周期表中的位置为(2)Te位于元素周期表第五周期第ⅥA族,其基态原子的价层电子轨道表示式为
(3)第一电子亲和能
 是指基态的气态原子得到一个电子形成气态
是指基态的气态原子得到一个电子形成气态 价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
 ”或“
”或“ ”)
”)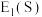 。
。(4)
 和
和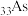 (与
(与 同主族)两种元素中第一电离能较大的是
同主族)两种元素中第一电离能较大的是(5)根据对角线规则可知,
 与铝在性质上具有相似性。已知
与铝在性质上具有相似性。已知 ,
, 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Cr、Ni、C等多种元素。请回答:
(1)基态铁原子的价电子排布式为___ ,FeCl3的熔点为306℃,沸点为315℃,FeCl3的晶体类型是____ 。
(2)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为___ ;Fe2+与O2-最短核间距为____ pm。

(3)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①Ni(NH3)6]SO4中阴离子的立体构型是____ 。
②在[NiNH3)6]SO4中Ni2+与NH3之间形成的化学键称为__ ,提供孤电子对的成键原子是_ 。
(1)基态铁原子的价电子排布式为
(2)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为

(3)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①Ni(NH3)6]SO4中阴离子的立体构型是
②在[NiNH3)6]SO4中Ni2+与NH3之间形成的化学键称为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】据报道,新疆南部发现稀有金属、铅、锌、铁、锰和金矿带约600 m。回答下列问题:
(1)基态锰的价层电子排布式为___________ ;预测:锰的第三电离能( )
)___________ (填“大于”“小于”或“等于”)铁的第三电离能( )。
)。
(2)氧化锰能催化氧化HCHO生成CO2和H2O。
①等物质的量的HCHO、CO2分子中π键数目之比为___________ 。
②在HCHO、CO2、H2O中,空间构型呈V形的分子是___________ 。
③HCHO中C原子的杂化类型是___________ 。
(3) 中不存在的作用力类型是___________(填字母)。
中不存在的作用力类型是___________(填字母)。
(4)配合物在水中的颜色与d轨道的分裂能有关。d轨道的分裂能是1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量。预测分裂能:
___________ (填“>”“<”或“=”)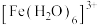 ,理由是
,理由是___________ 。
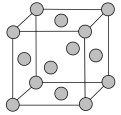
(5)铅晶胞如图所示。___________ ,它的配位数为___________ 。
②面心上六个铅原子相连构成的空间结构是___________ (填字母)。
A.正四方形 B.三角锥形 C.正八面体形 D.正四面体形
③已知:铅晶胞密度为 ,
, 代表阿伏加德罗常数的值。晶胞中两个面心上铅原子的最短距离为
代表阿伏加德罗常数的值。晶胞中两个面心上铅原子的最短距离为___________ pm。
(1)基态锰的价层电子排布式为
 )
) )。
)。(2)氧化锰能催化氧化HCHO生成CO2和H2O。
①等物质的量的HCHO、CO2分子中π键数目之比为
②在HCHO、CO2、H2O中,空间构型呈V形的分子是
③HCHO中C原子的杂化类型是
(3)
 中不存在的作用力类型是___________(填字母)。
中不存在的作用力类型是___________(填字母)。| A.非极性键 | B.配位键 | C.离子键 | D.金属键 |
(4)配合物在水中的颜色与d轨道的分裂能有关。d轨道的分裂能是1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量。预测分裂能:

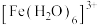 ,理由是
,理由是(5)铅晶胞如图所示。
②面心上六个铅原子相连构成的空间结构是
A.正四方形 B.三角锥形 C.正八面体形 D.正四面体形
③已知:铅晶胞密度为
 ,
, 代表阿伏加德罗常数的值。晶胞中两个面心上铅原子的最短距离为
代表阿伏加德罗常数的值。晶胞中两个面心上铅原子的最短距离为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】钴及其化合物在工业生产中有广阔的应用前景。已知:Co2+不易被氧化,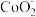 和Co3+都具有强氧化性,[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
和Co3+都具有强氧化性,[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
(1)从锂钴废料(主要成分为LiCoO2)分离Co2+。
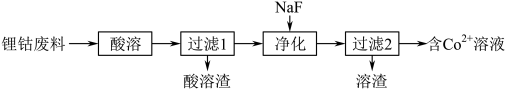
①Co2+的价电子排布式为___________ 。
②“酸溶”时不选择浓HCl的理由是___________ 。
③“净化”时,加NaF固体是将Li+转化为沉淀,“净化”后溶液中c(F-)=4.0×10-2mol/L,若“过滤1”后溶液中c(Li+)=1.0mo/L,则“净化”后c(Na+)=___________ mol/L。(溶液体积变化忽略不计,不考虑其他离子影响。25℃时Ksp(LiF)=2.0×10-3)
(2)从由CoCl2制备[Co(NH3)6]Cl3。
实验过程:称取研细的CoCl2·6H2O10.0g和NH4Cl50g于烧杯中溶解,将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水,5mL30%的H2O2溶液,控制反应温度为60°C,打开分液漏斗,反应一段时间后,得[Co(NH3)6]Cl3溶液,实验装置如图所示:

①由CoCl2制备[Co(NH3)6]Cl3溶液的离子方程式为___________ 。
②分液漏斗中液体加入三颈烧瓶中的顺序为___________ 。
(3)用CoSO4溶液为原料“沉钴”时,可先制得CoCO3再制备Co3O4,CoCO3在空气中受热分解,测得剩余固体的质量与起始CoCO3的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。
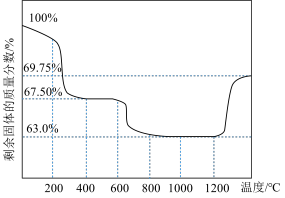
为获得较高产率的Co3O4,请补充实验方案:取0.1mo/LCoSO4溶液,边搅拌边滴加0.1mol/LNH4HCO3溶液,至不再产生沉淀,过滤、洗涤,得到CoCO3固体;将CoCO3固体置于热解装置中,通入空气流,在___________ ℃温度下煅烧至恒重即可。
 和Co3+都具有强氧化性,[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
和Co3+都具有强氧化性,[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。(1)从锂钴废料(主要成分为LiCoO2)分离Co2+。

①Co2+的价电子排布式为
②“酸溶”时不选择浓HCl的理由是
③“净化”时,加NaF固体是将Li+转化为沉淀,“净化”后溶液中c(F-)=4.0×10-2mol/L,若“过滤1”后溶液中c(Li+)=1.0mo/L,则“净化”后c(Na+)=
(2)从由CoCl2制备[Co(NH3)6]Cl3。
实验过程:称取研细的CoCl2·6H2O10.0g和NH4Cl50g于烧杯中溶解,将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水,5mL30%的H2O2溶液,控制反应温度为60°C,打开分液漏斗,反应一段时间后,得[Co(NH3)6]Cl3溶液,实验装置如图所示:

①由CoCl2制备[Co(NH3)6]Cl3溶液的离子方程式为
②分液漏斗中液体加入三颈烧瓶中的顺序为
(3)用CoSO4溶液为原料“沉钴”时,可先制得CoCO3再制备Co3O4,CoCO3在空气中受热分解,测得剩余固体的质量与起始CoCO3的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。

为获得较高产率的Co3O4,请补充实验方案:取0.1mo/LCoSO4溶液,边搅拌边滴加0.1mol/LNH4HCO3溶液,至不再产生沉淀,过滤、洗涤,得到CoCO3固体;将CoCO3固体置于热解装置中,通入空气流,在
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1)基态磷原子有________ 种不同能量的电子。
(2)N、P、As电负性由大到小的顺序为______ ,它们的氢化物沸点最高的为_______________ ,原因为___________________________ 。
(3)NO3- 离子的空间构型为_____ ,中心原子的杂化方式为_____ ,NO3-离子有多种等电子体,请写出一种_________ 。
(4)钛元素原子核外价电子排布图为____________ ,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型为____________ ,该配离子的配位数为____________ 。
(5)砷化镓晶胞结构如下图。晶胞中距离Ga原子等距且最近的Ga原子有_________ 个,Ga与周围等距且最近的As形成的空间构型为____________ 。已知砷化镓晶胞边长为a pm,其密度为ρg•cm-3,则阿伏伽德罗常数的数值为_____________ (列出计算式即可)。
(1)基态磷原子有
(2)N、P、As电负性由大到小的顺序为
(3)NO3- 离子的空间构型为
(4)钛元素原子核外价电子排布图为
(5)砷化镓晶胞结构如下图。晶胞中距离Ga原子等距且最近的Ga原子有

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】金属镓拥有“电子工业脊梁”的美誉,镓与铝同族。某工厂改进了“石灰乳法提镓”,从某种煤灰(主要成分是 ,还含有少量
,还含有少量 、
、 、
、 等)中提取镓的工艺如下:
等)中提取镓的工艺如下:

已知:常温下,浸出液中各离子形成氢氧化物沉淀及转化的pH见下表;
沉淀完全pH指的是阳离子浓度为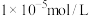 ;
; 。
。
回答下列问题:
(1)基态Ga原子的价电子排布式为______ 。
(2)“调pH”步骤时, 的浓度为
的浓度为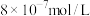 ,此时的pH约为
,此时的pH约为______ (保留一位小数)。
(3)“碱浸”步骤pH至少调为______ 。
(4)“滤液1”中的溶质为______ (填化学式)。
(5)已知铝酸钙的化学式为 ,则“脱铝”时发生反应的化学方程式为
,则“脱铝”时发生反应的化学方程式为______ 。
(6)“电解”步骤阴极的电极反应式为______ 。
(7)GaAs(摩尔质量为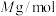 )是一种重要的半导体材料,原子间通过共价键结合,其晶胞结构如图,Ga原子半径为
)是一种重要的半导体材料,原子间通过共价键结合,其晶胞结构如图,Ga原子半径为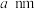 ,As原子半径为
,As原子半径为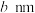 。GaAs的晶体类型为
。GaAs的晶体类型为______ ,其密度为______  。
。

 ,还含有少量
,还含有少量 、
、 、
、 等)中提取镓的工艺如下:
等)中提取镓的工艺如下:
已知:常温下,浸出液中各离子形成氢氧化物沉淀及转化的pH见下表;
金属离子 |
|
|
|
|
开始沉淀pH | 8.0 | 1.7 | 4.0 | 4.5 |
沉淀完全pH | 9.6 | 3.3 | 4.7 | 5.5 |
继续转化 | 9.8(转化为 | 9.4(转化为 |
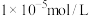 ;
; 。
。回答下列问题:
(1)基态Ga原子的价电子排布式为
(2)“调pH”步骤时,
 的浓度为
的浓度为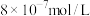 ,此时的pH约为
,此时的pH约为(3)“碱浸”步骤pH至少调为
(4)“滤液1”中的溶质为
(5)已知铝酸钙的化学式为
 ,则“脱铝”时发生反应的化学方程式为
,则“脱铝”时发生反应的化学方程式为(6)“电解”步骤阴极的电极反应式为
(7)GaAs(摩尔质量为
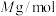 )是一种重要的半导体材料,原子间通过共价键结合,其晶胞结构如图,Ga原子半径为
)是一种重要的半导体材料,原子间通过共价键结合,其晶胞结构如图,Ga原子半径为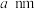 ,As原子半径为
,As原子半径为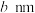 。GaAs的晶体类型为
。GaAs的晶体类型为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】贵重金属铜、银、金在元素周期表中处于同一族。它们自古以来就用作货币,故该族元素又称为“货币元素”。回答相关问题。
(1)写出基态铜原子的价电子排布式___________ 。
(2)CuSO4在碱性条件下加入双缩脲HN(CONH2)2,会得到紫色物质,该物质为-2价的配位阴离子,其结构如图所示。该反应原理在化学上可以用于检验蛋白质。
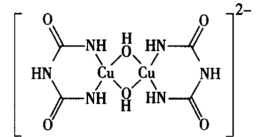
该离子中非金属元素的电负性由大到小的排列为___________ 。1mol该离子含有配位键的数目为___________ NA。
(3)无水Cu(NO3)2在很长的时间内都没有制备成功,因而认为不存在,直到后来利用单质Cu和液态N2O4反应成功制备。已知液态N2O4会发生类似水的自耦电离N2O4⇌NO++ 。
。
①写出该反应的化学方程式___________ ;
②写出与NO+互为等电子体的1种分子___________ 和1种离子___________ 。
(4)Ag+与SCN-反应得到一种白色难溶固体,该物质实际上是一种聚合结构,如图所示。
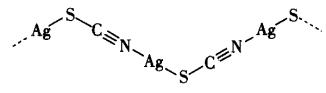
指出该结构中S的杂化方式___________ ,写出该白色固体的最简式___________ 。
(5)Au的原子序数为79,则其在元素周期表中的位置为___________ ;Au与F2和O2在一定条件下可以生成[O2]+[AuF6]-。则该物质的晶体类型为___________ 。
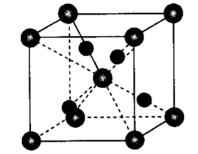
(6)氧化亚铜的晶胞如图,属于立方晶系。其密度为ρg·cm-3,阿伏加德罗常数为NAmol-1,则晶胞参数a=___________ pm,铜与铜原子的最短距离为___________ apm。
(1)写出基态铜原子的价电子排布式
(2)CuSO4在碱性条件下加入双缩脲HN(CONH2)2,会得到紫色物质,该物质为-2价的配位阴离子,其结构如图所示。该反应原理在化学上可以用于检验蛋白质。

该离子中非金属元素的电负性由大到小的排列为
(3)无水Cu(NO3)2在很长的时间内都没有制备成功,因而认为不存在,直到后来利用单质Cu和液态N2O4反应成功制备。已知液态N2O4会发生类似水的自耦电离N2O4⇌NO++
 。
。①写出该反应的化学方程式
②写出与NO+互为等电子体的1种分子
(4)Ag+与SCN-反应得到一种白色难溶固体,该物质实际上是一种聚合结构,如图所示。

指出该结构中S的杂化方式
(5)Au的原子序数为79,则其在元素周期表中的位置为
(6)氧化亚铜的晶胞如图,属于立方晶系。其密度为ρg·cm-3,阿伏加德罗常数为NAmol-1,则晶胞参数a=

您最近一年使用:0次




 )
) )
)

