下列根据实验操作和现象得出结论不正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 室温下,向NaAlO2溶液中滴加NaHCO3溶液 | 有白色絮状沉淀生成 | AlO 结合H+能力比CO 结合H+能力比CO 强 强 |
| B | 向Na2S2O3溶液中滴加稀H2SO4溶液 | 产生气体,生成浅黄色沉淀 | 硫酸表现强氧化性 |
| C | 向盛有1mL0.01mol·L-1AgNO3溶液的试管中滴加5滴0.01mol·L-1的NaCl溶液,再滴加5滴0.01mol·L-1的NaI溶液 | 先有白色沉淀生成,后有黄色沉淀生成 | 此温度下:Ksp(AgCl)>Ksp(AgI) |
| D | 向盛有相同浓度KI3溶液的两支试管中,分别滴加淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀 | 溶液中可能存在平衡:I  I-+I2 I-+I2 |
| A.A | B.B | C.C | D.D |
更新时间:2022-04-20 11:48:40
|
相似题推荐
多选题
|
适中
(0.65)
名校
【推荐1】由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2 在酸性条件下可以产生Cl2。下列关于混盐CaOCl2 的有关判断正确的是 ( )
| A.该混盐中氯元素的化合价为负一价 |
| B.该混盐的水溶液呈中性 |
| C.该混盐与硝酸反应产生1 mol Cl2 时转移1 mol 电子 |
| D.该混盐具有和漂白粉相似的化学性质 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,下列有关离子浓度及pH大小的比较正确的是
A. 浓度相同的下列溶液:① 浓度相同的下列溶液:① ② ② ③ ③ ,溶液浓度由大到小的顺序为②>③>① ,溶液浓度由大到小的顺序为②>③>① |
B.由 的 的 溶液与 溶液与 的 的 溶液等体积混合,其离子浓度不可能是 溶液等体积混合,其离子浓度不可能是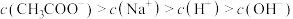 |
C. 的 的 溶液与 溶液与 的盐酸等体积混合,混合溶液的 的盐酸等体积混合,混合溶液的 |
D. 的 的 溶液与 溶液与 的 的 溶液等体积混合,混合溶液的pH范围是 溶液等体积混合,混合溶液的pH范围是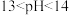 |
您最近一年使用:0次
多选题
|
适中
(0.65)
解题方法
【推荐3】常温下向浓度均为0.10 mol·L-1、体积均为1 mL的NaOH溶液和Na2CO3溶液中分别加水,均稀释至V mL,两种溶液的pH与lg V的变化关系如图所示。下列叙述中错误的是
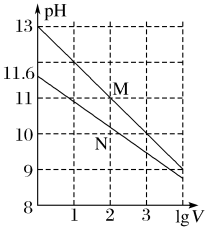
A.Kh1(CO )(Kh1为第一级水解平衡常数)的数量级为10-4 )(Kh1为第一级水解平衡常数)的数量级为10-4 |
| B.曲线M表示Na2CO3溶液的pH随lg V的变化关系 |
C.Na2CO3溶液中存在:c(Na+)>c(CO )>c(OH-)>c(HCO )>c(OH-)>c(HCO )>c(H+) )>c(H+) |
D.若将Na2CO3溶液加热蒸干,由于CO 水解,最终析出的是NaOH固体 水解,最终析出的是NaOH固体 |
您最近一年使用:0次
【推荐1】根据下列实验操作、现象、结论都正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向酸性高锰酸钾溶液中加入Fe3O4粉末,溶液紫色褪去 | 证明Fe3O4中含有二价铁 |
| B | 用惰性电极电解饱和食盐水,将湿润的淀粉碘化钾试纸置于阴极处,试纸变蓝 | 阴极产物含氯气 |
| C | 向盛有2 mL0.1 mol/LNaCl溶液的试管中滴加2滴等浓度的AgNO3溶液,振荡,产生白色沉淀,再滴加4滴等浓度的NaI溶液,产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 利用pH计分别测定饱和Na2CO3溶液和饱和NaHCO3溶液的pH,前者大于后者 | 水解程度: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐2】为完成下列各组实验,所选玻璃仪器和试剂均正确、完整的是(非玻璃仪器任选;不考虑存放试剂的容器)
| 实验 | 玻璃仪器 | 试剂 | |
| A | 证明HClO是弱酸 | 表面皿、玻璃棒 |  NaClO溶液 NaClO溶液 |
| B | 证明HCN和碳酸的酸性强弱 | 玻璃棒、玻璃片 |  NaCN溶液和 NaCN溶液和 Na2CO3溶液 Na2CO3溶液 |
| C | 测定醋酸溶液浓度 | 酸式滴定管、碱式滴定管、锥形瓶、烧杯 | 待测醋酸溶液、标准NaOH溶液、酚酞溶液 |
| D | 证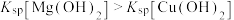 | 试管、胶头滴管 | 含有少量CuCl2的MgCl2溶液、稀氨水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
解题方法
【推荐3】水垢中含有的 CaSO4,可先用 Na2CO3溶液处理,使之转化为疏松、易溶于酸的 CaCO3。某化学兴 趣小组用某浓度的 Na2CO3溶液处理一定量的 CaSO4固体,测得所加 Na2CO3溶液体积与溶液中-lgc(CO32-) 的关系如图所示,已知Ksp(CaSO4)=9×10-6,Ksp(CaCO3)=3×10-9,lg3=0.5,下列说法不正确的是
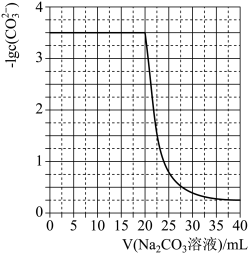

| A.曲线上各点的溶液满足关系式:c(Ca2+)×c(SO42-)=Ksp(CaSO4) |
B.CaSO4(s)+CO32-(aq)  CaCO3(s)+SO42-(aq) K=3×103 CaCO3(s)+SO42-(aq) K=3×103 |
| C.该Na2CO3溶液的浓度为1.5mol·L-1 |
| D.相同条件下,若将Na2CO3溶液的浓度改为原浓度的2倍,则上图曲线整体向上平移1个单位即可 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
解题方法
【推荐1】一瓶不纯的K2CO3粉末,所含杂质可能是KNO3、Ca(NO3)2、KCl、CuCl2、Na2SO4中的一种或几种。为确定其成分,进行如下实验:
(1)取少量该粉末于烧杯中,加入适量蒸馏水,充分搅拌,得无色澄清溶液
(2)在上述无色溶液中加入足量的BaCl2溶液,有白色沉淀生成,过滤,得无色溶液。
(3)取少许(2)中过滤后的无色溶液于试管中,漓加AgNO3溶液有白色沉淀生成。下列说法正确的是
(1)取少量该粉末于烧杯中,加入适量蒸馏水,充分搅拌,得无色澄清溶液
(2)在上述无色溶液中加入足量的BaCl2溶液,有白色沉淀生成,过滤,得无色溶液。
(3)取少许(2)中过滤后的无色溶液于试管中,漓加AgNO3溶液有白色沉淀生成。下列说法正确的是
| A.杂质中肯定不含有Ca(NO3)2、CuCl2 |
| B.杂质中肯定含有KCl、Na2SO4 |
| C.杂质中可能含有KNO3、KCl、Na2SO4 |
| D.杂质中肯定含有KCl,可能含有KNO3、Na2SO4 |
您最近一年使用:0次
多选题
|
适中
(0.65)
【推荐2】将气体X通入 溶液中,无明显现象,继续通入Y气体,有沉淀生成。则X、Y不可能是( )
溶液中,无明显现象,继续通入Y气体,有沉淀生成。则X、Y不可能是( )
 溶液中,无明显现象,继续通入Y气体,有沉淀生成。则X、Y不可能是( )
溶液中,无明显现象,继续通入Y气体,有沉淀生成。则X、Y不可能是( )选项 | X | Y |
A |
|
|
B |
|
|
C |
|
|
D |
|
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次










