 时,向两份
时,向两份 溶液
溶液 中分别滴加浓度均为
中分别滴加浓度均为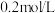 的
的 和
和 溶液。部分离子浓度随溶液体积的变化如图所示,有关说法错误的是
溶液。部分离子浓度随溶液体积的变化如图所示,有关说法错误的是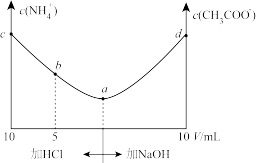
A.水的电离程度: |
B.b点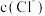 和d点 和d点 存在的关系是 存在的关系是 |
C.c点存在离子浓度关系: |
D.若b点 ,则 ,则 的 的 |
更新时间:2022-05-01 19:26:11
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列溶液中有关微粒的物质的量浓度关系正确的是。
| A.物质的量浓度相等的H2S和NaHS混合溶液中: c(Na+)=2[c(S2-)+c(HS-)+c(H2S)] |
| B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(CH3COO-) >c(Na+)>c(Cl-)>c(CH3COOH) |
| C.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性时:c(Na+) > c(NH4+) > c(SO42-) > c(OH-)=c(H+) |
| D.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中的c(NH4+):①<②<③ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】室温下,向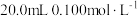 的某弱酸
的某弱酸 的溶液中滴加同浓度的
的溶液中滴加同浓度的 ,过程中
,过程中 随
随 的变化关系如图所示。下列说法正确的是
的变化关系如图所示。下列说法正确的是

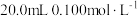 的某弱酸
的某弱酸 的溶液中滴加同浓度的
的溶液中滴加同浓度的 ,过程中
,过程中 随
随 的变化关系如图所示。下列说法正确的是
的变化关系如图所示。下列说法正确的是
A.a到c的过程中,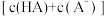 为定值 为定值 | B.a到c的过程中,水的电离程度不断增大 |
C.b点时,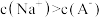 | D.c点时加入碱的体积为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】室温下,向10 mL pH=3的CH3COOH溶液中加入下列物质,对所得溶液的分析正确的是
| 加入的物质 | 对所得溶液的分析 | |
| A | 90 mLH2O | 由水电离出的c(H+)=10-10 mol·L-1 |
| B | 0.1 mol CH3COONa固体 | c(OH-)比原CH3COOH溶液中的大 |
| C | 10 mL pH=1 的H2SO4溶液 | CH3COOH的电离程度不变 |
| D | 10 mL pH=11的NaOH溶液 | c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】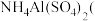 俗名铵明矾
俗名铵明矾 是食品加工中最为快捷的食品添加剂,常用于焙烤食品中;
是食品加工中最为快捷的食品添加剂,常用于焙烤食品中;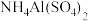 在分析试剂、医药、电子工业中用途广泛。下列有关叙述正确的是
在分析试剂、医药、电子工业中用途广泛。下列有关叙述正确的是
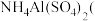 俗名铵明矾
俗名铵明矾 是食品加工中最为快捷的食品添加剂,常用于焙烤食品中;
是食品加工中最为快捷的食品添加剂,常用于焙烤食品中;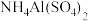 在分析试剂、医药、电子工业中用途广泛。下列有关叙述正确的是
在分析试剂、医药、电子工业中用途广泛。下列有关叙述正确的是A.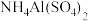 可做净水剂,其理由是水解产物可以杀菌消毒 可做净水剂,其理由是水解产物可以杀菌消毒 |
B.相同条件下,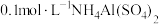 中 中 大于 大于 中 中 |
C.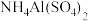 溶液中加入盐酸抑制水解,酸性减弱 溶液中加入盐酸抑制水解,酸性减弱 |
D. 时 时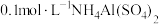 溶液的 溶液的 为 为 ,则溶液中 ,则溶液中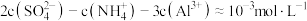 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】乙二胺( )是二元弱碱,分步电离,在溶液中的电离类似于氨。25℃时,向10 mL乙二胺溶液中滴加等浓度的盐酸,微粒的分布系数(平衡时某含氮微粒的浓度与各含氮微粒浓度之和的比值)随溶液pH的变化曲线如图。下列说法正确的是
)是二元弱碱,分步电离,在溶液中的电离类似于氨。25℃时,向10 mL乙二胺溶液中滴加等浓度的盐酸,微粒的分布系数(平衡时某含氮微粒的浓度与各含氮微粒浓度之和的比值)随溶液pH的变化曲线如图。下列说法正确的是

 )是二元弱碱,分步电离,在溶液中的电离类似于氨。25℃时,向10 mL乙二胺溶液中滴加等浓度的盐酸,微粒的分布系数(平衡时某含氮微粒的浓度与各含氮微粒浓度之和的比值)随溶液pH的变化曲线如图。下列说法正确的是
)是二元弱碱,分步电离,在溶液中的电离类似于氨。25℃时,向10 mL乙二胺溶液中滴加等浓度的盐酸,微粒的分布系数(平衡时某含氮微粒的浓度与各含氮微粒浓度之和的比值)随溶液pH的变化曲线如图。下列说法正确的是
A.曲线a代表 的分布系数随溶液pH的变化曲线 的分布系数随溶液pH的变化曲线 |
| B.交点m处对应加入的盐酸的体积约为5 mL |
C.乙二胺的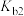 数量级为 数量级为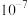 |
D.当溶液中加入10 mL盐酸时,溶液中存在以下关系: |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】室温下,分别取10 mL pH均为2的盐酸、醋酸溶液分别与10mL 0.01 mol• L-1 NaHCO3溶液混合,实验测得产生CO2气体的体积(V)随时间(t)的变化如图所示。下列说法不正确的是


| A.①表示的是盐酸的反应曲线 |
| B.混合后的溶液中:c(CH3COO-)>c(C1-) |
| C.上述混合前三种溶液中水的电离程度:NaHCO3溶液>醋酸溶液=盐酸 |
| D.醋酸和NaHCO3溶液混合后,所得的溶液中:c(CH3COO-)+ c(CH3COOH) = 0.005 mol• L-1 |
您最近一年使用:0次



