C、N、O、Ca、Ba、Cu、Hg等元素及其化合物在工农业生产和生活中有重要用途。请回答下列问题:
(1)基态Cu原子价层电子的轨道表示式为_______ 。
(2)基态气态原子获得一个电子变为气态一价负离子放出的能量称为第一电子亲和能。C、N、O三种元素的第一电子亲和能分别为-121 kJ·mol-1、7 kJ·mol-1、-141kJ·mol-1。请解释N元素第一电子亲和能异常的原因:_______ 。
(3)氨水的主要成分为NH3·H2O,农业上经稀释后可作化肥。
①氨水的施用原则是“一不离土,二不离水”。不离土就是要深施覆土,不离水就是加水稀释,这样做的目的是_______ 。
②NH3和H2O相比,键角较大的是_______ (填化学式),原因是_______ 。
(4)O、Ca、Ba 、Cu、Hg可以形成超导材料HBCO,晶胞结构如图所示。

①晶胞中Ba与Ca均位于体内,晶胞中与Ca距离最近的O原子 有_______ 个 ,Ca原子与Cu原子之间的最短距离为_______ pm。
②设阿伏加德罗常数的值为NA,则晶胞的密度为_______ g·cm-3。
(1)基态Cu原子价层电子的轨道表示式为
(2)基态气态原子获得一个电子变为气态一价负离子放出的能量称为第一电子亲和能。C、N、O三种元素的第一电子亲和能分别为-121 kJ·mol-1、7 kJ·mol-1、-141kJ·mol-1。请解释N元素第一电子亲和能异常的原因:
(3)氨水的主要成分为NH3·H2O,农业上经稀释后可作化肥。
①氨水的施用原则是“一不离土,二不离水”。不离土就是要深施覆土,不离水就是加水稀释,这样做的目的是
②NH3和H2O相比,键角较大的是
(4)O、Ca、Ba 、Cu、Hg可以形成超导材料HBCO,晶胞结构如图所示。

①晶胞中Ba与Ca均位于体内,晶胞中与Ca距离最近的O原子 有
②设阿伏加德罗常数的值为NA,则晶胞的密度为
更新时间:2022-06-04 10:11:19
|
相似题推荐
【推荐1】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)制取MnSO4·H2O并回收单质硫的工艺流程如下:

回答下列问题:
(1)写出基态铁原子价层电子轨道表示式___________ 。
(2)步骤①混合研磨成细粉的主要目的是___________ 。
(3)步骤②浸取时若生成S、MnSO4及Fe2(SO4)3,化学方程式为___________ 。
(4)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入氧化剂___________ (填化学式),步骤⑤所得滤渣为___________ (填化学式)。
(5)步骤⑤所得滤液经过___________ (填操作)可得纯净干燥的MnSO4·H2O。
(6)步骤⑦中(NH4)2Sx+1分解需在90~100℃下进行,该反应除得到产品外,还产生一种酸性和一种碱性气体,写出其化学方程式___________ 。

回答下列问题:
(1)写出基态铁原子价层电子轨道表示式
(2)步骤①混合研磨成细粉的主要目的是
(3)步骤②浸取时若生成S、MnSO4及Fe2(SO4)3,化学方程式为
(4)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入氧化剂
(5)步骤⑤所得滤液经过
(6)步骤⑦中(NH4)2Sx+1分解需在90~100℃下进行,该反应除得到产品外,还产生一种酸性和一种碱性气体,写出其化学方程式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】钯(46Pd)催化剂在有机合成中有着重要的地位。请回答以下问题:
(1)钯与镍是同族元素,它们位于周期表的____ (选填s、p、d、ds、f)区。
(2)四(三苯基膦)钯(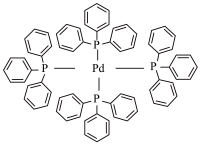 )是一种常见的钯催化剂,也是一种配合物,其配位数为
)是一种常见的钯催化剂,也是一种配合物,其配位数为_____ ,其中“三苯基膦”中磷原子与键合的三个碳原子构成的立体结构为__ 。
(3)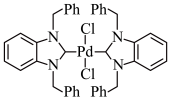 是苯并咪唑类卡宾化合物之一(-Ph代表苯基),常用作有机合成的催化剂,其晶体类型为
是苯并咪唑类卡宾化合物之一(-Ph代表苯基),常用作有机合成的催化剂,其晶体类型为____ 。配体中碳原子的杂化类型有____ ,其中氯原子的价电子轨道表达式为___ 。
(1)钯与镍是同族元素,它们位于周期表的
(2)四(三苯基膦)钯(
 )是一种常见的钯催化剂,也是一种配合物,其配位数为
)是一种常见的钯催化剂,也是一种配合物,其配位数为(3)
 是苯并咪唑类卡宾化合物之一(-Ph代表苯基),常用作有机合成的催化剂,其晶体类型为
是苯并咪唑类卡宾化合物之一(-Ph代表苯基),常用作有机合成的催化剂,其晶体类型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】A、B、C、D、E为主族元素。A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素的最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
(1)C元素简单离子的电子排布图是_______________________ 。
(2)
(3)B与E可形成离子化合物BE5,其阴离子的电子式是_______________ ,BE5含有的化学键类型有_________
(4)下列晶体结构示意图中( 代表阳离子,
代表阳离子, 代表阴离子),能表示C与D形成的离子化合物的晶体结构的是
代表阴离子),能表示C与D形成的离子化合物的晶体结构的是__________ (选填字母标号“a”或“b”)。
(1)C元素简单离子的电子排布图是
(2)
| A.B两元素各有多种氢化物,其电子数为10的氢化物中沸点较高的是________(填化学式)。 |
a.离子键 b.极性键 c.非极性键 d.配位键
(4)下列晶体结构示意图中(
 代表阳离子,
代表阳离子, 代表阴离子),能表示C与D形成的离子化合物的晶体结构的是
代表阴离子),能表示C与D形成的离子化合物的晶体结构的是
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】我国科学家利用Cs2CO3、XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)C、O、Si三种元素电负性由大到小的顺序为___________ ;第一电离能I1(Si)___________ I1(Ge)(填“>”或“<”)。
(2)基态Ge原子价电子排布式为___________ ;SiO2、GeO2具有类似的晶体结构,SiO2熔点较高,其原因是___________
(3)如图为硼酸晶体的片层结构,其中硼原子的杂化方式为___________ 。该晶体中存在的作用力有___________ 。
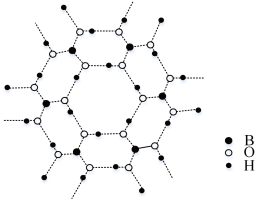
A.共价键B.离子键C.氢键
(4)Fe和Cu可分别与氧元素形成低价态氧化物FeO和Cu2O。
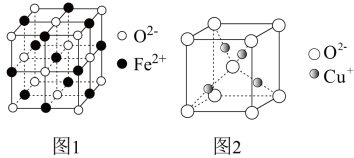
①FeO立方晶胞结构如图1所示,则Fe2+的配位数为___________ 。
②Cu2O立方晶胞结构如图2所示,若晶胞边长为acm,则该晶体的密度为___________ g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加 德罗常数)
(1)C、O、Si三种元素电负性由大到小的顺序为
(2)基态Ge原子价电子排布式为
(3)如图为硼酸晶体的片层结构,其中硼原子的杂化方式为

A.共价键B.离子键C.氢键
(4)Fe和Cu可分别与氧元素形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为
②Cu2O立方晶胞结构如图2所示,若晶胞边长为acm,则该晶体的密度为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素基态原子的价电子排布式为 ;C元素为周期表中最活泼的非金属元素;D元素原子核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素形成的正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层只有一个电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;C元素为周期表中最活泼的非金属元素;D元素原子核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素形成的正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层只有一个电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能_______ (填“<”“>”或“=”)B元素的第一电离能;A、B、C三种元素的电负性由小到大的顺序为_______ (用元素符号表示)。
(2)D元素基态原子的价电子排布式为_______ 。
(3)C元素基态原子的轨道表示式为_______ ;
(4)F元素位于元素周期表的_______ 区,其基态原子的电子排布式为_______ 。
(5)G元素可能的性质是_______(填序号)。
(6)第一电离能:
_______  (填“>”或“<”,下同),其原因是
(填“>”或“<”,下同),其原因是_______ 。
 ;C元素为周期表中最活泼的非金属元素;D元素原子核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素形成的正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层只有一个电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;C元素为周期表中最活泼的非金属元素;D元素原子核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素形成的正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层只有一个电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。(1)A元素的第一电离能
(2)D元素基态原子的价电子排布式为
(3)C元素基态原子的轨道表示式为
(4)F元素位于元素周期表的
(5)G元素可能的性质是_______(填序号)。
| A.其单质可作为半导体材料 | B.其电负性大于磷 |
| C.其原子半径大于锗 | D.其第一电离能小于硒 |

 (填“>”或“<”,下同),其原因是
(填“>”或“<”,下同),其原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】磷化铜(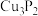 )用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的电子排布式为_______ ;
(2)磷化铜与水作用产生有毒的磷化氢( )。
)。
①P与N同主族,其最高价氧化物对应水化物的酸性:
_______  (填“>”或“<”),从结构的角度说明理由:
(填“>”或“<”),从结构的角度说明理由:_______ 。
②P与N的氢化物空间构型相似, 键角
键角_______  键角(填“>”“<”或“=”)
键角(填“>”“<”或“=”)
(3)硝酸铜是一种重要的化工原料,硝酸铜中N原子的价层电子对数_______ ;硝酸根的空间构型_______ ,硝酸铜中含有的三种元素的第一电离能从大到小顺序是_______ 。
(4)某磷青铜晶胞结构如图所示。

①则其化学式为_______ 。
②该晶体中距离 原子最近的
原子最近的 原子有
原子有_______ 个,这些 原子所呈现的构型为
原子所呈现的构型为_______ 。
③若晶体密度为 ,最近的
,最近的 原子核间距为
原子核间距为_______  (用含
(用含 的代数式表示)。
的代数式表示)。
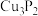 )用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。(1)基态铜原子的电子排布式为
(2)磷化铜与水作用产生有毒的磷化氢(
 )。
)。①P与N同主族,其最高价氧化物对应水化物的酸性:

 (填“>”或“<”),从结构的角度说明理由:
(填“>”或“<”),从结构的角度说明理由:②P与N的氢化物空间构型相似,
 键角
键角 键角(填“>”“<”或“=”)
键角(填“>”“<”或“=”)(3)硝酸铜是一种重要的化工原料,硝酸铜中N原子的价层电子对数
(4)某磷青铜晶胞结构如图所示。

①则其化学式为
②该晶体中距离
 原子最近的
原子最近的 原子有
原子有 原子所呈现的构型为
原子所呈现的构型为③若晶体密度为
 ,最近的
,最近的 原子核间距为
原子核间距为 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】在 溶液中加入氨水直至过量,可以形成配合物
溶液中加入氨水直至过量,可以形成配合物 。
。
(1) 的电离方程式为
的电离方程式为___________ 。
(2) 中,中心离子是
中,中心离子是___________ ,配体是___________ ,配位数为___________ 。
(3) 结构中,若用两个
结构中,若用两个 分子代替两个
分子代替两个 分子,可以得到两种不同结构的配合物离子,由此推测
分子,可以得到两种不同结构的配合物离子,由此推测 的空间构型为
的空间构型为___________ 形。
(4) 组成元素中电负性最大的元素是___________。
组成元素中电负性最大的元素是___________。
(5) 与
与 结合形成配合物离子后,其H-N-H的键角会
结合形成配合物离子后,其H-N-H的键角会___________ 。(填“变大”、“变小”或“不变”)
 溶液中加入氨水直至过量,可以形成配合物
溶液中加入氨水直至过量,可以形成配合物 。
。(1)
 的电离方程式为
的电离方程式为(2)
 中,中心离子是
中,中心离子是(3)
 结构中,若用两个
结构中,若用两个 分子代替两个
分子代替两个 分子,可以得到两种不同结构的配合物离子,由此推测
分子,可以得到两种不同结构的配合物离子,由此推测 的空间构型为
的空间构型为(4)
 组成元素中电负性最大的元素是___________。
组成元素中电负性最大的元素是___________。| A.H | B.N | C.S | D.O |
 与
与 结合形成配合物离子后,其H-N-H的键角会
结合形成配合物离子后,其H-N-H的键角会
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】I.有下列7种晶体,用字母序号回答下列问题:
A.水晶 B.冰醋酸 C.白磷 D.固态氩 E.氯化铵 F.铝 G.金刚石
(1)属于共价晶体的化合物是_______ ;属于离子晶体的是_______ 。
(2)由极性分子构成的晶体是_______ ;属于分子晶体的单质是_______ ;含有共价键的离子晶体是_______ 。
II.回答下列问题
(3)在①苯 ②CH3OH ③HCHO ④CS2⑤CCl4五种有机溶剂中,碳原子采取sp杂化的分子有_______ (填序号)
(4)下列一组微粒中键角按由大到小的顺序排列为_______ 填序号)。
①HCN ②SiF4③SCl2④BF3
(5)基态硫原子的价层电子排布图是_______ 。硫单质的一种结构称被为“王冠结构”,分子中S原子的杂化方式为_______ ,该物质_______ (填“可溶”或“难溶”)于水。

(6)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_______ 、_______ (填标号)。
A.
B.
C.
D.
(7)从电负性角度解释CF3COOH的酸性强于CH3COOH的原因_______ 。
A.水晶 B.冰醋酸 C.白磷 D.固态氩 E.氯化铵 F.铝 G.金刚石
(1)属于共价晶体的化合物是
(2)由极性分子构成的晶体是
II.回答下列问题
(3)在①苯 ②CH3OH ③HCHO ④CS2⑤CCl4五种有机溶剂中,碳原子采取sp杂化的分子有
(4)下列一组微粒中键角按由大到小的顺序排列为
①HCN ②SiF4③SCl2④BF3
(5)基态硫原子的价层电子排布图是

(6)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.

B.

C.

D.

(7)从电负性角度解释CF3COOH的酸性强于CH3COOH的原因
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】氮及其化合物在生产、生活和科技等方面有着重要的应用。请回答下列问题。
(1)氮原子的原子结构示意图为______ 。
(2)氮气的电子式为______ ,在氮气分子中,氮原子之间存在着______ 个σ键和______ 个π键。
(3)磷、氮、氧是周期表中相邻的三种元素,比较:(均填“大于”“小于”或“等于”)
①氮原子的第一电离能______ 磷原子的第一电离能;
②N2分子中N—N键的键长______ 白磷分子中P—P键的键长。
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述原因是______ 。
(1)氮原子的原子结构示意图为
(2)氮气的电子式为
(3)磷、氮、氧是周期表中相邻的三种元素,比较:(均填“大于”“小于”或“等于”)
①氮原子的第一电离能
②N2分子中N—N键的键长
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】氮元素可以形成很多重要的化合物。回答下列问题:
(1) 分子中氮原子和氢原子的价电子排布图分别为
分子中氮原子和氢原子的价电子排布图分别为___________ (填字母序号)。
a. b.
b. c.
c. d.
d.
(2) 和
和 分子中均含有以
分子中均含有以 原子为中心原子的大
原子为中心原子的大 健
健 。
。
① 分子中
分子中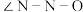
___________  分子中
分子中 (
(
填“>”、“<”或“=”);
②实验测定 分子中氮氮键键长为112.6pm、氮氧键键长为118.6pm,且原子均满足最外层
分子中氮氮键键长为112.6pm、氮氧键键长为118.6pm,且原子均满足最外层 稳定结构。写出
稳定结构。写出 分子的结构式
分子的结构式___________ ;
(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列氮的氧化物属于顺磁性物质的是___________ 。
a.NO b.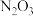 c.
c. d.
d.
(4)硼氮化合物有多种晶型,其中六方氮化硼(类似石墨结构-左图)和立方氮化硼(类似金刚石结构-右图)如图所示。

①下列说法正确的是___________ ;
a.六方氮化硼是混合晶体,立方氮化硼是共价晶体,熔点都很高
b. 的电负性大于
的电负性大于 ,
, 电子集中在
电子集中在 原子上,因此六方氮化硼是电绝缘体
原子上,因此六方氮化硼是电绝缘体
c.氮硼键键长:六方氮化硼>立方氮化硼
d. 立方氮化硼晶胞中含有
立方氮化硼晶胞中含有 键的数目为
键的数目为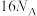
②立方氮化硼中“ ”键键长为
”键键长为 (
( ),
), 表示阿伏伽德罗常数的值。立方氮化硼的密度为
表示阿伏伽德罗常数的值。立方氮化硼的密度为___________  (写表达式)。
(写表达式)。
(1)
 分子中氮原子和氢原子的价电子排布图分别为
分子中氮原子和氢原子的价电子排布图分别为a.
 b.
b. c.
c. d.
d.
(2)
 和
和 分子中均含有以
分子中均含有以 原子为中心原子的大
原子为中心原子的大 健
健 。
。①
 分子中
分子中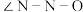
 分子中
分子中 (
(填“>”、“<”或“=”);
②实验测定
 分子中氮氮键键长为112.6pm、氮氧键键长为118.6pm,且原子均满足最外层
分子中氮氮键键长为112.6pm、氮氧键键长为118.6pm,且原子均满足最外层 稳定结构。写出
稳定结构。写出 分子的结构式
分子的结构式(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列氮的氧化物属于顺磁性物质的是
a.NO b.
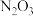 c.
c. d.
d.
(4)硼氮化合物有多种晶型,其中六方氮化硼(类似石墨结构-左图)和立方氮化硼(类似金刚石结构-右图)如图所示。

①下列说法正确的是
a.六方氮化硼是混合晶体,立方氮化硼是共价晶体,熔点都很高
b.
 的电负性大于
的电负性大于 ,
, 电子集中在
电子集中在 原子上,因此六方氮化硼是电绝缘体
原子上,因此六方氮化硼是电绝缘体c.氮硼键键长:六方氮化硼>立方氮化硼
d.
 立方氮化硼晶胞中含有
立方氮化硼晶胞中含有 键的数目为
键的数目为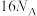
②立方氮化硼中“
 ”键键长为
”键键长为 (
( ),
), 表示阿伏伽德罗常数的值。立方氮化硼的密度为
表示阿伏伽德罗常数的值。立方氮化硼的密度为 (写表达式)。
(写表达式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15. 2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。
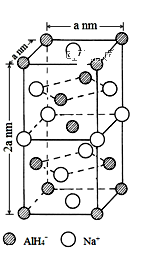
(1)基态Ti原子的价电子轨道排布图为___________ 。
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于_____ 晶体,其电子式为____________ 。
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为______________ (标明配位键)
(4)AlH4-中,Al的轨道杂化方式为_______ ;例举与AlH4-空间构型相同的两种离子_________ (填化学式)。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有______ 个;NaAlH4晶体的密度为______________ g·cm-3(用含a的代数式表示)。

(1)基态Ti原子的价电子轨道排布图为
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为
(4)AlH4-中,Al的轨道杂化方式为
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
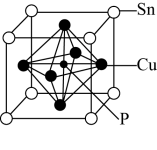
【推荐3】碳(C)、铜(Cu)、锡(Sn)及其化合物有许多用途。回答下列问题。
(1)在元素周期表里,锡和碳同族,锡位于第五周期。基态锡原子的最外层电子排布式为_______ 。
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,P、S的第二电离能(I2)的大小关系为I2(P)___ I2(S)(填“>”、“<”或“=”),原因是_ 。PH3分子的热稳定性比NH3______ (填“强”或“弱”)。
(3)1mol苯中含 键的数目为
键的数目为______ 。CH3CH2COOH中C的杂化方式有______ ;
(4)磷青铜晶体的晶胞结构如图所示,该晶体中P原子与最近的Cu原子的核间距为anm,该晶体中P原子位于由铜原子形成的正八面体的空隙中,则该正八面体的边长为__________ nm,该晶体密度为______ g cm-3(用含NA的代数式表示)。
cm-3(用含NA的代数式表示)。

(1)在元素周期表里,锡和碳同族,锡位于第五周期。基态锡原子的最外层电子排布式为
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,P、S的第二电离能(I2)的大小关系为I2(P)
(3)1mol苯中含
 键的数目为
键的数目为(4)磷青铜晶体的晶胞结构如图所示,该晶体中P原子与最近的Cu原子的核间距为anm,该晶体中P原子位于由铜原子形成的正八面体的空隙中,则该正八面体的边长为
 cm-3(用含NA的代数式表示)。
cm-3(用含NA的代数式表示)。
您最近一年使用:0次



