已知常温下浓度为0.1 mol·L-1的下列溶液的pH如表所示:
下列有关说法正确的是
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A.加热0.1 mol·L-1 NaF溶液测其pH,pH小于7.5 |
B.0.1 mol·L-1 Na2CO3溶液中:c(OH- )-c(H+ )=c(HCO )+c(H2CO3) )+c(H2CO3) |
| C.根据上表数据得出三种酸电离平衡常数大小关系为:Ka (HF)> Ka(HClO)> Ka2(H2CO3) |
| D.pH=2的HF溶液与pH=12的NaOH溶液以体积比1 : 1混合,则有c(H+ )=c(OH-) 。 |
更新时间:2022-08-28 08:21:13
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】常温下,向10mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电能力变化如图。下列分析不正确的是

| A.a~b点导电能力增强,说明HR为弱酸 |
| B.b点溶液pH=7,此时酸碱恰好中和 |
C.c点溶液存在c(NH )>c(R-)、c(OH-)>c(H+) )>c(R-)、c(OH-)>c(H+) |
| D.b、c两点水的电离程度:b<c |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】某温度下,测得0.01mol•L-1NaOH溶液的pH为11。在该温度下,将pH=4的HCl溶液与pH=11的Ba(OH)2溶液混合并保持恒温,欲使混合溶液呈中性,则HCl与Ba(OH)2溶液的体积之比为
| A.1:10 | B.10:1 | C.100:1 | D.1:100 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列溶液中有关物质的量浓度关系正确的是
A. 的 的 溶液与 溶液与 的 的 溶液任意比例混合:c(Cl-)=c(Na+) 溶液任意比例混合:c(Cl-)=c(Na+) |
B.pH相等的 、 、 和 和 三种溶液: 三种溶液: |
C.物质的量浓度相等 和 和 溶液等体积混合: 溶液等体积混合: |
D.0.1 的 的 溶液,其 溶液,其 : : |
您最近一年使用:0次
【推荐2】由下列实验操作及现象得到的结论正确的是
| 选项 | 实验操作及现象 | 结论 |
| A | 向某 溶液中滴加几滴 溶液中滴加几滴 溶液,溶液变红色 溶液,溶液变红色 |  溶液变质了 溶液变质了 |
| B | 向盛有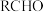 溶液的试管中滴加浓溴水,充分振荡后静置,最终得到无色溶液 溶液的试管中滴加浓溴水,充分振荡后静置,最终得到无色溶液 |  是不饱和烃基 是不饱和烃基 |
| C | 向某品牌的食盐溶液中加入几滴淀粉溶液,溶液不变蓝色 | 该食盐不是加碘盐 |
| D | 向 溶液中滴加2滴酚酞溶液,溶液变红色 溶液中滴加2滴酚酞溶液,溶液变红色 | 含有杂质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】室温下,下列溶液中粒子浓度关系正确的是
A. 溶液: 溶液: |
B. 溶液: 溶液: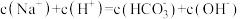 |
C. 溶液: 溶液: |
D. 溶液: 溶液: |
您最近一年使用:0次
单选题
|
适中
(0.65)
真题
【推荐2】在浓度为 的
的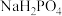 溶液中,如下说法正确的是
溶液中,如下说法正确的是
 的
的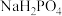 溶液中,如下说法正确的是
溶液中,如下说法正确的是A.溶液中浓度最大的离子是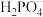 |
B.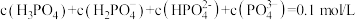 |
C.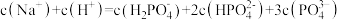 |
D.磷酸第二步电离平衡的平衡常数表达式为 |
您最近一年使用:0次


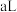 溶液④与
溶液④与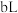 溶液②混合后,若所得溶液的
溶液②混合后,若所得溶液的 ,则
,则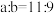

 的NaOH溶液分别滴定体积均为20.00mL、浓度均为0.050
的NaOH溶液分别滴定体积均为20.00mL、浓度均为0.050 的盐酸、磷酸及谷氨酸
的盐酸、磷酸及谷氨酸 ,滴定曲线如图所示。下列说法正确的是
,滴定曲线如图所示。下列说法正确的是

 时,
时,
 的第一电离平衡常数
的第一电离平衡常数 的数量级不同
的数量级不同 溶液中:
溶液中:


