利用“萨巴蒂尔反应”,空间站的水气整合系统将CO2转化为CH4和水蒸气,配合O2
生成系统可实现O2的再生。回答下列问题:
I.萨巴蒂尔反应为CO2(g)十4H2(g) CH4(g) + 2H2O(g) ∆H
CH4(g) + 2H2O(g) ∆H
(1)已知25°C和101 kPa时,①H2(g)的燃烧热△H=- 285. 8 kJ●mol-1;
②CH4(g)的燃烧热∆H=- 890. 3 kJ●mol-1;
③H2O(g)=H2O (l) ∆H=-44.0 kJ●mol-1。
则萨巴蒂尔反应的∆H=_______ kJ●mol-1。
(2)萨巴蒂尔反应的前三步反应历程如图所示,其中吸附在催化剂Pt/SiO2表面的物质用“*”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会_______ (填“放出”或“吸收”)热量,反应历程中最小能垒(活化能)步骤的化学方程式为_______ 。

II.CO2在一定条件下能与H2O发生氧再生反应:CO2(g) +2H2O(g) CH4(g)+ 2O2(g) ∆H=+802.3 kJ●mol-1
CH4(g)+ 2O2(g) ∆H=+802.3 kJ●mol-1
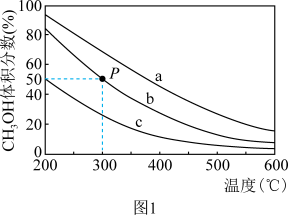
(3)恒压p0条件下,按c(CO2) : c(H2O)=1 : 2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图所示。350 ℃时,该反应的平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数)。为了提高CO2的转化率,除升高温度外,还可采取的措施为_______ (写出一条)。

(4)氧再生反应还可以通过酸性条件下半导体光催化转化实现,反应机理如图甲所示:

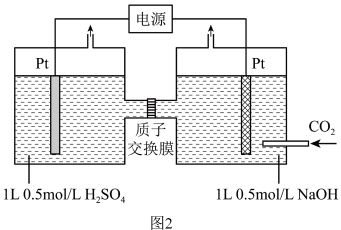
①光催化CO2转化为CH4时,阴极的电极反应式为_______ 。
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图乙所示。300~400℃之间,CH4生成速率加快的原因是_______ 。

(5)氧再生反应所需的能量可由合成氨反应提供。合成氨反应的焓变和熵变如下:N2 (g) +3H2(g) 2NH3(g) ∆H= -92.4 kJ●mol-1 ∆S=-200J·K-1●mol-1常温(298 K)下,合成氨反应的自由能∆G=
2NH3(g) ∆H= -92.4 kJ●mol-1 ∆S=-200J·K-1●mol-1常温(298 K)下,合成氨反应的自由能∆G=_______ kJ ●mol-1, 合成氨反应在常温下_______ (填“能”或“不能”)自发进行。
生成系统可实现O2的再生。回答下列问题:
I.萨巴蒂尔反应为CO2(g)十4H2(g)
 CH4(g) + 2H2O(g) ∆H
CH4(g) + 2H2O(g) ∆H(1)已知25°C和101 kPa时,①H2(g)的燃烧热△H=- 285. 8 kJ●mol-1;
②CH4(g)的燃烧热∆H=- 890. 3 kJ●mol-1;
③H2O(g)=H2O (l) ∆H=-44.0 kJ●mol-1。
则萨巴蒂尔反应的∆H=
(2)萨巴蒂尔反应的前三步反应历程如图所示,其中吸附在催化剂Pt/SiO2表面的物质用“*”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会

II.CO2在一定条件下能与H2O发生氧再生反应:CO2(g) +2H2O(g)
 CH4(g)+ 2O2(g) ∆H=+802.3 kJ●mol-1
CH4(g)+ 2O2(g) ∆H=+802.3 kJ●mol-1(3)恒压p0条件下,按c(CO2) : c(H2O)=1 : 2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图所示。350 ℃时,该反应的平衡常数Kp=

(4)氧再生反应还可以通过酸性条件下半导体光催化转化实现,反应机理如图甲所示:

①光催化CO2转化为CH4时,阴极的电极反应式为
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图乙所示。300~400℃之间,CH4生成速率加快的原因是

(5)氧再生反应所需的能量可由合成氨反应提供。合成氨反应的焓变和熵变如下:N2 (g) +3H2(g)
 2NH3(g) ∆H= -92.4 kJ●mol-1 ∆S=-200J·K-1●mol-1常温(298 K)下,合成氨反应的自由能∆G=
2NH3(g) ∆H= -92.4 kJ●mol-1 ∆S=-200J·K-1●mol-1常温(298 K)下,合成氨反应的自由能∆G=
更新时间:2022-09-16 09:37:18
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】二氧化碳是潜在的碳资源,无论是天然的二氧化碳气藏(气体矿藏),还是各种炉气、尾气、副产气,进行分离回收合理利用,意义重大。
(1)CO2在Cu—ZnO的催化下,同时发生反应Ⅰ、Ⅱ,是解决温室效应和能源短缺的重要手段。(已知活化能EaⅠ<EaⅡ)
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H1
CH3OH(g)+H2O(g) ∆H1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ∆H2=+41.1kJ/mol
CO(g)+H2O(g) ∆H2=+41.1kJ/mol
①反应Ⅰ能自发进行的条件是:___ 。
②保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量及总压强如表:
若反应I、II均达平衡时,p0=1.4p,则表中n=___ ;反应Ⅰ的平衡常数Kp=___ (kPa)-2。(用含p的式子表示)
③若β=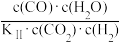 (KⅡ为反应Ⅱ平衡常数),在5Mp条件下,测得入口处β≈0,出口处β>1,试分析β变化的原因:
(KⅡ为反应Ⅱ平衡常数),在5Mp条件下,测得入口处β≈0,出口处β>1,试分析β变化的原因:___ 。
④在③条件下实验测得出口处甲醇浓度与温度关系如图,在图中画出相同条件下空速(气体通过催化剂的流速)增大时,出口处甲醇浓度与温度的关系曲线___ (该温度变化范围内,催化剂活性几乎不变)。
(2)某科学小组100mL锥形瓶中依次加入H2O2溶液、KIO3溶液、H2SO4溶液和MnSO4溶液(催化剂)各10mL,充分振荡后加入3—5滴淀粉溶液,摇匀,得到如图,初始阶段有大量气体产生,查资料知含Mn3+溶液呈黄色,碘遇到淀粉显蓝色,该反应一段时间后停止。

该小组同学根据资料还原了该反应的主要过程,请将下列反应补充完整:
①2IO +6H2O2=2I-+3O2+12H2O
+6H2O2=2I-+3O2+12H2O
②:___ 。
③:___ 。
④5H2O2+I2=2IO +4H2O+2H+
+4H2O+2H+
(1)CO2在Cu—ZnO的催化下,同时发生反应Ⅰ、Ⅱ,是解决温室效应和能源短缺的重要手段。(已知活化能EaⅠ<EaⅡ)
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H1
CH3OH(g)+H2O(g) ∆H1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2=+41.1kJ/mol
CO(g)+H2O(g) ∆H2=+41.1kJ/mol①反应Ⅰ能自发进行的条件是:
②保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量及总压强如表:
| CO2 | H2 | CH3OH(g) | CO | H2O(g) | 总压强/kPa | |
| 起始/mol | 0.5 | 0.9 | 0 | 0 | 0 | P0 |
| 平衡/mol | n | 0.3 | p |
若反应I、II均达平衡时,p0=1.4p,则表中n=
③若β=
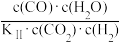 (KⅡ为反应Ⅱ平衡常数),在5Mp条件下,测得入口处β≈0,出口处β>1,试分析β变化的原因:
(KⅡ为反应Ⅱ平衡常数),在5Mp条件下,测得入口处β≈0,出口处β>1,试分析β变化的原因:④在③条件下实验测得出口处甲醇浓度与温度关系如图,在图中画出相同条件下空速(气体通过催化剂的流速)增大时,出口处甲醇浓度与温度的关系曲线

(2)某科学小组100mL锥形瓶中依次加入H2O2溶液、KIO3溶液、H2SO4溶液和MnSO4溶液(催化剂)各10mL,充分振荡后加入3—5滴淀粉溶液,摇匀,得到如图,初始阶段有大量气体产生,查资料知含Mn3+溶液呈黄色,碘遇到淀粉显蓝色,该反应一段时间后停止。

该小组同学根据资料还原了该反应的主要过程,请将下列反应补充完整:
①2IO
 +6H2O2=2I-+3O2+12H2O
+6H2O2=2I-+3O2+12H2O②:
③:
④5H2O2+I2=2IO
 +4H2O+2H+
+4H2O+2H+
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】氢能源是最具应用前景的能源之一。甲烷-水蒸气催化重整制氢(SMR)是一种制高纯氢的方法之一,其涉及的主要反应如下:
反应Ⅰ: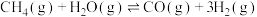
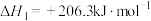
反应Ⅱ: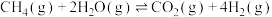

反应Ⅲ: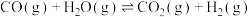
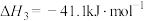
回答下列问题:
(1)反应Ⅱ能自发进行的条件是_______ 。
(2)一定温度下,向某容积为1L的恒容容器中按照水碳比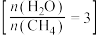 充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。
充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。
①下列说法不正确 的是_______ 。
A.为防止催化剂中毒和安全事故发生,需对原料气进行脱硫等净化处理
B.提高水碳比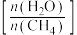 ,有利于提高H2的产率
,有利于提高H2的产率
C.其他条件不变,压缩容器体积,反应Ⅱ的平衡不发生移动
D.以Ni/γ-Al2O3作催化剂,降低反应活化能,提高反应速率和原料平衡利用率
②反应Ⅲ的平衡常数K=_______ (用含a,m,n的代数式表示)。
(3)650((局部温度过高会造成积碳)、按照一定流速通入原料气,当水碳比[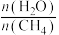 ]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示:
]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示:_______ 。
②实验时发现t1min后CO2的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是_______ (用化学反应方程式表示)。
(4)该反应常采用钯膜分离技(可选择性地让某气体通过而离开体系),其机理如图所示,其中过程2: ,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法
,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法不正确 的是_______。
反应Ⅰ:
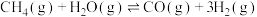
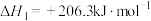
反应Ⅱ:
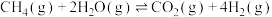

反应Ⅲ:
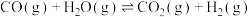
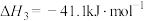
回答下列问题:
(1)反应Ⅱ能自发进行的条件是
(2)一定温度下,向某容积为1L的恒容容器中按照水碳比
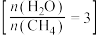 充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。
充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。①下列说法
A.为防止催化剂中毒和安全事故发生,需对原料气进行脱硫等净化处理
B.提高水碳比
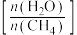 ,有利于提高H2的产率
,有利于提高H2的产率C.其他条件不变,压缩容器体积,反应Ⅱ的平衡不发生移动
D.以Ni/γ-Al2O3作催化剂,降低反应活化能,提高反应速率和原料平衡利用率
②反应Ⅲ的平衡常数K=
(3)650((局部温度过高会造成积碳)、按照一定流速通入原料气,当水碳比[
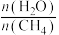 ]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示:
]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示: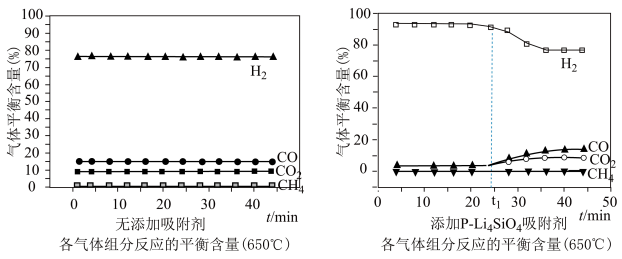
②实验时发现t1min后CO2的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是
(4)该反应常采用钯膜分离技(可选择性地让某气体通过而离开体系),其机理如图所示,其中过程2:
 ,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法
,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法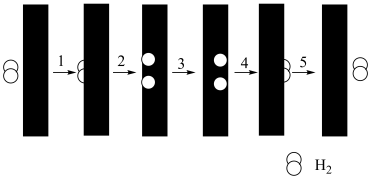
| A.钯膜对H2分子的透过具有选择性 |
B.过程4的 |
| C.采用钯膜分离技术可以提高原料的利用率 |
| D.常用N2将过程5中的H2吹扫出反应器而促进反应 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】CuCl是生产印刷颜料酞菁蓝的重要原料,工业上可用一种低品位铜矿(主要成分CuS、Cu2S、CuO、Fe2O3、FeO 及其他非酸溶性杂质)和软锰矿(主要成分为MnO2 和其他非酸溶性杂质)来进行生产,过程如下:
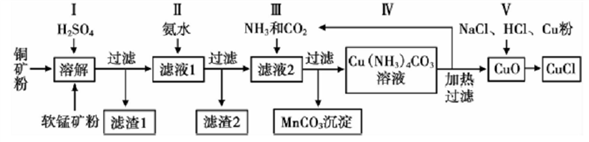
回答下列问题:
(1)步骤Ⅰ中反应较多,下列反应是其中之一:Cu2S+2MnO2+4H2SO4=2CuSO4+2MnSO4+4H2O+S, 该反应的氧化产物为____________________ (填化学式)。
(2)为确定滤液1中是否含有Fe2+,首先用有机萃取剂除去溶液中MnSO4,再取下层水溶液进行检测,所用试剂为_____________________ 。
(3)步骤Ⅱ加入氨水控制溶液的pH 为5左右,目的是______________________ 。
(4)为模拟步骤Ⅲ的生产过程,某同学设计如下实验,下列有关叙述正确的是_____________ 。
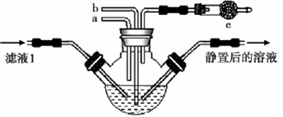
A.a 通入CO2,然后b 通入NH3;c中放碱石灰
B.b通入NH3,然后a通入CO2;c中放碱石灰
C.a通入NH3,然后b 通入CO2;c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a 通入NH3;c中放蘸稀硫酸|的脱脂棉
(5)步骤Ⅳ的滤液中主要成分X 是步骤Ⅱ和步骤Ⅲ都有的产物,可以回收作为肥料使用, 该肥料_______ ( 填“可以”或“不可以”)与草木灰(有效成分K2CO3) 共用,简述原因:__________ 。
(6)已知CuCl 为难溶于水的白色沉淀,写出步骤Ⅴ发生反应的离子方程式:_____________ 。

回答下列问题:
(1)步骤Ⅰ中反应较多,下列反应是其中之一:Cu2S+2MnO2+4H2SO4=2CuSO4+2MnSO4+4H2O+S, 该反应的氧化产物为
(2)为确定滤液1中是否含有Fe2+,首先用有机萃取剂除去溶液中MnSO4,再取下层水溶液进行检测,所用试剂为
(3)步骤Ⅱ加入氨水控制溶液的pH 为5左右,目的是
(4)为模拟步骤Ⅲ的生产过程,某同学设计如下实验,下列有关叙述正确的是

A.a 通入CO2,然后b 通入NH3;c中放碱石灰
B.b通入NH3,然后a通入CO2;c中放碱石灰
C.a通入NH3,然后b 通入CO2;c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a 通入NH3;c中放蘸稀硫酸|的脱脂棉
(5)步骤Ⅳ的滤液中主要成分X 是步骤Ⅱ和步骤Ⅲ都有的产物,可以回收作为肥料使用, 该肥料
(6)已知CuCl 为难溶于水的白色沉淀,写出步骤Ⅴ发生反应的离子方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲醇来源丰富、价格低廉,是一种重要的化工原料,有着重要的用途和应用前景。
Ⅰ.工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H = -91 kJ/mol。
CH3OH(g) △H = -91 kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = -580kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H =__________ 。
(2)若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),下列表示该反应
CH3OH(g),下列表示该反应没有 达到平衡状态的有__________(填字母序号)。
Ⅱ.制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g) H2(g)+ CO2(g) △H<0,某温度下该反应达到平衡时,c(H2)·c(CO2)= c(CO)·c(H2O),若起始时c(CO)=1 mol/L-1,c(H2O)=1 mol/L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应达到平衡时,c(H2)·c(CO2)= c(CO)·c(H2O),若起始时c(CO)=1 mol/L-1,c(H2O)=1 mol/L-1,试回答下列问题:
(3)该温度下,反应进行一阶段时间后,测得H2的浓度为0.5 mol/L-1,则此时该反应v(正)__________ v(逆)(填“>”、“<”或“=”);
(4)若反应温度不变,达到平衡后,H2O的转化率为________ 。
Ⅲ.某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。
(5)试想该电池工作时,OH-向_______ 极移动(填“负”或“正”);
(6)工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为______________________ ,总反应的化学方程式为______________________ 。
Ⅰ.工业生产甲醇的常用方法是:CO(g)+2H2(g)
 CH3OH(g) △H = -91 kJ/mol。
CH3OH(g) △H = -91 kJ/mol。已知:2H2(g)+O2(g)=2H2O(l) △H = -580kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H =
(2)若在恒温恒容的容器内进行反应CO(g)+2H2(g)
 CH3OH(g),下列表示该反应
CH3OH(g),下列表示该反应| A.CO百分含量保持不变 | B.容器中混合气体的密度不变化 |
| C.有1个H-H键生成的同时有 3个C-H键生成 | D.容器中混合气体的压强不变化 |
Ⅱ.制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)
 H2(g)+ CO2(g) △H<0,某温度下该反应达到平衡时,c(H2)·c(CO2)= c(CO)·c(H2O),若起始时c(CO)=1 mol/L-1,c(H2O)=1 mol/L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应达到平衡时,c(H2)·c(CO2)= c(CO)·c(H2O),若起始时c(CO)=1 mol/L-1,c(H2O)=1 mol/L-1,试回答下列问题:(3)该温度下,反应进行一阶段时间后,测得H2的浓度为0.5 mol/L-1,则此时该反应v(正)
(4)若反应温度不变,达到平衡后,H2O的转化率为
Ⅲ.某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。
(5)试想该电池工作时,OH-向
(6)工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
真题
解题方法
【推荐2】下表列出了3种燃煤烟气脱硫方法的原理。
(1) 方法Ⅰ中氨水吸收燃煤烟气中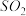 的化学反应为:
的化学反应为:

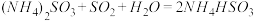
能提高燃煤烟气中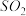 去除率的措施有
去除率的措施有__________ (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D. 通入空气使HSO3-转化为SO42-
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的 ,原因是
,原因是________ (用离子方程式表示)。
(2)方法Ⅱ重要发生了下列反应:
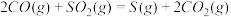 ∆H=8.0kJ/mol
∆H=8.0kJ/mol
 ∆H=90.4kJ/mol
∆H=90.4kJ/mol
 ∆H=-566.0kJ/mol
∆H=-566.0kJ/mol
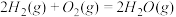 ∆H=-483.6kJ/mol
∆H=-483.6kJ/mol
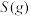 与
与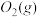 反应生成
反应生成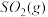 的热化学方程式为
的热化学方程式为_____________ 。
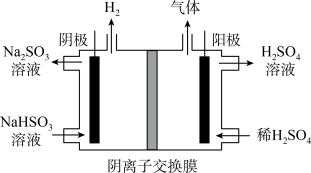
(3) 方法Ⅲ中用惰性电极电解 溶液的装置如上图所示。阳极区放出气体的成分为
溶液的装置如上图所示。阳极区放出气体的成分为______________ 。(填化学式)
| 方法I | 用氨水将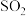 转化为 转化为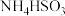 ,再氧化成( ,再氧化成(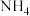 ) )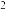 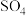 |
| 方法II | 用生物质热解气(主要成分CO、 、 、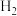 )将 )将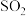 在高温下还原成单质硫 在高温下还原成单质硫 |
| 方法III | 用 溶液吸收 溶液吸收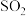 ,再经电解转化为 ,再经电解转化为 |
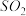 的化学反应为:
的化学反应为:
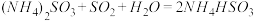
能提高燃煤烟气中
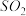 去除率的措施有
去除率的措施有A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D. 通入空气使HSO3-转化为SO42-
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的
 ,原因是
,原因是(2)方法Ⅱ重要发生了下列反应:
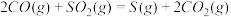 ∆H=8.0kJ/mol
∆H=8.0kJ/mol ∆H=90.4kJ/mol
∆H=90.4kJ/mol ∆H=-566.0kJ/mol
∆H=-566.0kJ/mol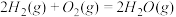 ∆H=-483.6kJ/mol
∆H=-483.6kJ/mol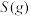 与
与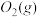 反应生成
反应生成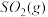 的热化学方程式为
的热化学方程式为
(3) 方法Ⅲ中用惰性电极电解
 溶液的装置如上图所示。阳极区放出气体的成分为
溶液的装置如上图所示。阳极区放出气体的成分为
您最近一年使用:0次
【推荐3】Ⅰ.为减少碳排放,科学家提出利用CO2和H2反应合成甲醇,其反应原理为CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
(1)上述反应常用CuO和ZnO的混合物作催化剂。经研究发现,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率有明显影响。实验数据如表所示:
根据数据表判断,催化剂中CuO的最佳质量分数为________ 。
(2)已知:①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1=-41 kJ·mol-1;
CO2(g)+H2(g) ΔH1=-41 kJ·mol-1;
②CO(g)+2H2(g)===CH3OH(g)ΔH2=-91 kJ·mol-1。
写出由CO2和H2制备甲醇蒸气并产生水蒸气的热化学方程式:_________________ 。
(3)甲醇是清洁能源。某甲醇燃料电池的电解质为稀硫酸,其能量密度为5.93 kW·h·kg-1。该电池的负极反应式为______________ 。若甲醇的燃烧热为ΔH=-726.5 kJ·mol-1,该电池的能量利用率为________ (结果精确到小数点后1位数字)。(已知1 kW·h=3.6×106 J)
Ⅱ.利用CO和H2在催化剂的作用下合成甲醇,发生如下反应:CO(g)+2H2(g) CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 mol H2,测得不同温度下CO的平衡转化率如图2所示。
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 mol H2,测得不同温度下CO的平衡转化率如图2所示。

(1)该反应的ΔH________ (填“>”、“<”或“=”,后同)0,p1________ p2。
(2)达到平衡时,反应速率:A点________ B点。平衡常数:C点________ D点。
(3)在C点时,CO的转化率为________ 。
(4)L、M两点容器内压强:p(M)________ 2p(L)。
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。(1)上述反应常用CuO和ZnO的混合物作催化剂。经研究发现,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率有明显影响。实验数据如表所示:
w(CuO) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
CH3OH的产率 | 20% | 30% | 35% | 50% | 65% | 60% | 55% | 54% | 50% | 45% |
CO2的 转化率 | 10% | 12% | 15% | 20% | 45% | 42% | 40% | 36% | 30% | 15% |
根据数据表判断,催化剂中CuO的最佳质量分数为
(2)已知:①CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH1=-41 kJ·mol-1;
CO2(g)+H2(g) ΔH1=-41 kJ·mol-1;②CO(g)+2H2(g)===CH3OH(g)ΔH2=-91 kJ·mol-1。
写出由CO2和H2制备甲醇蒸气并产生水蒸气的热化学方程式:
(3)甲醇是清洁能源。某甲醇燃料电池的电解质为稀硫酸,其能量密度为5.93 kW·h·kg-1。该电池的负极反应式为
Ⅱ.利用CO和H2在催化剂的作用下合成甲醇,发生如下反应:CO(g)+2H2(g)
 CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 mol H2,测得不同温度下CO的平衡转化率如图2所示。
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 mol H2,测得不同温度下CO的平衡转化率如图2所示。
(1)该反应的ΔH
(2)达到平衡时,反应速率:A点
(3)在C点时,CO的转化率为
(4)L、M两点容器内压强:p(M)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】2021年3月5日,国务院政府工作报告中指出,扎实做好碳达峰、碳中和各项工作。为了达到碳中和,研发二氧化碳的利用技术成为热点。
(1)CH4—CO2催化重整可得到合成气(CO和H2),其工艺过程中涉及如下反应:
反应①:CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.2kJ·mol-1
CO(g)+H2O(g) △H1=+41.2kJ·mol-1
反应②:CH4(g)+ O2(g)
O2(g) CO(g)+2H2(g) △H2=-36.0kJ·mol-1
CO(g)+2H2(g) △H2=-36.0kJ·mol-1
反应③: O2(g)+H2(g)
O2(g)+H2(g) H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
则反应④:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H4=
2CO(g)+2H2(g) △H4=__ kJ·mol-1
(2)在催化剂作用下合成气可发生反应:CO(g)+2H2(g) CH3OH(g),在a、b、c容积不等的恒容密闭容器中(其中容器b容积为1L),均充入0.1molCO和0.2molH2,充分反应后测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图1所示:
CH3OH(g),在a、b、c容积不等的恒容密闭容器中(其中容器b容积为1L),均充入0.1molCO和0.2molH2,充分反应后测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图1所示:
①容器的容积a___ c(填“>”“<”或“=”)。
②P点时,H2的转化率为____ ;若其他条件不变,将恒容密闭容器改为恒压密闭容器,平衡后H2的转化率将____ (填“增大”、“减小”或“不变”)。
③当温度为300℃时,该反应的化学平衡常数K=____ 。
(3)利用电化学方法可以将CO2有效地转化为HCOO-,装置如图2所示。
①在该装置中,右侧Pt电极的电极反应式为____ 。
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率(电解效率=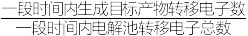 ×100%),标准状况下,当阳极生成氧气体积为448mL时,测得阴极区内的c(HCOO-)=0.03mol/L,电解效率为
×100%),标准状况下,当阳极生成氧气体积为448mL时,测得阴极区内的c(HCOO-)=0.03mol/L,电解效率为____ (忽略电解前后溶液的体积变化)。
(1)CH4—CO2催化重整可得到合成气(CO和H2),其工艺过程中涉及如下反应:
反应①:CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41.2kJ·mol-1
CO(g)+H2O(g) △H1=+41.2kJ·mol-1反应②:CH4(g)+
 O2(g)
O2(g) CO(g)+2H2(g) △H2=-36.0kJ·mol-1
CO(g)+2H2(g) △H2=-36.0kJ·mol-1反应③:
 O2(g)+H2(g)
O2(g)+H2(g) H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1则反应④:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H4=
2CO(g)+2H2(g) △H4=(2)在催化剂作用下合成气可发生反应:CO(g)+2H2(g)
 CH3OH(g),在a、b、c容积不等的恒容密闭容器中(其中容器b容积为1L),均充入0.1molCO和0.2molH2,充分反应后测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图1所示:
CH3OH(g),在a、b、c容积不等的恒容密闭容器中(其中容器b容积为1L),均充入0.1molCO和0.2molH2,充分反应后测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图1所示:
①容器的容积a
②P点时,H2的转化率为
③当温度为300℃时,该反应的化学平衡常数K=
(3)利用电化学方法可以将CO2有效地转化为HCOO-,装置如图2所示。

①在该装置中,右侧Pt电极的电极反应式为
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率(电解效率=
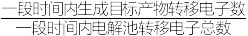 ×100%),标准状况下,当阳极生成氧气体积为448mL时,测得阴极区内的c(HCOO-)=0.03mol/L,电解效率为
×100%),标准状况下,当阳极生成氧气体积为448mL时,测得阴极区内的c(HCOO-)=0.03mol/L,电解效率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】二氧化碳是实现碳中和过程中的重要化学物质,关于二氧化碳的研究对于实现碳中和十分重要。目前已经实现利用太阳能将CO2或CO还原成CH3OH和CH4的过程。
部分反应过程如下:
反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
反应II:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
试回答下列问题:
(1)已知H2和CH4的燃烧热(△H)分别为a和b,且有H2O(g)=H2O(l) △H=c,则上述反应I的焓变△H1=____ 。
(2)温度和体积不变的条件下,下列描述能说明反应I已经达到平衡的是____ 。
A.CO2的浓度不再改变
B.混合气体的密度不再改变
C.混合气体的平均摩尔质量不再改变
D.消耗4molH2的同时,生成2mol的H2O
当反应I达到平衡后,采取什么措施能提高CO2的平衡转化率____ (任填两种)。
(3)体积可变的密闭容器中发生反应II,不同温度、不同投料比时CO2的平衡转化。如图a所示。根据图中信息可以判断△H2____ 0(填“>”或“<”);若在常压、起始体积为1L且体积可变的容器中,当在温度800K、投料比=3(共投入amol气体)的条件下发生反应II,根据图中数据计算该条件下的反应平衡常数K=____ 。

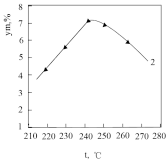
(4)工业上利用合适的催化剂可以直接将CO2转化为乙酸,不同温度下,催化剂的催化效率与乙酸的生成速率的关系如图b所示,温度在250℃到300℃时,乙酸的生成速率降低的原因可能是____ ,温度超过300度时,催化剂的催化效率大大降低,但是乙酸的生成速率反而继续上升,出现这种现象的原因可能是____ 。

部分反应过程如下:
反应I:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1反应II:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2试回答下列问题:
(1)已知H2和CH4的燃烧热(△H)分别为a和b,且有H2O(g)=H2O(l) △H=c,则上述反应I的焓变△H1=
(2)温度和体积不变的条件下,下列描述能说明反应I已经达到平衡的是
A.CO2的浓度不再改变
B.混合气体的密度不再改变
C.混合气体的平均摩尔质量不再改变
D.消耗4molH2的同时,生成2mol的H2O
当反应I达到平衡后,采取什么措施能提高CO2的平衡转化率
(3)体积可变的密闭容器中发生反应II,不同温度、不同投料比时CO2的平衡转化。如图a所示。根据图中信息可以判断△H2

(4)工业上利用合适的催化剂可以直接将CO2转化为乙酸,不同温度下,催化剂的催化效率与乙酸的生成速率的关系如图b所示,温度在250℃到300℃时,乙酸的生成速率降低的原因可能是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
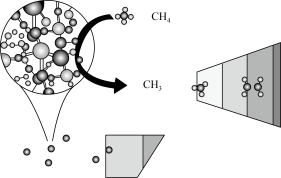
【推荐3】CH4在高温下的分解反应相当复杂,其原理属于游离基反应。随着反应温度的不同,CH4的分解产物为甲基-CH3、亚甲基-CH2-、次甲基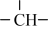 、氢原子H等,这些基团又可以相互结合形成诸多种类的物质,如2个亚甲基结合,就形成了乙烯、2个次甲基结合就形成的乙炔。一般规律是:温度越高,小分子量的产物就越多。
、氢原子H等,这些基团又可以相互结合形成诸多种类的物质,如2个亚甲基结合,就形成了乙烯、2个次甲基结合就形成的乙炔。一般规律是:温度越高,小分子量的产物就越多。
(2)已知相关物质的燃烧热如表,写出甲烷制备乙烯的热化学方程式
| 物质 | 燃烧热/(kJ·mol-1) |
| 氢气 | 285.8 |
| 甲烷 | 890.3 |
| 乙烯 | 1411.0 |
①在该温度下,其平衡常数K=
②若向该容器通入高温水蒸气(不参加反应,高于400℃),C2H4的产率将
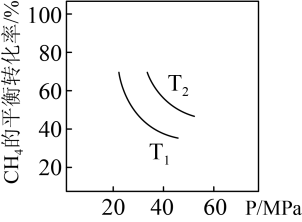
③若容器体积固定,不同温度下可得变化如下图,则温度T1、T2的关系是
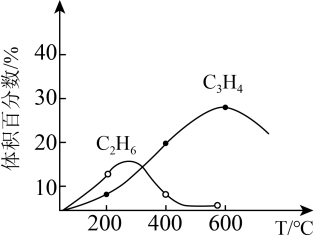
B.400℃时,C2H4、C2H6的体积分数分别为20.0%、6.0%,则体系中CH4的体积分数是
您最近一年使用:0次



