氢能源是最具应用前景的能源之一。甲烷-水蒸气催化重整制氢(SMR)是一种制高纯氢的方法之一,其涉及的主要反应如下:
反应Ⅰ: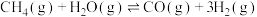
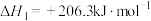
反应Ⅱ: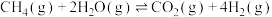

反应Ⅲ: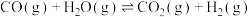
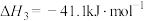
回答下列问题:
(1)反应Ⅱ能自发进行的条件是_______ 。
(2)一定温度下,向某容积为1L的恒容容器中按照水碳比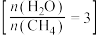 充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。
充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。
①下列说法不正确 的是_______ 。
A.为防止催化剂中毒和安全事故发生,需对原料气进行脱硫等净化处理
B.提高水碳比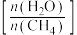 ,有利于提高H2的产率
,有利于提高H2的产率
C.其他条件不变,压缩容器体积,反应Ⅱ的平衡不发生移动
D.以Ni/γ-Al2O3作催化剂,降低反应活化能,提高反应速率和原料平衡利用率
②反应Ⅲ的平衡常数K=_______ (用含a,m,n的代数式表示)。
(3)650((局部温度过高会造成积碳)、按照一定流速通入原料气,当水碳比[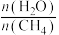 ]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示:
]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示:_______ 。
②实验时发现t1min后CO2的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是_______ (用化学反应方程式表示)。
(4)该反应常采用钯膜分离技(可选择性地让某气体通过而离开体系),其机理如图所示,其中过程2: ,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法
,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法不正确 的是_______。
反应Ⅰ:
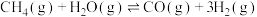
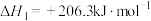
反应Ⅱ:
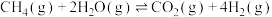

反应Ⅲ:
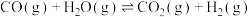
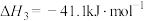
回答下列问题:
(1)反应Ⅱ能自发进行的条件是
(2)一定温度下,向某容积为1L的恒容容器中按照水碳比
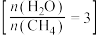 充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。
充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。①下列说法
A.为防止催化剂中毒和安全事故发生,需对原料气进行脱硫等净化处理
B.提高水碳比
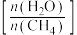 ,有利于提高H2的产率
,有利于提高H2的产率C.其他条件不变,压缩容器体积,反应Ⅱ的平衡不发生移动
D.以Ni/γ-Al2O3作催化剂,降低反应活化能,提高反应速率和原料平衡利用率
②反应Ⅲ的平衡常数K=
(3)650((局部温度过高会造成积碳)、按照一定流速通入原料气,当水碳比[
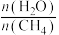 ]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示:
]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示: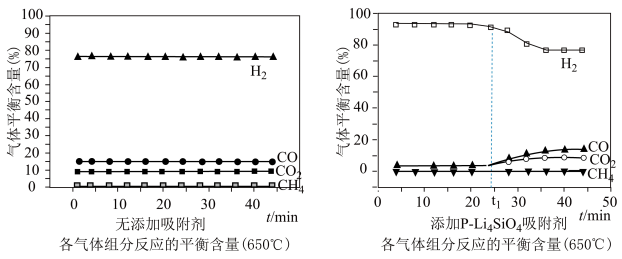
②实验时发现t1min后CO2的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是
(4)该反应常采用钯膜分离技(可选择性地让某气体通过而离开体系),其机理如图所示,其中过程2:
 ,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法
,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法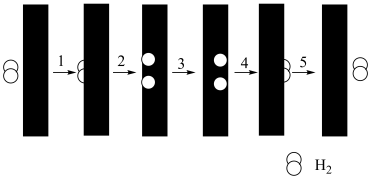
| A.钯膜对H2分子的透过具有选择性 |
B.过程4的 |
| C.采用钯膜分离技术可以提高原料的利用率 |
| D.常用N2将过程5中的H2吹扫出反应器而促进反应 |
更新时间:2024-05-26 10:31:02
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)ASH3的电子式为___ ;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为___ 。
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:

①1gKal ( H3 AsO4)=___ ;用甲基橙作指示剂,用NaOH溶液滴定H3 ASO4发生的主要反应的离子方程式为___
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g) H2=bkJ/mol
H2=bkJ/mol
则反应4As(g)=As4(g) H=
H=_______ kJ/mol(用含a、b的代数式表示)。
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
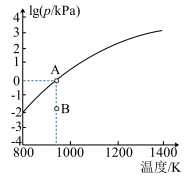
①对应温度下,B点的反应速率v(正)___ v(逆)(填“>’,’’<”或“一”)。
②A点处,AsS(g)的分压为___ kPa,该反应的Kp=___ kPa5 (Kp为以分压表示的平衡常数)。
(1)ASH3的电子式为
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:

①1gKal ( H3 AsO4)=
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g)
 H1=akJ/mol
H1=akJ/molAs2O3(g)+3C(s)=1/2As4(g)+3CO(g)
 H2=bkJ/mol
H2=bkJ/mol则反应4As(g)=As4(g)
 H=
H=(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正)
②A点处,AsS(g)的分压为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】I.如图为工业合成氨的流程图:_______ (填序号)。
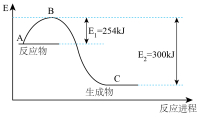
(2)如图是未用催化剂N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请在图中绘制同条件下加入铁触媒后相应的能量变化曲线:_______ ,并写出该条件下2molNH3(g)分解对应的热化学方程式:_______ 。
(3)则:α1_______ α2、α1_______ α3(填“>”、“=”或“<”)
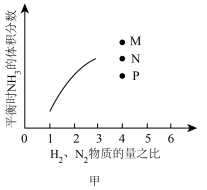
(4)如图甲表示500℃、60.0MPa条件下,平衡时NH3的体积分数与原料气投料比的关系。若投料比为4时,氨气的体积分数为40%,NH3的体积分数可能为图中的_______ 点,平衡时N2的体积分数为_______ 。_______ 。
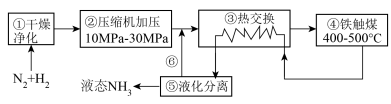
(2)如图是未用催化剂N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请在图中绘制同条件下加入铁触媒后相应的能量变化曲线:
| 序号 | 起始投入量 | 平衡转化率 | ||
| N2 | H2 | NH3 | ||
| ①恒温恒容 | 1mol | 3mol | 0 | α1 |
| ②绝热恒容 | 1mol | 3mol | 0 | α2 |
| ③恒温恒压 | 2mol | 6mol | 0 | α3 |
(4)如图甲表示500℃、60.0MPa条件下,平衡时NH3的体积分数与原料气投料比的关系。若投料比为4时,氨气的体积分数为40%,NH3的体积分数可能为图中的
您最近一年使用:0次
【推荐3】下列是MnO2工业制备及对含Mn2+废水处理的有关问题,已知:Ksp[Mn(OH)2]=1.9×10-13 , Ksp(MnCO3)=2.2×10-11,回答下列问题:
(1)用惰性电极电解MnSO4溶液可制备MnO2,其阳极反应式为___________ 。
(2)往MnSO4溶液中加入(NH4)2CO3溶液制取MnCO3时会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq) Mn(OH)2(s)+CO32-(aq),该反应的平衡常数K=
Mn(OH)2(s)+CO32-(aq),该反应的平衡常数K=_________ (保留一位小数)。
(3)废水中的Mn2+,也可用NH4HSO4调节溶液的pH。室温时,往100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如下图所示 (反应前后溶液总体积变化忽略不计) 。
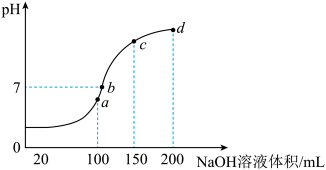
a点c(NH4+)+c(NH3.H2O)=__________ mol·L-1;图中a、b、c、d四个点,水的电离程度最大的是__________ ;b点,溶液中各离子浓度由大到小的排列顺序是____________________ 。
(1)用惰性电极电解MnSO4溶液可制备MnO2,其阳极反应式为
(2)往MnSO4溶液中加入(NH4)2CO3溶液制取MnCO3时会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq)
 Mn(OH)2(s)+CO32-(aq),该反应的平衡常数K=
Mn(OH)2(s)+CO32-(aq),该反应的平衡常数K=(3)废水中的Mn2+,也可用NH4HSO4调节溶液的pH。室温时,往100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如下图所示 (反应前后溶液总体积变化忽略不计) 。

a点c(NH4+)+c(NH3.H2O)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】一种新型煤气化燃烧集成制氢发生的主要反应如下:
I.C(s)+H2O(g) CO(g)+H2(g)△H1
CO(g)+H2(g)△H1
II.CO(g)+H2O(g) CO2(g)+H2(g)△H2
CO2(g)+H2(g)△H2
III.CaO(s)+CO2(g) CaCO3(s)△H3
CaCO3(s)△H3
IV.C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g)△H4=-64.9kJ·mol-1
CaCO3(s)+2H2(g)△H4=-64.9kJ·mol-1
副反应:
V.C(s)+2H2(g) CH4(g)△H5=-74.8kJ·mol-1
CH4(g)△H5=-74.8kJ·mol-1
VI.CO(g)+3H2(g) CH4(g)+H2O(g)△H6=-206.1kJ·mol-1
CH4(g)+H2O(g)△H6=-206.1kJ·mol-1
回答下列问题:
(1)已知反应I、II的平衡常数K1、K2随温度的变化如图1、图2所示。
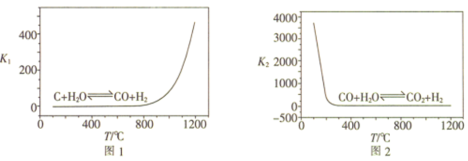
①由反应V和反应VI可知,△H1___________ ;反应I的△S___________ (填“>”或“<”)0。
②温度小于800°C时,K1=0,原因是___________ 。
③为提高反应II中CO的转化率,可采取的措施是___________ (写一条)。
④T°C时,向密闭容器中充入1molCO(g)和3molH2O(g),只发生反应II,此时该反应的平衡常数K2=1,CO的平衡转化率为___________ 。
(2)从环境保护角度分析,该制氢工艺中设计反应III的优点是___________ 。
(3)起始时在气化炉中加入1molC、2molH2O及1molCaO,在2.5MPa下,气体的组成与温度的关系如图3所示。
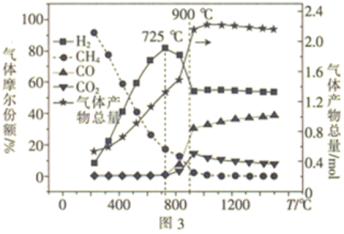
①200~725°C时,CH4的量不断减少的原因是___________ 。
②725~900°C时,H2的物质的量分数快速减小,其原因是___________ 。
I.C(s)+H2O(g)
 CO(g)+H2(g)△H1
CO(g)+H2(g)△H1II.CO(g)+H2O(g)
 CO2(g)+H2(g)△H2
CO2(g)+H2(g)△H2III.CaO(s)+CO2(g)
 CaCO3(s)△H3
CaCO3(s)△H3IV.C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g)△H4=-64.9kJ·mol-1
CaCO3(s)+2H2(g)△H4=-64.9kJ·mol-1副反应:
V.C(s)+2H2(g)
 CH4(g)△H5=-74.8kJ·mol-1
CH4(g)△H5=-74.8kJ·mol-1VI.CO(g)+3H2(g)
 CH4(g)+H2O(g)△H6=-206.1kJ·mol-1
CH4(g)+H2O(g)△H6=-206.1kJ·mol-1回答下列问题:
(1)已知反应I、II的平衡常数K1、K2随温度的变化如图1、图2所示。

①由反应V和反应VI可知,△H1
②温度小于800°C时,K1=0,原因是
③为提高反应II中CO的转化率,可采取的措施是
④T°C时,向密闭容器中充入1molCO(g)和3molH2O(g),只发生反应II,此时该反应的平衡常数K2=1,CO的平衡转化率为
(2)从环境保护角度分析,该制氢工艺中设计反应III的优点是
(3)起始时在气化炉中加入1molC、2molH2O及1molCaO,在2.5MPa下,气体的组成与温度的关系如图3所示。

①200~725°C时,CH4的量不断减少的原因是
②725~900°C时,H2的物质的量分数快速减小,其原因是
您最近一年使用:0次
【推荐2】研发二氧化碳利用技术,降低空气中二氧化碳的含量成为当今研究热点。
(1)科学家研发了一种新型Zn-CO2水介质电池,电极材料为金属锌和选择性催化材料,放电时,可将CO2转化为储氢物质甲酸。其工作原理如下所示。
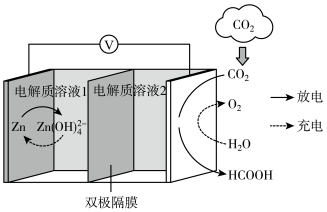
充电时,该电池的总反应式为___________ 。该电池放电产生1Ah电量时,生成的HCOOH和消耗Zn的质量比值为___________ (保留两位有效数字)。
(2) 与
与 重整反应体系,涉及到的某些主要反应如下:
重整反应体系,涉及到的某些主要反应如下:
I.
II.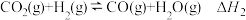
III.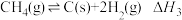
IV.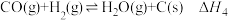
设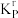 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压 除以
除以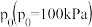 。反应I、III、IV的
。反应I、III、IV的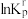 随
随 的变化如图所示。
的变化如图所示。
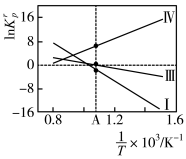
①根据盖斯定律,反应I的∆H1___________ 。
②I、III、IV中,属于放热反应的是___________ (填序号)。
③反应I的相对压力平衡常数表达式为
___________ 。
④在上图中A点对应温度下、原料组成为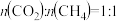 、初始总压为
、初始总压为 的恒容密闭容器中进行反应III,体系达到平衡时
的恒容密闭容器中进行反应III,体系达到平衡时 的分压为
的分压为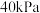 ,则
,则 的平衡转化率为
的平衡转化率为___________ 。
(1)科学家研发了一种新型Zn-CO2水介质电池,电极材料为金属锌和选择性催化材料,放电时,可将CO2转化为储氢物质甲酸。其工作原理如下所示。

充电时,该电池的总反应式为
(2)
 与
与 重整反应体系,涉及到的某些主要反应如下:
重整反应体系,涉及到的某些主要反应如下:I.

II.
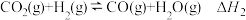
III.
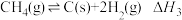
IV.
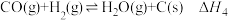
设
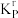 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压 除以
除以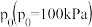 。反应I、III、IV的
。反应I、III、IV的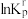 随
随 的变化如图所示。
的变化如图所示。
①根据盖斯定律,反应I的∆H1
②I、III、IV中,属于放热反应的是
③反应I的相对压力平衡常数表达式为

④在上图中A点对应温度下、原料组成为
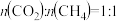 、初始总压为
、初始总压为 的恒容密闭容器中进行反应III,体系达到平衡时
的恒容密闭容器中进行反应III,体系达到平衡时 的分压为
的分压为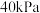 ,则
,则 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) ⇌2NO(g) ΔH>0,已知该反应在2404℃,平衡常数K=6.4×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟时达平衡O2的物质的量为0.5mol,则5分钟内N2的反应速率为_______ ,N2的转化率是_______ 。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志是_______。
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下图变化趋势正确的是_______ (填字母序号)。
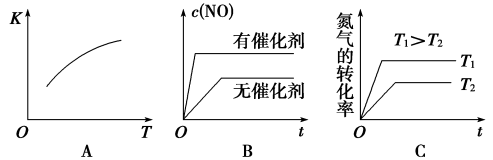
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_______ (填“变大”、“变小”或“不变”)
(5)高炉炼铁发生的反应有:Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g) ΔH < 0,该反应平衡常数的表达式K=_______ 。
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟时达平衡O2的物质的量为0.5mol,则5分钟内N2的反应速率为
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志是_______。
| A.消耗1molN2同时生成1molO2 |
| B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 |
| D.2v正(N2)=v逆(NO) |

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数
(5)高炉炼铁发生的反应有:Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g) ΔH < 0,该反应平衡常数的表达式K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①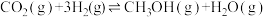
 ;
;
②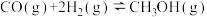
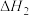 ;
;
③
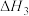 ;
;
回答下列问题:
(1)已知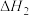 =-99 kJ·mol-1,则根据上表相关的化学键键能(“C
=-99 kJ·mol-1,则根据上表相关的化学键键能(“C O”表示CO的化学键)计算X=
O”表示CO的化学键)计算X=_______ kJ·mol-1
(2)反应①、②、③对应 、
、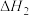 、
、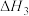 的关系
的关系 =
=_______ 平衡常数K1、K2、K3之间的关系式为K1=_______ 。
(3)根据化学反应原理,分析增大压强对反应③的影响为_______ 。(要求:从对反应速率、平衡状态、转化率角度回答)
①
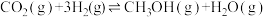
 ;
;②
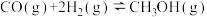
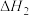 ;
;③

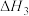 ;
;| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | X |
(1)已知
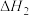 =-99 kJ·mol-1,则根据上表相关的化学键键能(“C
=-99 kJ·mol-1,则根据上表相关的化学键键能(“C O”表示CO的化学键)计算X=
O”表示CO的化学键)计算X=(2)反应①、②、③对应
 、
、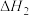 、
、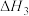 的关系
的关系 =
=(3)根据化学反应原理,分析增大压强对反应③的影响为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(l) CH3OH(l)+
CH3OH(l)+ O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
②CO2(g)+3H2O(l) CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
③CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
④CO2(g)+4H2(g) CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是__ ,反应进行程度最大的是__ 。
(2)反应CO2+4H2 CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2,再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充__ (填化学式)。

②在1.5MPa,气体流速为20mL·min-1时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
分析上表数据可知:__ (填化学式)的催化性能更好。
③调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如下:
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率__ (填“增大”或“减小”),其可能的原因是__ 。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是__ ,在1L恒容密闭容器中发生该反应,已知初始反应气体中V(H2):V(CO2)=4:1,估算该温度下的平衡常数为__ (列出计算表达式)。
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因__ 。(已知Co的性质与Fe相似)

(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(l)
 CH3OH(l)+
CH3OH(l)+ O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1②CO2(g)+3H2O(l)
 CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1③CO2(g)+3H2(g)
 CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1④CO2(g)+4H2(g)
 CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1从化学平衡的角度来看,上述化学反应中反应进行程度最小的是
(2)反应CO2+4H2
 CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。①在载人航天器中利用Sabatier反应实现回收CO2,再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充

②在1.5MPa,气体流速为20mL·min-1时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
| 催化剂 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
| Co4N/Al2O3 | 8.0 | 20.3 | 37.3 | 74.8 | 84.4 | 85.3 | 86.8 | 90.1 |
| Co/Al2O3 | 0.2 | 0.7 | 2.0 | 22.4 | 37.6 | 48.8 | 54.9 | 59.8 |
分析上表数据可知:
③调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如下:
| 气体流速/mL·min-1 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
| 10 | 11.0 | 25.1 | 49.5 | 90.2 | 93.6 | 97.2 | 98.0 | 98.0 |
| 30 | 4.9 | 11.2 | 28.9 | 68.7 | 72.7 | 79.8 | 82.1 | 84.2 |
| 40 | 0.2 | 5.2 | 15.3 | 61.2 | 66.2 | 71.2 | 76.6 | 79.0 |
| 50 | 0.2 | 5.0 | 10.0 | 50.0 | 59.5 | 61.2 | 64.1 | 69.1 |
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】研究NOx、CO、SO2等大气污染气体的治理,对保护环境有重要的意义。回答下列问题:
(1)在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应:2NO2(g)+4CO(g) N2(g)+4CO2(g),测得相关数据如下:
N2(g)+4CO2(g),测得相关数据如下:
①其他条件不变,若不使用催化剂,则0~5minNO2的转化率将___________ (填“变大”、“变小”或“不变”)。
②以下表述能说明该反应已达到平衡状态的是___________ 。
A.CO的反应速率为N2的4倍 B.气体的颜色不再变化
C.化学平衡常数K不再变化 D.混合气的压强不再变化
③该温度下反应的化学平衡常数K=___________ (保留两位有效数字)。
④在20min时,保持温度不变,继续向容器中再加入2.0molNO2和2.0molN2,则化学平衡___________ 移动(填“正向”、“逆向”或“不”)。
(2)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。CH4还原NO2反应的化学方程式为___________ 。
(1)在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应:2NO2(g)+4CO(g)
 N2(g)+4CO2(g),测得相关数据如下:
N2(g)+4CO2(g),测得相关数据如下:| 0min | 5min | 10min | 15min | 20min | |
| c(NO2)/mol·L−1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol·L−1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②以下表述能说明该反应已达到平衡状态的是
A.CO的反应速率为N2的4倍 B.气体的颜色不再变化
C.化学平衡常数K不再变化 D.混合气的压强不再变化
③该温度下反应的化学平衡常数K=
④在20min时,保持温度不变,继续向容器中再加入2.0molNO2和2.0molN2,则化学平衡
(2)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。CH4还原NO2反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】工业上可溶性的钡盐常用重晶石(BaSO4)与焦炭在高温下还原得到,按物质的量之比1:3投料。主要发生如下反应:
①BaSO4(s)+2C(s) BaS(s)+2CO2(g)ΔH1=-98kJ•mol-1
BaS(s)+2CO2(g)ΔH1=-98kJ•mol-1
②BaSO4(s)+4C(s) BaS(s)+4CO(g)ΔH2=+571.2kJ•mol-1
BaS(s)+4CO(g)ΔH2=+571.2kJ•mol-1
③BaSO4(s)+4CO(g) BaS(s)+4CO2(g)ΔH3=-118.8kJ•mol-1
BaS(s)+4CO2(g)ΔH3=-118.8kJ•mol-1
④CO2(g)+C(s) 2CO(g)ΔH4
2CO(g)ΔH4
按要求回答下列问题:
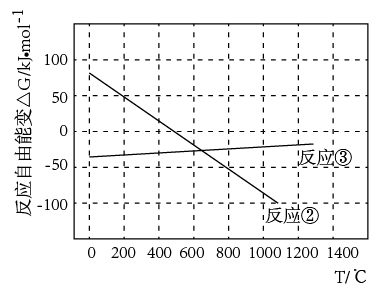
(1)ΔH4=___ kJ•mol-1。
(2)已知体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应自发进行。由下图可知工业上用焦炭还原重晶石发生反应②,至少需控制反应温度___ ℃以上。
(3)将重晶石与焦炭(固体均足量)在恒压密闭容器中控制1000℃温度下发生反应,下列能证明反应③达到平衡状态的是___ 。
A.气体的压强不变
B.CO2的体积分数保持不变
C.v(CO):v(CO2)=1:1
D.容器内气体密度不变
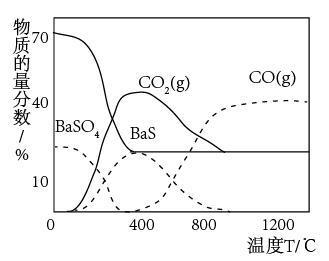
(4)T℃温度下,碳热还原硫酸钡反应达到平衡时,混合气体的总压强为P,其中CO的物质的量分数为α,则反应③的平衡常数Kp=__ 。[说明:对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)可表示平衡常数,记作Kp,如p(B)=p•x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数]。
(5)常压下,不同反应温度下碳热还原硫酸钡反应体系各物质的组成如图所示。400℃以,反应①可以看成反应②和反应③连续进行的结果,由图可判断在400℃以下时反应②的速率___ 反应③(填“>”、“<”或“=”),理由是__ 。
①BaSO4(s)+2C(s)
 BaS(s)+2CO2(g)ΔH1=-98kJ•mol-1
BaS(s)+2CO2(g)ΔH1=-98kJ•mol-1②BaSO4(s)+4C(s)
 BaS(s)+4CO(g)ΔH2=+571.2kJ•mol-1
BaS(s)+4CO(g)ΔH2=+571.2kJ•mol-1③BaSO4(s)+4CO(g)
 BaS(s)+4CO2(g)ΔH3=-118.8kJ•mol-1
BaS(s)+4CO2(g)ΔH3=-118.8kJ•mol-1④CO2(g)+C(s)
 2CO(g)ΔH4
2CO(g)ΔH4
按要求回答下列问题:
(1)ΔH4=
(2)已知体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应自发进行。由下图可知工业上用焦炭还原重晶石发生反应②,至少需控制反应温度
(3)将重晶石与焦炭(固体均足量)在恒压密闭容器中控制1000℃温度下发生反应,下列能证明反应③达到平衡状态的是
A.气体的压强不变
B.CO2的体积分数保持不变
C.v(CO):v(CO2)=1:1
D.容器内气体密度不变
(4)T℃温度下,碳热还原硫酸钡反应达到平衡时,混合气体的总压强为P,其中CO的物质的量分数为α,则反应③的平衡常数Kp=
(5)常压下,不同反应温度下碳热还原硫酸钡反应体系各物质的组成如图所示。400℃以,反应①可以看成反应②和反应③连续进行的结果,由图可判断在400℃以下时反应②的速率

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】我国在政府工作报告中提出力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳转化利用技术,成为当下研究热点。
 .
. 与
与 重整是
重整是 再利用的研究热点之一。该重整反应体系主要涉及以下反应:
再利用的研究热点之一。该重整反应体系主要涉及以下反应:
①

②
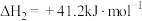
③
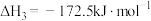
(1)已知反应①低温无法自发进行,只能在高温下自发进行,则
___________ 0(填“>”或“<”)。
(2)某温度下,在体积 的密闭容器中加入
的密闭容器中加入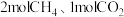 及催化剂仅发生反应①,经过
及催化剂仅发生反应①,经过 达到平衡状态时
达到平衡状态时 的转化率为
的转化率为 。则用
。则用 表示的平均化学反应速率为
表示的平均化学反应速率为___________ ,平衡常数的值为___________ ;达到平衡后,其他条件不变时向容器中充入 与
与 各
各 ,则化学平衡
,则化学平衡___________ 移动(选填“正向”、“逆向”或“不”)。
(3) 下,将
下,将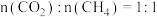 的混合气体置于密闭容器中,不同温度下重整体系中
的混合气体置于密闭容器中,不同温度下重整体系中 和
和 的平衡转化率如图所示。
的平衡转化率如图所示。 时
时 的平衡转化率远大于
的平衡转化率远大于 时
时 的平衡转化率。原因是
的平衡转化率。原因是___________ 。 .
. 在催化剂作用下,通过电催化还原为
在催化剂作用下,通过电催化还原为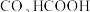 是一种具有前景的利用
是一种具有前景的利用 的方式。在催化剂表面,
的方式。在催化剂表面, 还原生成
还原生成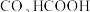 通过两种平行的反应途径进行,各自途径的关键中间体分别为
通过两种平行的反应途径进行,各自途径的关键中间体分别为 。催化剂催化
。催化剂催化 转化为
转化为 和
和 的反应历程如图1(*表示吸附在催化剂表面)。
的反应历程如图1(*表示吸附在催化剂表面)。 催化剂表面更利于生成
催化剂表面更利于生成___________ 。
(5)在m和n两种催化剂作用下,反应①的阿伦尼乌斯经验公式实验数据如图2所示,已知阿伦尼乌斯经验公式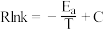 (
( 为活化能,k为速率常数,R和C为常数),m和n两种催化剂中对该反应催化效果较高的是
为活化能,k为速率常数,R和C为常数),m和n两种催化剂中对该反应催化效果较高的是___________ (填“m”或“n”)。
 .
. 与
与 重整是
重整是 再利用的研究热点之一。该重整反应体系主要涉及以下反应:
再利用的研究热点之一。该重整反应体系主要涉及以下反应:①


②

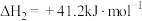
③

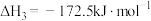
(1)已知反应①低温无法自发进行,只能在高温下自发进行,则

(2)某温度下,在体积
 的密闭容器中加入
的密闭容器中加入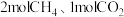 及催化剂仅发生反应①,经过
及催化剂仅发生反应①,经过 达到平衡状态时
达到平衡状态时 的转化率为
的转化率为 。则用
。则用 表示的平均化学反应速率为
表示的平均化学反应速率为 与
与 各
各 ,则化学平衡
,则化学平衡(3)
 下,将
下,将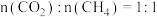 的混合气体置于密闭容器中,不同温度下重整体系中
的混合气体置于密闭容器中,不同温度下重整体系中 和
和 的平衡转化率如图所示。
的平衡转化率如图所示。 时
时 的平衡转化率远大于
的平衡转化率远大于 时
时 的平衡转化率。原因是
的平衡转化率。原因是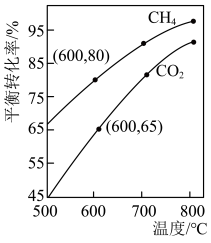
 .
. 在催化剂作用下,通过电催化还原为
在催化剂作用下,通过电催化还原为 是一种具有前景的利用
是一种具有前景的利用 的方式。在催化剂表面,
的方式。在催化剂表面, 还原生成
还原生成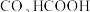 通过两种平行的反应途径进行,各自途径的关键中间体分别为
通过两种平行的反应途径进行,各自途径的关键中间体分别为 。催化剂催化
。催化剂催化 转化为
转化为 和
和 的反应历程如图1(*表示吸附在催化剂表面)。
的反应历程如图1(*表示吸附在催化剂表面)。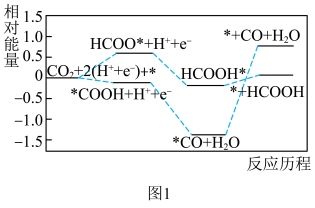
 催化剂表面更利于生成
催化剂表面更利于生成(5)在m和n两种催化剂作用下,反应①的阿伦尼乌斯经验公式实验数据如图2所示,已知阿伦尼乌斯经验公式
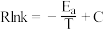 (
( 为活化能,k为速率常数,R和C为常数),m和n两种催化剂中对该反应催化效果较高的是
为活化能,k为速率常数,R和C为常数),m和n两种催化剂中对该反应催化效果较高的是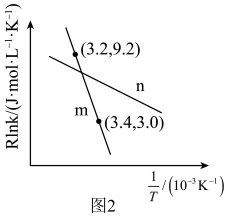
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】能源是现代文明的原动力,通过化学方法可以使能源按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。回答下列问题:
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,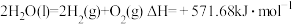 ,
,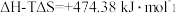 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是_______ 。
(2)已知反应: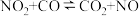
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为_______ (用含K的式子表示)。
②下图是该反应中能量变化示意图。
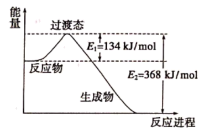
则 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为_______ , 和
和 反应的热化学方程式为
反应的热化学方程式为_______ 。
(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①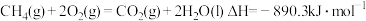
②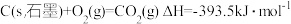
③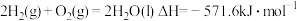
则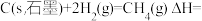
_______ 。
(4)已知一些化学键的键能数据如表所示:
请根据键能数据写出 和
和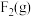 反应生成
反应生成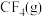 和
和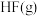 的热化学方程式:
的热化学方程式:_______ 。
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,
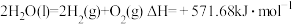 ,
,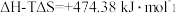 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是(2)已知反应:
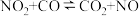
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为
②下图是该反应中能量变化示意图。

则
 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为 和
和 反应的热化学方程式为
反应的热化学方程式为(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①
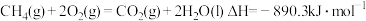
②
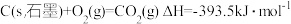
③
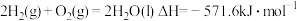
则
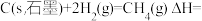
(4)已知一些化学键的键能数据如表所示:
| 化学键 |  |  |  |  |
键能/ | 414 | 489 | 565 | 155 |
请根据键能数据写出
 和
和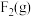 反应生成
反应生成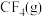 和
和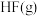 的热化学方程式:
的热化学方程式:
您最近一年使用:0次



