为减弱温室效应,除了减少 的排放、植树造林、将液态
的排放、植树造林、将液态 注入深海等措施外,还有一种思路是将
注入深海等措施外,还有一种思路是将 转化成其它可燃物质。如工业上已实现
转化成其它可燃物质。如工业上已实现 和
和 反应生成甲醇的转化。已知:在一恒温、恒容密闭容器中充入1mol
反应生成甲醇的转化。已知:在一恒温、恒容密闭容器中充入1mol 和3mol
和3mol ,一定条件下发生反应:
,一定条件下发生反应: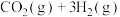

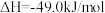 ,测得
,测得 和
和 的浓度随时间变化如图所示。请回答:
的浓度随时间变化如图所示。请回答:
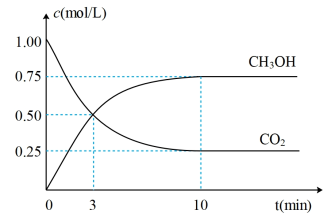
(1)达到平衡的时刻是_______ min(填“3”或“10”),3min时, 的转化率为
的转化率为_______ 。
(2)能判断该反应达到化学平衡状态的依据是_______ 。
a.容器压强不变 b.混合气体中 不变
不变
c.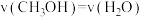 d.
d.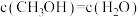
(3)为了提高 的转化率,可采取
的转化率,可采取_______ (填“增大”或“减小”) 浓度的措施。
浓度的措施。
(4)达平衡后, 的物质的量分数为
的物质的量分数为_______ ;平衡常数
_______ 。(计算结果保留一位小数)
 的排放、植树造林、将液态
的排放、植树造林、将液态 注入深海等措施外,还有一种思路是将
注入深海等措施外,还有一种思路是将 转化成其它可燃物质。如工业上已实现
转化成其它可燃物质。如工业上已实现 和
和 反应生成甲醇的转化。已知:在一恒温、恒容密闭容器中充入1mol
反应生成甲醇的转化。已知:在一恒温、恒容密闭容器中充入1mol 和3mol
和3mol ,一定条件下发生反应:
,一定条件下发生反应: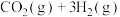

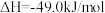 ,测得
,测得 和
和 的浓度随时间变化如图所示。请回答:
的浓度随时间变化如图所示。请回答:
(1)达到平衡的时刻是
 的转化率为
的转化率为(2)能判断该反应达到化学平衡状态的依据是
a.容器压强不变 b.混合气体中
 不变
不变c.
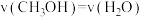 d.
d.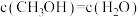
(3)为了提高
 的转化率,可采取
的转化率,可采取 浓度的措施。
浓度的措施。(4)达平衡后,
 的物质的量分数为
的物质的量分数为
更新时间:2022-10-26 19:34:53
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】过氧化钙遇水放出氧气,且过氧化钙本身无毒,不污染环境,是一种用途广泛的优良供氧剂。以大理石(含有少量氧化亚铁和氧化铁杂质)为原料制备过氧化钙的工艺流程如图所示。

回答下列问题:
(1)为了加快大理石和盐酸的反应速率,可以采取的措施为_______ (写出一点)。
(2)为了验证“滤液M”中是否含有 ,可取少量“滤液M”于试管中,向其中加入
,可取少量“滤液M”于试管中,向其中加入_______ 溶液(填试剂名称),溶液变成血红色,则证明“滤液M”中有 。
。
(3)反应Ⅰ是放热反应,不同浓度的 溶液对反应生成
溶液对反应生成 的产率的影响如图所示,
的产率的影响如图所示, 的浓度大于20%后
的浓度大于20%后 的产率反而下降的原因是
的产率反而下降的原因是_______ 。

(4)制备所得的过氧化钙中常含有CaO杂质,实验室可按以下步骤测定 的质量分数:
的质量分数:
步骤1:准确称取0.3900g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:加入10mL蒸馏水和适当过量的磷酸溶液,振荡使样品完全溶解;
步骤3:用 的酸性
的酸性 溶液滴定至终点,记录数据;
溶液滴定至终点,记录数据;
步骤4:平行测定3次(数据记录见下表),计算试样中 的质量分数。
的质量分数。
已知:上述实验过程中反应关系为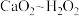 ,
,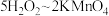 。
。
①滴定时,将酸性 标准液装在如图中的
标准液装在如图中的_______ (填“甲”或“乙”)滴定管中,滴定管用蒸馏水洗涤后,直接加入酸性 标准液进行滴定,则测定的
标准液进行滴定,则测定的 的质量分数会
的质量分数会_______ (填“偏高”“偏低”或“无影响”)。

②在滴定时,眼睛应观察________ 。在锥形瓶下垫一张白纸,其目的是_______ 。
③由表中数据可知,该样品中 的质量分数为
的质量分数为_______ %。(保留整数)
④有一支25mL的酸式滴定管,其中盛有溶液,液面恰好在5.00mL刻度处,现把管内液体全部放出,得到液体的体积_______ 20.00mL(填“大于”“小于”或“等于”)。

回答下列问题:
(1)为了加快大理石和盐酸的反应速率,可以采取的措施为
(2)为了验证“滤液M”中是否含有
 ,可取少量“滤液M”于试管中,向其中加入
,可取少量“滤液M”于试管中,向其中加入 。
。(3)反应Ⅰ是放热反应,不同浓度的
 溶液对反应生成
溶液对反应生成 的产率的影响如图所示,
的产率的影响如图所示, 的浓度大于20%后
的浓度大于20%后 的产率反而下降的原因是
的产率反而下降的原因是
(4)制备所得的过氧化钙中常含有CaO杂质,实验室可按以下步骤测定
 的质量分数:
的质量分数:步骤1:准确称取0.3900g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:加入10mL蒸馏水和适当过量的磷酸溶液,振荡使样品完全溶解;
步骤3:用
 的酸性
的酸性 溶液滴定至终点,记录数据;
溶液滴定至终点,记录数据;步骤4:平行测定3次(数据记录见下表),计算试样中
 的质量分数。
的质量分数。| 实验 | 1 | 2 | 3 |
V(酸性 溶液)/mL 溶液)/mL | 19.50 | 19.48 | 19.52 |
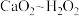 ,
,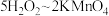 。
。①滴定时,将酸性
 标准液装在如图中的
标准液装在如图中的 标准液进行滴定,则测定的
标准液进行滴定,则测定的 的质量分数会
的质量分数会
②在滴定时,眼睛应观察
③由表中数据可知,该样品中
 的质量分数为
的质量分数为④有一支25mL的酸式滴定管,其中盛有溶液,液面恰好在5.00mL刻度处,现把管内液体全部放出,得到液体的体积
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】填空
(1)某压强下工业合成氨生产过程中,N2与H2按体积比为1∶3投料时,反应混合物中氨的体积分数随温度的变化曲线如图甲所示,其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。
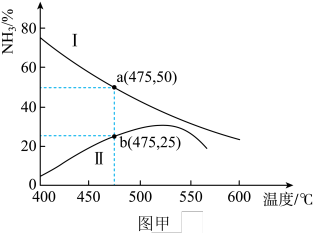
①图甲中表示该反应的平衡曲线的是___________ (填“I”或“Ⅱ”);由图甲中曲线变化趋势可推知工业合成氨的反应是___________ (填“吸热”或“放热”)反应。
②图甲中a点,容器内气体n(N2)∶n(NH3)=___________ ,图甲中b点,v(正)___________ v(逆)(填“>”“=”或“<”)。
(2)以工业合成氨为原料,进一步合成尿素的反应原理为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)。工业生产时,需要原料气带有水蒸气,图乙中曲线I、Ⅱ、Ⅲ表示在不同水碳比[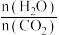 ]时,CO2的平衡转化率与氨碳比之间[
]时,CO2的平衡转化率与氨碳比之间[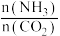 ]的关系。
]的关系。

①曲线I、Ⅱ、Ⅲ对应的水碳比最大的是___________ ,判断依据是___________ 。
②测得B点氨的平衡转化率为40%,则x1=___________ 。
(1)某压强下工业合成氨生产过程中,N2与H2按体积比为1∶3投料时,反应混合物中氨的体积分数随温度的变化曲线如图甲所示,其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。

①图甲中表示该反应的平衡曲线的是
②图甲中a点,容器内气体n(N2)∶n(NH3)=
(2)以工业合成氨为原料,进一步合成尿素的反应原理为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)。工业生产时,需要原料气带有水蒸气,图乙中曲线I、Ⅱ、Ⅲ表示在不同水碳比[
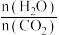 ]时,CO2的平衡转化率与氨碳比之间[
]时,CO2的平衡转化率与氨碳比之间[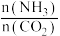 ]的关系。
]的关系。
①曲线I、Ⅱ、Ⅲ对应的水碳比最大的是
②测得B点氨的平衡转化率为40%,则x1=
您最近一年使用:0次
【推荐3】减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题.
Ⅰ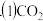 经催化加氢可合成低碳烯烃:
经催化加氢可合成低碳烯烃: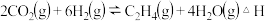 在
在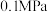 时,按
时,按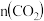 :
: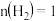 :3投料,图1所示不同温度
:3投料,图1所示不同温度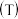 下,平衡时的四种气态物质的物质的量
下,平衡时的四种气态物质的物质的量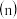 的关系.
的关系.
 该反应的
该反应的
______  填“
填“ ”、“
”、“ ”或“
”或“ ”
” .
.
 曲线b表示的物质为
曲线b表示的物质为 ______ .
 为提高
为提高 的平衡转化率,除改变温度外,还可采取的措施是
的平衡转化率,除改变温度外,还可采取的措施是 ______ .
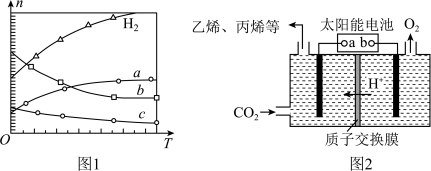
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解 可得到多种燃料,其原理如图2所示.
可得到多种燃料,其原理如图2所示.
b为电源的______ 极,电解时,生成乙烯的电极反应式是 ______ .
Ⅱ (3)用活性炭还原法可以处理氮氧化物.如反应:
(3)用活性炭还原法可以处理氮氧化物.如反应: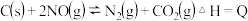
 . 在
. 在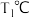 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:
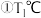 时,该反应的平衡常数
时,该反应的平衡常数
______ .
 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是
后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ______  答一种即可
答一种即可 .
.
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的 ,分别生成
,分别生成 、
、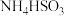 ,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中
,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中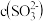 较小的是
较小的是 ______ ,用文字和化学用语解释原因 ______ .
Ⅰ
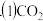 经催化加氢可合成低碳烯烃:
经催化加氢可合成低碳烯烃: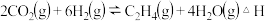 在
在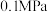 时,按
时,按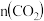 :
: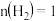 :3投料,图1所示不同温度
:3投料,图1所示不同温度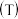 下,平衡时的四种气态物质的物质的量
下,平衡时的四种气态物质的物质的量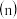 的关系.
的关系. 
 该反应的
该反应的
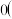 填“
填“ ”、“
”、“ ”或“
”或“ ”
” .
. 曲线b表示的物质为
曲线b表示的物质为  为提高
为提高 的平衡转化率,除改变温度外,还可采取的措施是
的平衡转化率,除改变温度外,还可采取的措施是 (2)在强酸性的电解质水溶液中,惰性材料做电极,电解
 可得到多种燃料,其原理如图2所示.
可得到多种燃料,其原理如图2所示. b为电源的
Ⅱ
 (3)用活性炭还原法可以处理氮氧化物.如反应:
(3)用活性炭还原法可以处理氮氧化物.如反应: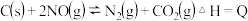
 . 在
. 在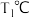 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下: 时间 浓度  | 0 | 10 | 20 | 30 | 40 | 50 |
| NO |  |  |  |  |  |  |
 | 0 | 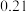 |  |  |  |  |
 | 0 | 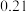 |  |  |  |  |
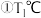 时,该反应的平衡常数
时,该反应的平衡常数
 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是
后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是  答一种即可
答一种即可 .
.Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的
 ,分别生成
,分别生成 、
、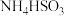 ,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中
,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中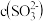 较小的是
较小的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】化石燃料的综合利用既能减少污染,又能提高资源利用率。回答下列问题:
(1)煤气化过程如下:
反应1
反应2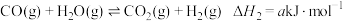
反应3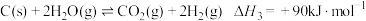
①a=___________ 。
②反应2在催化剂作用下的反应历程如图(TS表示过渡态,*表示吸附态),历程中决速步的方程式为___________ 。

(2)在一定温度下,向某恒容容器中充入2molCO2(g)和2molH2(g),仅发生反应: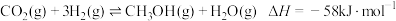 。
。
①下列情况表明反应已达到平衡状态的是___________ (填标号)。
A.CO2的体积分数保持不变 B.混合气体的平均摩尔质量保持不变
C.CO2的转化率保持不变 D.CH3OH与H2O的物质的量之比不再改变
②该反应能在___________ (填“高温”、“低温”或“任何温度”)下自发。
(3)向2L的恒容密闭容器中充入1molCH3OH(g),发生反应: 。其他条件不变时,CH3OH的平衡转化率随着温度(T)的变化如图所示。
。其他条件不变时,CH3OH的平衡转化率随着温度(T)的变化如图所示。

①欲提高CH3OH的平衡转化率且加快反应速率,下列措施可能有效的是___________ (填标号)。
a.降低温度并及时分离出产物
b.加入合适的催化剂并分离出产物
c.再向容器中充入1molCH3OH(g)
d.适当降温并加入合适的催化剂
②T1K时,反应经过20min达到平衡,用C2H4表示的该段时间内的平均速率为___________  ,该温度下,改变投料,某时刻容器内
,该温度下,改变投料,某时刻容器内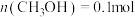 、
、 、
、 ,则此时
,则此时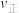
___________ (填“>”、“<”或“=”) 。
。
(1)煤气化过程如下:
反应1

反应2
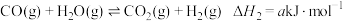
反应3
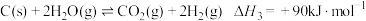
①a=
②反应2在催化剂作用下的反应历程如图(TS表示过渡态,*表示吸附态),历程中决速步的方程式为

(2)在一定温度下,向某恒容容器中充入2molCO2(g)和2molH2(g),仅发生反应:
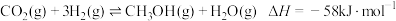 。
。①下列情况表明反应已达到平衡状态的是
A.CO2的体积分数保持不变 B.混合气体的平均摩尔质量保持不变
C.CO2的转化率保持不变 D.CH3OH与H2O的物质的量之比不再改变
②该反应能在
(3)向2L的恒容密闭容器中充入1molCH3OH(g),发生反应:
 。其他条件不变时,CH3OH的平衡转化率随着温度(T)的变化如图所示。
。其他条件不变时,CH3OH的平衡转化率随着温度(T)的变化如图所示。
①欲提高CH3OH的平衡转化率且加快反应速率,下列措施可能有效的是
a.降低温度并及时分离出产物
b.加入合适的催化剂并分离出产物
c.再向容器中充入1molCH3OH(g)
d.适当降温并加入合适的催化剂
②T1K时,反应经过20min达到平衡,用C2H4表示的该段时间内的平均速率为
 ,该温度下,改变投料,某时刻容器内
,该温度下,改变投料,某时刻容器内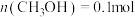 、
、 、
、 ,则此时
,则此时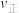
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】Ⅰ.碳氧化物有助于人们对氮及其化合物的处理。
(1)利用催化技术可将汽车尾气中的NO、 转化为无污染的
转化为无污染的 和
和 ,反应的化学方程为
,反应的化学方程为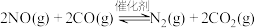 。若向某恒温恒容的密闭容器中加入等物质的量的NO和CO,发生上述反应。下列叙述能说明反应已经达到平衡状态的是___________。
。若向某恒温恒容的密闭容器中加入等物质的量的NO和CO,发生上述反应。下列叙述能说明反应已经达到平衡状态的是___________。
(2) 用于处理大气污染物
用于处理大气污染物 的反应为
的反应为 。在
。在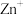 作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
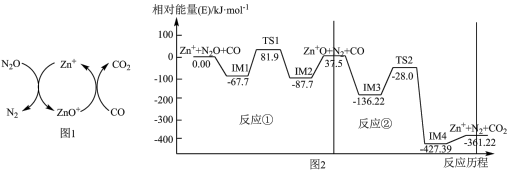
总反应:

___________  ;该总反应的决速步是反应
;该总反应的决速步是反应___________ (填“①”或“②”)
(3)已知: 的正反应速率方程为
的正反应速率方程为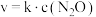 ,
, 为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。
为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。
Ⅱ.已知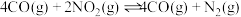

(4)对于该反应,改变某一反应条件(温度 ),下列图象正确的是___________(填标号)。
),下列图象正确的是___________(填标号)。
(5)某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料。甲: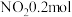 ,
, ;乙:
;乙: ,
, 。经过一段时间后达到平衡状态。
。经过一段时间后达到平衡状态。
① 的平衡体积分数:甲
的平衡体积分数:甲___________ 乙(选填“>”、“=”或“<”)。
②若甲中起始压强为 ,平衡时CO转化率为50%,该反应的
,平衡时CO转化率为50%,该反应的
___________ 。(用含 的式子表示)
的式子表示)
(1)利用催化技术可将汽车尾气中的NO、
 转化为无污染的
转化为无污染的 和
和 ,反应的化学方程为
,反应的化学方程为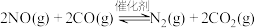 。若向某恒温恒容的密闭容器中加入等物质的量的NO和CO,发生上述反应。下列叙述能说明反应已经达到平衡状态的是___________。
。若向某恒温恒容的密闭容器中加入等物质的量的NO和CO,发生上述反应。下列叙述能说明反应已经达到平衡状态的是___________。| A.体系压强不变 | B.体系温度不变 |
| C.混合气体密度不变 | D. |
(2)
 用于处理大气污染物
用于处理大气污染物 的反应为
的反应为 。在
。在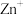 作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
总反应:


 ;该总反应的决速步是反应
;该总反应的决速步是反应(3)已知:
 的正反应速率方程为
的正反应速率方程为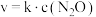 ,
, 为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。
为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。| A.升温 | B.恒容时,再充入CO |
C.恒容时,再充入 | D.恒压时,再充入 |
Ⅱ.已知
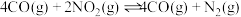

(4)对于该反应,改变某一反应条件(温度
 ),下列图象正确的是___________(填标号)。
),下列图象正确的是___________(填标号)。A. | B.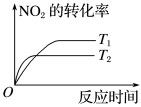 | C.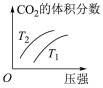 | D. |
(5)某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料。甲:
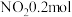 ,
, ;乙:
;乙: ,
, 。经过一段时间后达到平衡状态。
。经过一段时间后达到平衡状态。①
 的平衡体积分数:甲
的平衡体积分数:甲②若甲中起始压强为
 ,平衡时CO转化率为50%,该反应的
,平衡时CO转化率为50%,该反应的
 的式子表示)
的式子表示)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】工业上已实现 和
和 反应生成甲醇的转化。在一恒温、恒容密闭容器中充入1mol
反应生成甲醇的转化。在一恒温、恒容密闭容器中充入1mol 和3mol
和3mol ,一定条件下发生反应:
,一定条件下发生反应: ,
, 和
和 的浓度随时间变化如图所示。请回答:
的浓度随时间变化如图所示。请回答:

(1)达到平衡的时刻是_______ (填“3”或“10”)min。0~10min内,用 表示该反应的平均速率
表示该反应的平均速率
_______  。
。
(2)能判断该反应达到化学平衡状态的依据是_______ (填字母)。
a.容器内气体的总压强不变 b.混合气体中 不变
不变
c.容器内混合气体的密度不变 d.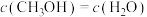
(3)为了提高反应速率,可采取_______ (填“升高”或“降低”)温度的措施。
(4)达到平衡时, 消耗量与初始量的百分比为
消耗量与初始量的百分比为_______ 。
 和
和 反应生成甲醇的转化。在一恒温、恒容密闭容器中充入1mol
反应生成甲醇的转化。在一恒温、恒容密闭容器中充入1mol 和3mol
和3mol ,一定条件下发生反应:
,一定条件下发生反应: ,
, 和
和 的浓度随时间变化如图所示。请回答:
的浓度随时间变化如图所示。请回答:
(1)达到平衡的时刻是
 表示该反应的平均速率
表示该反应的平均速率
 。
。(2)能判断该反应达到化学平衡状态的依据是
a.容器内气体的总压强不变 b.混合气体中
 不变
不变c.容器内混合气体的密度不变 d.
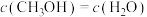
(3)为了提高反应速率,可采取
(4)达到平衡时,
 消耗量与初始量的百分比为
消耗量与初始量的百分比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】已知:用NH3催化还原NOx时包含以下反应。
反应①:4NH3(g) + 6NO(g) 5N2(g) + 6H2O(l) ∆H1 = -1807.0kJ•mol-1
5N2(g) + 6H2O(l) ∆H1 = -1807.0kJ•mol-1
反应②:4NH3(g) + 6NO2(g) ⇌ 5N2(g) + 3O2(g) + 6H2O(l) ∆H2 = ?
反应③:2NO(g) + O2(g) ⇌2NO2(g) ∆H3 = -113.0kJ•mol-1
(1)反应②的∆H2 =_________________________ 。 反应①②在热力学上趋势大,其原因是___________________________________________________________________ 。
(2)为探究温度及不同催化剂对反应①的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图所示。
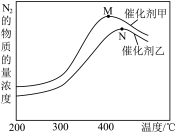
①反应①的平衡常数的表达式K=__________ 。在催化剂甲的作用下反应的平衡常数_______________ 在催化剂乙的作用下反应的平衡常数(填写“大于”,“小于”或“等于”)。
②N点后N2浓度减小的原因可能是_________________ 、 ________________ 。
(3)某温度下,在1L容器中对于反应①初始投入4molNH3和6molNO,当气体总物质的量为7.5mol时反应达到平衡,则NH3的转化率_______________ % ,达平衡所用时间为5分钟,则用NO表示此反应平均反应速率为__________________ 。
反应①:4NH3(g) + 6NO(g)
 5N2(g) + 6H2O(l) ∆H1 = -1807.0kJ•mol-1
5N2(g) + 6H2O(l) ∆H1 = -1807.0kJ•mol-1反应②:4NH3(g) + 6NO2(g) ⇌ 5N2(g) + 3O2(g) + 6H2O(l) ∆H2 = ?
反应③:2NO(g) + O2(g) ⇌2NO2(g) ∆H3 = -113.0kJ•mol-1
(1)反应②的∆H2 =
(2)为探究温度及不同催化剂对反应①的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图所示。

①反应①的平衡常数的表达式K=
②N点后N2浓度减小的原因可能是
(3)某温度下,在1L容器中对于反应①初始投入4molNH3和6molNO,当气体总物质的量为7.5mol时反应达到平衡,则NH3的转化率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】随着低碳钢等洁净钢技术的发展, 耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:
耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:
(1)在埋炭实验条件下,不同碳素材料的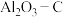 耐火材料与铁液之间的可能反应如下:
耐火材料与铁液之间的可能反应如下:
①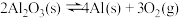
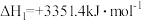
②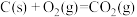
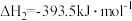
③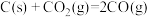
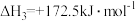
④

则
___________  。
。
(2)直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤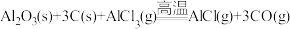

⑥
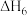
反应⑤、反应⑥中吉布斯自由能(ΔG)与温度(T)的变化关系如图1所示,由此判断反应⑤对应图中的曲线___________ (填“Ⅰ”或“Ⅱ”),试分析氧化铝碳热还原氯化法炼铝的可行性:___________ 。
(3)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑: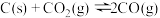 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为
。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为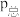 )中加入足量的碳和
)中加入足量的碳和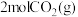 ,平衡时体系中气体体积分数与温度的关系如图2所示。
,平衡时体系中气体体积分数与温度的关系如图2所示。

①650℃反应达到平衡时,容器体积为10L,则平衡时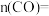
___________ 。
②T℃时,若向平衡体系中再充入一定量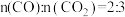 的混合气体,则平衡
的混合气体,则平衡___________ (填“向正反应方向”、“向逆反应方向”或“不”)移动。
③800℃时,用平衡分压代替平衡浓度表示的化学平衡常数
___________ [用含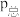 的代数式表示,气体分压
的代数式表示,气体分压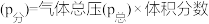 ]。
]。
(4)CO可作某熔融盐电池的燃料,电解质为Li2CO3和Na2CO3的熔融盐混合物,空气与CO2的混合气为助燃气,电池在650℃下工作时,负极的电极反应式为___________ 。
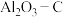 耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:
耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:(1)在埋炭实验条件下,不同碳素材料的
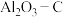 耐火材料与铁液之间的可能反应如下:
耐火材料与铁液之间的可能反应如下:①
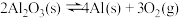
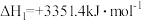
②
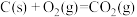
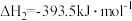
③
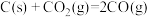
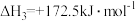
④


则

 。
。(2)直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤
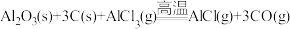

⑥

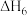
反应⑤、反应⑥中吉布斯自由能(ΔG)与温度(T)的变化关系如图1所示,由此判断反应⑤对应图中的曲线
(3)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑:
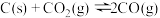 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为
。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为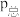 )中加入足量的碳和
)中加入足量的碳和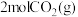 ,平衡时体系中气体体积分数与温度的关系如图2所示。
,平衡时体系中气体体积分数与温度的关系如图2所示。
①650℃反应达到平衡时,容器体积为10L,则平衡时
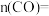
②T℃时,若向平衡体系中再充入一定量
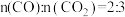 的混合气体,则平衡
的混合气体,则平衡③800℃时,用平衡分压代替平衡浓度表示的化学平衡常数

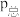 的代数式表示,气体分压
的代数式表示,气体分压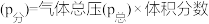 ]。
]。(4)CO可作某熔融盐电池的燃料,电解质为Li2CO3和Na2CO3的熔融盐混合物,空气与CO2的混合气为助燃气,电池在650℃下工作时,负极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】综合利用碳氧化物对促进低碳社会的构建具有重要意义。一定条件下,由二氧化碳合成乙醇的反应原理为2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)
C2H5OH(g)+3H2O(g)  。回答下列问题:
。回答下列问题:
Ⅰ.已知化学键键能如表所示
(1)上述反应的
___________ 。
Ⅱ. 在恒容密闭容器中进行上述反应,某压强下起始时按照不同氢碳比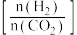 投料(如图中曲线①-③),测得
投料(如图中曲线①-③),测得 平衡转化率与温度的关系如图所示。
平衡转化率与温度的关系如图所示。
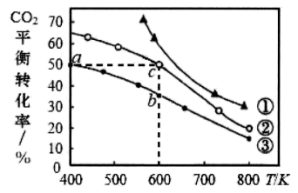
(2)氢碳比最大的曲线是___________ (填标号,下同),一定温度下,起始以该氢碳比充入一定量 和
和 发生反应,下列能说明该反应已达平衡状态的是
发生反应,下列能说明该反应已达平衡状态的是___________ 。
a. 容器内气体平均相对分子质量不变 b. 容器内气体密度不变
c. 每生成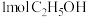 ,断裂
,断裂 个
个 键 d. 容器内压强不变
键 d. 容器内压强不变
(3)在 恒容密闭容器中按曲线③的起始氢碳比投料,充入
恒容密闭容器中按曲线③的起始氢碳比投料,充入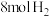 和
和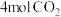 ,发生反应
,发生反应 ,达到平衡。已知该反应速率
,达到平衡。已知该反应速率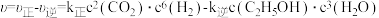 ,其中
,其中 、
、 分别为正、逆反应速率常数,
分别为正、逆反应速率常数, 为物质的量浓度。
为物质的量浓度。
①a、b、c处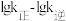 的大小关系为
的大小关系为___________ (用a、b、c表示)。
②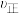 :a
:a___________ b (填“大于”、“小于”或“等于”),原因是___________ 。
③a点处
___________ (填数值,保留两位小数)。
 C2H5OH(g)+3H2O(g)
C2H5OH(g)+3H2O(g)  。回答下列问题:
。回答下列问题:Ⅰ.已知化学键键能如表所示
| 化学键 |  |  |  |  |  |  |
键能/ | 799 | 358 | 436 | 413 | 347 | 467 |
(1)上述反应的

Ⅱ. 在恒容密闭容器中进行上述反应,某压强下起始时按照不同氢碳比
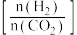 投料(如图中曲线①-③),测得
投料(如图中曲线①-③),测得 平衡转化率与温度的关系如图所示。
平衡转化率与温度的关系如图所示。
(2)氢碳比最大的曲线是
 和
和 发生反应,下列能说明该反应已达平衡状态的是
发生反应,下列能说明该反应已达平衡状态的是a. 容器内气体平均相对分子质量不变 b. 容器内气体密度不变
c. 每生成
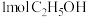 ,断裂
,断裂 个
个 键 d. 容器内压强不变
键 d. 容器内压强不变(3)在
 恒容密闭容器中按曲线③的起始氢碳比投料,充入
恒容密闭容器中按曲线③的起始氢碳比投料,充入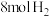 和
和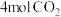 ,发生反应
,发生反应 ,达到平衡。已知该反应速率
,达到平衡。已知该反应速率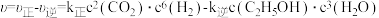 ,其中
,其中 、
、 分别为正、逆反应速率常数,
分别为正、逆反应速率常数, 为物质的量浓度。
为物质的量浓度。①a、b、c处
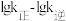 的大小关系为
的大小关系为②
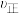 :a
:a③a点处

您最近一年使用:0次



