铜冶炼过程中,产生的粗硫酸镍废液中含有Cu2+、Fe2+、Ca2+、Mg2+、H3AsO3等杂质微粒,工业生产以此为原料,精制硫酸镍,主要流程如图:
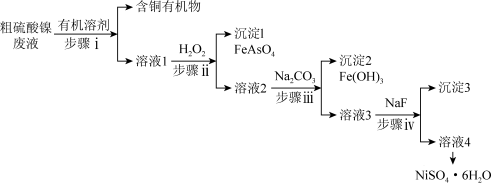
已知:常温下,Fe(OH)3Ksp=2.6×10−39,Ni(OH)2Ksp=5.48×10−16,HFKa=6.3×10−4
(1)步骤i的操作名称是____ 。
(2)①H3AsO3中As的化合价为____ 。
②步骤ii中H2O2的作用是____ 。
(3)步骤iii,加入Na2CO3的目的是通过调pH进一步去除Fe3+,使c(Fe3+)≤2.5×10-4mol•L-1,若溶液2中c(Ni2+)=0.0548mol•L-1,则需控制pH的大致范围为____ 。
(4)①步骤iv,沉淀3的主要成分有____ (填化学式)。
②在加入NaF的同时需调pH约为5,若pH过低,导致沉淀率下降,原因是____ 。
(5)结合图说明由溶液4得到NiSO4•6H2O的操作是____ 。
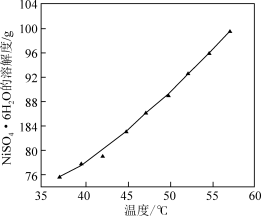

已知:常温下,Fe(OH)3Ksp=2.6×10−39,Ni(OH)2Ksp=5.48×10−16,HFKa=6.3×10−4
(1)步骤i的操作名称是
(2)①H3AsO3中As的化合价为
②步骤ii中H2O2的作用是
(3)步骤iii,加入Na2CO3的目的是通过调pH进一步去除Fe3+,使c(Fe3+)≤2.5×10-4mol•L-1,若溶液2中c(Ni2+)=0.0548mol•L-1,则需控制pH的大致范围为
(4)①步骤iv,沉淀3的主要成分有
②在加入NaF的同时需调pH约为5,若pH过低,导致沉淀率下降,原因是
(5)结合图说明由溶液4得到NiSO4•6H2O的操作是

更新时间:2022-11-04 08:49:13
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】实验小组对Cr(Ⅲ)与过氧化氢反应的影响因素进行了探究,实验过程如下:实验1:探究pH对Cr(Ⅲ)与过氧化氢反应的影响
1.室温下,加酸或碱调节0.1mol/LCr2(SO4)3溶液pH分别为2.00、4.10、6.75、8.43、10.03、13.37。
2.各取5mL上述溶液分置于6支试管中,分别向其中逐滴加入30%H2O2溶液,直至溶液不再发生变化,观察并记录现象。
pH对Cr(Ⅲ)与过氧化氢反应的影响
查阅资料:
①Cr3+为绿色,CrO 为亮绿色,CrO
为亮绿色,CrO 为黄色。
为黄色。
②Cr3+较稳定,需用较强氧化剂才能将其氧化;CrO 在碱性溶液中是较强的还原剂。
在碱性溶液中是较强的还原剂。
(1)Cr(OH)3为蓝色固体,写出⑤中生成蓝色沉淀的离子方程式_____ 。
(2)试管①②中溶液未发生明显变化,可能的原因是_____ 。
(3)④中沉淀溶解,溶液变为亮黄色,可能发生反应的离子方程式是_____ 。
(4)Cr(OH)3与Al(OH)3类似,具有两性。存在如下关系:Cr3++3OH- Cr(OH)3
Cr(OH)3 CrO
CrO +H++H2O。解释实验1中,随着溶液pH升高,终点溶液颜色变化的原因
+H++H2O。解释实验1中,随着溶液pH升高,终点溶液颜色变化的原因______ 。
实验2:探究温度对Cr(Ⅲ)与过氧化氢反应的影响
各取5mLpH=13.50Cr2(SO4)3溶液分置于5支试管中,将其分置于0℃、25℃、50℃、75℃、100℃的水浴中,然后向试管中各滴加过量30%H2O2溶液,观察并记录实验现象:
温度对Cr(Ⅲ)与30%H2O2反应的影响
(5)随着反应温度的升高,反应后溶液颜色由红棕色向亮黄色转变,是因为生成的红色物质CrO (Cr为+5价)不稳定,自身发生氧化还原反应,随着温度升高会逐渐转化为亮黄色的CrO
(Cr为+5价)不稳定,自身发生氧化还原反应,随着温度升高会逐渐转化为亮黄色的CrO ,同时生成氧气。发生反应的离子方程式是
,同时生成氧气。发生反应的离子方程式是______ 。
(6)反应物浓度也是影响反应的因素之一。请利用实验1给出的试剂,设计实验进行验证_____ 。
(7)综上所述,Cr(III)与过氧化氢的反应产物与_____ 密切相关。
1.室温下,加酸或碱调节0.1mol/LCr2(SO4)3溶液pH分别为2.00、4.10、6.75、8.43、10.03、13.37。
2.各取5mL上述溶液分置于6支试管中,分别向其中逐滴加入30%H2O2溶液,直至溶液不再发生变化,观察并记录现象。
pH对Cr(Ⅲ)与过氧化氢反应的影响
| 试管 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| pH | 2.00 | 4.10 | 6.75 | 8.43 | 10.03 | 13.37 |
| 起始现象 | 墨绿色 溶液 | 墨绿色 溶液 | 蓝色 浑浊液 | 蓝色 浑浊液 | 蓝色 浑浊液 | 亮绿色 溶液 |
| 终点现象 | 墨绿色 | 墨绿色 | 黄绿色 | 亮黄色 | 橙红色 | 砖红色 |
①Cr3+为绿色,CrO
 为亮绿色,CrO
为亮绿色,CrO 为黄色。
为黄色。②Cr3+较稳定,需用较强氧化剂才能将其氧化;CrO
 在碱性溶液中是较强的还原剂。
在碱性溶液中是较强的还原剂。(1)Cr(OH)3为蓝色固体,写出⑤中生成蓝色沉淀的离子方程式
(2)试管①②中溶液未发生明显变化,可能的原因是
(3)④中沉淀溶解,溶液变为亮黄色,可能发生反应的离子方程式是
(4)Cr(OH)3与Al(OH)3类似,具有两性。存在如下关系:Cr3++3OH-
 Cr(OH)3
Cr(OH)3 CrO
CrO +H++H2O。解释实验1中,随着溶液pH升高,终点溶液颜色变化的原因
+H++H2O。解释实验1中,随着溶液pH升高,终点溶液颜色变化的原因实验2:探究温度对Cr(Ⅲ)与过氧化氢反应的影响
各取5mLpH=13.50Cr2(SO4)3溶液分置于5支试管中,将其分置于0℃、25℃、50℃、75℃、100℃的水浴中,然后向试管中各滴加过量30%H2O2溶液,观察并记录实验现象:
温度对Cr(Ⅲ)与30%H2O2反应的影响
| 反应温度 | 0℃ | 25℃ | 50℃ | 75℃ | 100℃ |
| 起始现象 | 墨绿色 | ||||
| 终点现象 | 红棕色 | 砖红色 | 橙红色 | 亮黄色 | 亮黄色 |
 (Cr为+5价)不稳定,自身发生氧化还原反应,随着温度升高会逐渐转化为亮黄色的CrO
(Cr为+5价)不稳定,自身发生氧化还原反应,随着温度升高会逐渐转化为亮黄色的CrO ,同时生成氧气。发生反应的离子方程式是
,同时生成氧气。发生反应的离子方程式是(6)反应物浓度也是影响反应的因素之一。请利用实验1给出的试剂,设计实验进行验证
(7)综上所述,Cr(III)与过氧化氢的反应产物与
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】I 铁及其化合物之间的相互转化可用下式表示:

回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是___________________ 。
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2= 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是___________ ,每生成l mol Na2FeO4转移____________ mol电子。
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:
Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:_______________ 。
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为___________ 。
II某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备 。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
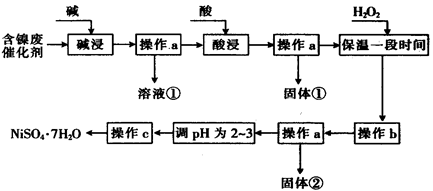
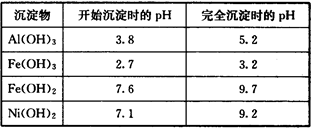
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)“碱浸”过程中发生反应的离子方程式是____________ 。
(2)“酸浸”时所加入的酸是____________________ (填化学式)。
(3)加入H2O2时发生反应的离子方程式为__________________
(4)操作b为调节溶液的pH,你认为pH的调控范围是__________________
(5)NiS04·7Hz0可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为__________________ 。

回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2= 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:
Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为
II某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备
 。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式沉淀时的pH如下:

(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是
(5)NiS04·7Hz0可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
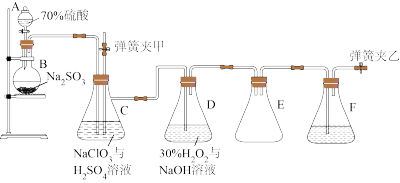
【推荐3】二氧化氯泡腾片是一种常用的含氯消毒剂,其主要成分是亚氯酸钠(NaClO2)。NaClO2的制备原理为:用SO2与NaClO3制取ClO2气体,再由ClO2在强碱性条件下与过量的H2O2反应制得(装置如图所示)。
已知:①NaClO2碱性溶液稳定,酸性溶液会分解
②无水NaClO2常温稳定,有水存在时加热到130°C分解;
③NaClO2饱和溶液在温度低于38°C时析出的晶体是NaClO2•3H2O,高于38°C时析出晶体是NaClO2。
(1)装置C用于制备ClO2气体,同时生成NaHSO4,写出该反应的化学方程式:_______ 。
(2)将C中产生的ClO2通入装置D中制备NaClO2,反应温度需控制在3°C,写出该反应的离子方程式:____ 。
(3)反应结束后,将D中混合物减压蒸发浓缩,冷却结晶可获得NaClO2晶体。结晶时温度需保持在40~55°C,原因是_______ 。
(4)保持反应时间、反应物和溶剂的用量不变,实验中提高ClO2吸收率的措施有(写出一种即可)_____ 。
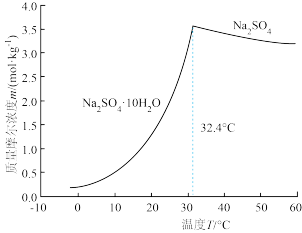
(5)装置C所得溶液中主要溶质为Na2SO4和NaHSO4,直接排放会污染环境且浪费资源,经处理后可获得芒硝(Na2SO4·10H2O)。请补充完整由装置C中所得溶液制取Na2SO4·10H2O的实验方案:_____________ (实验中须使用的试剂和仪器有:NaOH溶液、冰水、pH计)。已知:Na2SO4的溶解度曲线如图所示。

已知:①NaClO2碱性溶液稳定,酸性溶液会分解
②无水NaClO2常温稳定,有水存在时加热到130°C分解;
③NaClO2饱和溶液在温度低于38°C时析出的晶体是NaClO2•3H2O,高于38°C时析出晶体是NaClO2。
(1)装置C用于制备ClO2气体,同时生成NaHSO4,写出该反应的化学方程式:
(2)将C中产生的ClO2通入装置D中制备NaClO2,反应温度需控制在3°C,写出该反应的离子方程式:
(3)反应结束后,将D中混合物减压蒸发浓缩,冷却结晶可获得NaClO2晶体。结晶时温度需保持在40~55°C,原因是
(4)保持反应时间、反应物和溶剂的用量不变,实验中提高ClO2吸收率的措施有(写出一种即可)
(5)装置C所得溶液中主要溶质为Na2SO4和NaHSO4,直接排放会污染环境且浪费资源,经处理后可获得芒硝(Na2SO4·10H2O)。请补充完整由装置C中所得溶液制取Na2SO4·10H2O的实验方案:

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】NOx、SO2是大气的主要污染物。研究消除NOx、SO2的方法和机理一直是环境专家不断追求的目标。
I.南京大学某教授研究团队以CO同时还原NOx和SO2过程为研究对象,发现在一定温度下,平衡体系中发生的反应为:
①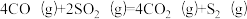
②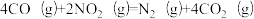
在该温度下,总压为4MPa条件下,以n(CO):n(SO2):n(NO2)=2:1:1通入,t1s后达到平衡,CO2的分压为aMPa,N2的分压为bMPa。
(1)当t1s达平衡时,以CO表示的反应速率为______________________ MPa/s。
(2)反应①在该温度下的Kp=_________________ (MPa)-1。(列出计算式即可,无需化简)
Ⅱ.东南大学化工团队在酸性的条件下,以电化学原理消除NOx、SO2,同时又变废为宝。
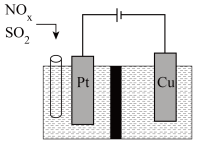
(3)写出NOx转化的电极反应方程式:________________ 。
(4)电解生成的硫酸,电离方程式可表示为: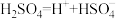 ,
, 。
。
①25°C时,Na2SO4溶液的pH________________ (填“>”“<”或“=”)7。
②0.100mol.L-1的稀硫酸中,c(H+)=0.109mol.L-1,求硫酸第二步电离的电离常数:________________ (写出计算过程,结果保留三位有效数字)。
I.南京大学某教授研究团队以CO同时还原NOx和SO2过程为研究对象,发现在一定温度下,平衡体系中发生的反应为:
①
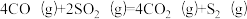
②
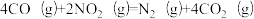
在该温度下,总压为4MPa条件下,以n(CO):n(SO2):n(NO2)=2:1:1通入,t1s后达到平衡,CO2的分压为aMPa,N2的分压为bMPa。
(1)当t1s达平衡时,以CO表示的反应速率为
(2)反应①在该温度下的Kp=
Ⅱ.东南大学化工团队在酸性的条件下,以电化学原理消除NOx、SO2,同时又变废为宝。

(3)写出NOx转化的电极反应方程式:
(4)电解生成的硫酸,电离方程式可表示为:
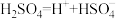 ,
, 。
。①25°C时,Na2SO4溶液的pH
②0.100mol.L-1的稀硫酸中,c(H+)=0.109mol.L-1,求硫酸第二步电离的电离常数:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】研究发现百多种植物富含草酸,尤以菠菜、苋菜、甜菜、马齿苋、芋头、甘薯和大黄等植物中含量最高,由于草酸可降低矿质元素的生物利用率,在人体中容易与钙离子形成草酸钙导致肾结石,草酸往往被认为是一种矿质元素吸收利用的拮抗物。
已知:草酸( )是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。
)是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。
(1)草酸的制备:在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示。
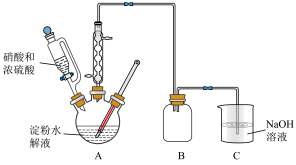
①55~60℃时,装置A中生成 ,同时生成NO。写出该反应的化学方程式:
,同时生成NO。写出该反应的化学方程式:___________ 。
②该实验中催化剂浓硫酸用量不宜过量的原因是___________ 。(答出一点即可)
③装置C的作用是___________ 。
(2)下列事实不能证明草酸是弱电解质的是___________(填字母)。
(3)向10mL
 溶液中加入
溶液中加入 NaOH溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:
NaOH溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:
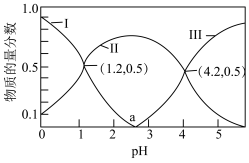
①写出草酸的一级电离方程式:___________ 。
②25℃时,碳酸电离平衡常数分别是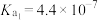 ,
, ,写出少量草酸和过量碳酸钠反应的离子方程式:
,写出少量草酸和过量碳酸钠反应的离子方程式:___________ 。
已知:草酸(
 )是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。
)是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。(1)草酸的制备:在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示。

①55~60℃时,装置A中生成
 ,同时生成NO。写出该反应的化学方程式:
,同时生成NO。写出该反应的化学方程式:②该实验中催化剂浓硫酸用量不宜过量的原因是
③装置C的作用是
(2)下列事实不能证明草酸是弱电解质的是___________(填字母)。
A.草酸能使酸性 溶液褪色 溶液褪色 |
B.常温下,0.1mol/L的 溶液的pH=2 溶液的pH=2 |
C.相同条件下,浓度均为0.1mol/L的 溶液的导电能力比硫酸的导电能力弱 溶液的导电能力比硫酸的导电能力弱 |
D. 溶液中存在 溶液中存在 分子,呈酸性 分子,呈酸性 |

 溶液中加入
溶液中加入 NaOH溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:
NaOH溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:
①写出草酸的一级电离方程式:
②25℃时,碳酸电离平衡常数分别是
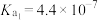 ,
, ,写出少量草酸和过量碳酸钠反应的离子方程式:
,写出少量草酸和过量碳酸钠反应的离子方程式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】含钴的化合物在实际生活中应用比较广泛,回答下列有关问题。
(1)用(NH4)2C2O4溶液和CoCl2溶液为原料制取难溶于水的CoC2O4·2H2O晶体。
①已知25℃,Kb(NH3·H2O)=1.8×10-5,H2C2O4的Ka1=5.6×10-2,Ka2=5.4×10-5。(NH4)2C2O4溶液的pH_________ (填“>”“=”或“<”)7。
②反应时,使(NH4)2C2O4过量的原因是_____________ 。
(2)某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用,某校研究小组尝试回收废旧正极材料中的钴

25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,一段时间后正极粉与铝箔剥离。
①阴极中LiCoO2参与的电极反应式为:_______________ 。
②该研究小组发现硫酸浓度对钴的漫出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol·L-1时,钴的浸出率下降,其原因可能为________ 。
③正极材料含有钴酸锂(LiCoO2),没有电解完,可以用H2O2和稀H2SO4将其溶解得到Co2+,写出反应的化学方程式____________ ,温度不能太高的原因是_________ 。
(1)用(NH4)2C2O4溶液和CoCl2溶液为原料制取难溶于水的CoC2O4·2H2O晶体。
①已知25℃,Kb(NH3·H2O)=1.8×10-5,H2C2O4的Ka1=5.6×10-2,Ka2=5.4×10-5。(NH4)2C2O4溶液的pH
②反应时,使(NH4)2C2O4过量的原因是
(2)某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用,某校研究小组尝试回收废旧正极材料中的钴

25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,一段时间后正极粉与铝箔剥离。
①阴极中LiCoO2参与的电极反应式为:
②该研究小组发现硫酸浓度对钴的漫出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol·L-1时,钴的浸出率下降,其原因可能为
③正极材料含有钴酸锂(LiCoO2),没有电解完,可以用H2O2和稀H2SO4将其溶解得到Co2+,写出反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】石棉尾矿主要含有Mg3(Si2O5)(OH)和少量的Fe2O3、Al2O3。以石棉尾矿为镁源制备碳酸镁晶体(MgCO3·nH2O)的工艺如图:

已知“焙烧”过程中的主反应为:Mg3(Si2O5)(OH)4+5(NH4)2SO4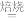 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
(1)写出焙烧产物NH3的电子式__ 。
(2)为提高水浸速率,可采取的措施为__ (任写一条即可),“浸渣”的主要成分为___ 。
(3)①“调节pH除杂”时,除去的杂质离子是__ ,室温下,若要将溶液中的c(Fe3+)降低至4.0×10-11mol/L,则应控制溶液的pH=___ (Ksp[Fe(OH)3]=4.0×10-38)。
②“调节pH除杂”时,可以选用的试剂是___ 。
A.MgO B.NaOH C.MgCO3 D.HNO3
(4)“沉镁”过程中反应的离子方程式为___ 。“沉镁”时若温度超过60℃,将产生较多的碱式碳酸镁[Mg2(OH)2CO3]杂质,原因是__ 。
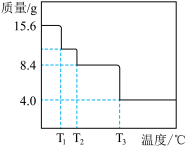
(5)某小组同学称取15.6gMgCO3·nH2O进行热重分析,并绘制剩余固体质量随温度变化的曲线如图所示,则n=__ 。

已知“焙烧”过程中的主反应为:Mg3(Si2O5)(OH)4+5(NH4)2SO4
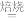 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑(1)写出焙烧产物NH3的电子式
(2)为提高水浸速率,可采取的措施为
(3)①“调节pH除杂”时,除去的杂质离子是
②“调节pH除杂”时,可以选用的试剂是
A.MgO B.NaOH C.MgCO3 D.HNO3
(4)“沉镁”过程中反应的离子方程式为
(5)某小组同学称取15.6gMgCO3·nH2O进行热重分析,并绘制剩余固体质量随温度变化的曲线如图所示,则n=

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】氯化钴渗入水泥中可以制备彩色水泥(变色水泥)。以某废钴渣(主要成分为Co2O3,含少量Fe3O4、Al2O3、CaO和SiO2)制备氯化钴晶体的一种流程如下:

已知:在酸性条件下,氧化性Co3>Cl2>H2O2>Fe3+。
请回答下列问题:
(1)提高废钴渣溶解速率的措施宜采用_______ (填两条)。
(2)在滤液A中加入H2O2,H2O2作还原剂的离子方程式为________________________ 。
(3)从滤渣B中提取铁红的操作是将滤渣B溶于过量的______________ 溶液(填化学式),____________ ,洗涤、灼烧得到铁红。
(4)从环境保护角度分析,不用浓盐酸替代硫酸的原因是__________________________ 。
(5)已知常温下,Ksp[Al(OH)3]≈1.0×1034。当pH=5时,c(Al3)=___________ mol·L1。
(6)为了测定CoCl2•nH2O中结晶水数目进行如下实验:取16.6 g样品在一定条件下脱水得13.0g CoCl2,则n=__________ 。

已知:在酸性条件下,氧化性Co3>Cl2>H2O2>Fe3+。
请回答下列问题:
(1)提高废钴渣溶解速率的措施宜采用
(2)在滤液A中加入H2O2,H2O2作还原剂的离子方程式为
(3)从滤渣B中提取铁红的操作是将滤渣B溶于过量的
(4)从环境保护角度分析,不用浓盐酸替代硫酸的原因是
(5)已知常温下,Ksp[Al(OH)3]≈1.0×1034。当pH=5时,c(Al3)=
(6)为了测定CoCl2•nH2O中结晶水数目进行如下实验:取16.6 g样品在一定条件下脱水得13.0g CoCl2,则n=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
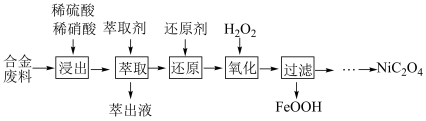
【推荐3】草酸镍 是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图:
是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图:
已知:①“浸出”液含有的离子主要有 ;
;
② 增大,
增大, 被氧化的速率加快,同时生成的
被氧化的速率加快,同时生成的 水解形成更多的胶体能吸附
水解形成更多的胶体能吸附 。
。
③草酸的
(1)生产时为提高合金废料浸出率,常采取的措施有______ (填字母)。
a.适当延长浸出时间 b.高温浸出 c.分批加入混酸浸取并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是______ 。
(3)“氧化”过程中,控制 小于3的条件下进行。
小于3的条件下进行。
① 的电子式为
的电子式为______ 。②“氧化”过程的离子方程式为______ 。
③ 为3~4时,镍的回收率降低的原因是
为3~4时,镍的回收率降低的原因是______ 。
(4)已知常温下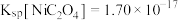 ,当溶液
,当溶液 时,
时, 沉淀完全[
沉淀完全[ 时认为完全沉淀],则此时溶液中草酸的浓度
时认为完全沉淀],则此时溶液中草酸的浓度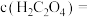
______ 。
(5)在空气中加热二水合草酸镍得到如下TT-DSC热分解曲线如图所示,已知: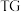 指的是在程序控制温度下测量待测样品的质量与温度变化关系,DSC指通过单独的加热器补偿样品在加热过程中发生的热量变化,以保持样品和参比物的温差为零。这种补偿能量即样品吸收(峰向下)或放出(峰向上)的热量。则
指的是在程序控制温度下测量待测样品的质量与温度变化关系,DSC指通过单独的加热器补偿样品在加热过程中发生的热量变化,以保持样品和参比物的温差为零。这种补偿能量即样品吸收(峰向下)或放出(峰向上)的热量。则 时,反应的化学方程式为
时,反应的化学方程式为______ 。二水合草酸镍分解的整个反应是______ (填“吸热”或“放热”)反应。

 是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图:
是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图:
已知:①“浸出”液含有的离子主要有
 ;
;②
 增大,
增大, 被氧化的速率加快,同时生成的
被氧化的速率加快,同时生成的 水解形成更多的胶体能吸附
水解形成更多的胶体能吸附 。
。③草酸的

(1)生产时为提高合金废料浸出率,常采取的措施有
a.适当延长浸出时间 b.高温浸出 c.分批加入混酸浸取并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是
(3)“氧化”过程中,控制
 小于3的条件下进行。
小于3的条件下进行。①
 的电子式为
的电子式为③
 为3~4时,镍的回收率降低的原因是
为3~4时,镍的回收率降低的原因是(4)已知常温下
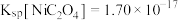 ,当溶液
,当溶液 时,
时, 沉淀完全[
沉淀完全[ 时认为完全沉淀],则此时溶液中草酸的浓度
时认为完全沉淀],则此时溶液中草酸的浓度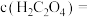
(5)在空气中加热二水合草酸镍得到如下TT-DSC热分解曲线如图所示,已知:
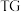 指的是在程序控制温度下测量待测样品的质量与温度变化关系,DSC指通过单独的加热器补偿样品在加热过程中发生的热量变化,以保持样品和参比物的温差为零。这种补偿能量即样品吸收(峰向下)或放出(峰向上)的热量。则
指的是在程序控制温度下测量待测样品的质量与温度变化关系,DSC指通过单独的加热器补偿样品在加热过程中发生的热量变化,以保持样品和参比物的温差为零。这种补偿能量即样品吸收(峰向下)或放出(峰向上)的热量。则 时,反应的化学方程式为
时,反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】我国科学家开发催化剂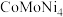 来提高
来提高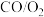 燃料电池的性能。某小组以含镍废料(主要含
燃料电池的性能。某小组以含镍废料(主要含 、
、 ,以及少量
,以及少量 、
、 、
、 、
、 、
、 、
、 和
和 等)为原料提取镍的流程如下:
等)为原料提取镍的流程如下:
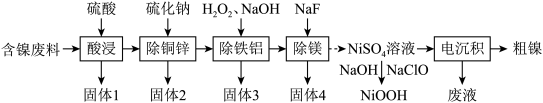
已知常温下部分难溶物的 如表所示:
如表所示:
请回答下列问题:
(1)“酸浸”中产生了一种还原性气体,它是_______ (填化学式);“除铁铝”中双氧水的作用是_______ 。
(2)“固体2”中除 、
、 外,还可能含硫单质等物质,生成硫单质的离子方程式为
外,还可能含硫单质等物质,生成硫单质的离子方程式为_______ 。
(3)为提高原料利用率,“电沉积”得到的“废液”可以循环用于_______ (填名称)工序。
(4)常温下,在“除铁铝”中,当滤液中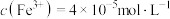 时,其
时,其
_______ 。
(5)可以通过电解法提纯镍,粗镍作_______ (填“阳”或“阴”)极,阴极的电极反应式为_______ 。
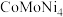 来提高
来提高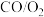 燃料电池的性能。某小组以含镍废料(主要含
燃料电池的性能。某小组以含镍废料(主要含 、
、 ,以及少量
,以及少量 、
、 、
、 、
、 、
、 、
、 和
和 等)为原料提取镍的流程如下:
等)为原料提取镍的流程如下:
已知常温下部分难溶物的
 如表所示:
如表所示:| 物质 |  |  |  |  |  |  |  |
 |  | 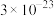 | 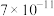 | 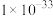 | 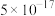 | 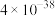 | 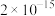 |
(1)“酸浸”中产生了一种还原性气体,它是
(2)“固体2”中除
 、
、 外,还可能含硫单质等物质,生成硫单质的离子方程式为
外,还可能含硫单质等物质,生成硫单质的离子方程式为(3)为提高原料利用率,“电沉积”得到的“废液”可以循环用于
(4)常温下,在“除铁铝”中,当滤液中
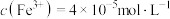 时,其
时,其
(5)可以通过电解法提纯镍,粗镍作
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】K3[Fe(C2O4)3](三草酸合铁酸钾)为亮绿色晶体,易溶于热水,在工业上具有一定的应用价值。
请回答下列问题:
(1)三草酸合铁酸钾在一定条件下能分解产生CO2和CO两种气体。某化学小组设计了如图所示的装置(夹持装置等略去),来验证这两种气体产物。
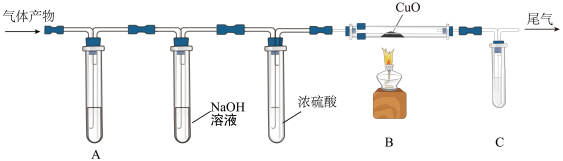
则A、C装置中的试剂均为___________ ;NaOH溶液的作用是___________ ;B装置硬质玻璃管中反应的化学方程式为___________ ;实验前需先通入N2排除装置内的空气,其原因是___________ 。
(2)实验室制备三草酸合铁酸钾的操作如下:称取5g(NH4)2Fe(SO4)2·6H2O固体置于烧杯中,加入15mL水和几滴稀硫酸,搅拌充分溶解。再加入25mL饱和H2C2O4溶液,加热至沸,生成黄色沉淀FeC2O4·2H2O。静置,倾去上层清液,将沉淀洗涤干净,向其中加入过量饱和K2C2O4溶液,水浴加热至40℃,边搅拌边缓慢滴加H2O2溶液,沉淀逐渐变为红褐色。将混合物继续煮沸,加入饱和H2C2O4溶液,红褐色沉淀溶解,趁热过滤。待滤液冷却后,析出亮绿色晶体,过滤、洗涤、干燥,可得到产品。则加入稀硫酸的作用是___________ ;滴加H2O2溶液生成K3[Fe(C2O4)3]和红褐色沉淀的化学方程式为___________ ;红褐色沉淀溶解得到K3[Fe(C2O4)3]的化学方程式为___________ ;滴加H2O2溶液时混合物的温度不宜过高的原因是___________ ;过滤操作中需用到的玻璃仪器有___________ (写出2种即可)。
请回答下列问题:
(1)三草酸合铁酸钾在一定条件下能分解产生CO2和CO两种气体。某化学小组设计了如图所示的装置(夹持装置等略去),来验证这两种气体产物。

则A、C装置中的试剂均为
(2)实验室制备三草酸合铁酸钾的操作如下:称取5g(NH4)2Fe(SO4)2·6H2O固体置于烧杯中,加入15mL水和几滴稀硫酸,搅拌充分溶解。再加入25mL饱和H2C2O4溶液,加热至沸,生成黄色沉淀FeC2O4·2H2O。静置,倾去上层清液,将沉淀洗涤干净,向其中加入过量饱和K2C2O4溶液,水浴加热至40℃,边搅拌边缓慢滴加H2O2溶液,沉淀逐渐变为红褐色。将混合物继续煮沸,加入饱和H2C2O4溶液,红褐色沉淀溶解,趁热过滤。待滤液冷却后,析出亮绿色晶体,过滤、洗涤、干燥,可得到产品。则加入稀硫酸的作用是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
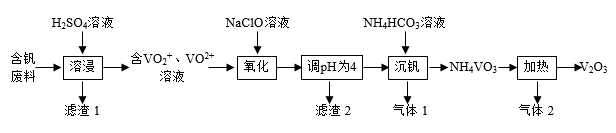
【推荐3】Ⅰ.钒及其化合物在工业生产中有着广泛的应用,可作为制硫酸的催化剂,从含钒废料(含有V2O5、V2O4、SiO2、Fe2O3等)中回收V2O5的流程如下:
已知:NH4VO3微溶于冷水,易溶于热水,不溶于乙醇。
回答下列问题:
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有______ (写出一条),滤渣1的成分是_____________ ,酸浸时V2O4发生反应的离子方程式为_______________ 。
(2) “氧化反应”反应中还原剂与氧化剂的物质的量之比为______ 。
(3)该流程中可循环利用的物质有______ (填化学式)。
(4)已知 +2H+
+2H+
 +H2O,“沉钒”过程中,主要反应的离子方程式为
+H2O,“沉钒”过程中,主要反应的离子方程式为______ 。沉钒后为了得到尽可能多的NH4VO3,需要进行的主要操作有:冷却过滤、___________ 。
Ⅱ.全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。如图是钒电池基本工作原理示意图:

请回答下列问题:
(5)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、 )为正极和负极电极反应的活性物质,电池总反应为V2++
)为正极和负极电极反应的活性物质,电池总反应为V2++ +2H+
+2H+ VO2++V3++H2O。放电时的负极反应式为
VO2++V3++H2O。放电时的负极反应式为______________________ ,充电时的阳极极反应式为_____________ 。
(6)钒电池基本工作原理示意图中“负极电解液”可能是________ 。
a. 、VO2+混合液b.V3+、V2+混合液c.
、VO2+混合液b.V3+、V2+混合液c. 溶液d.VO2+溶液e.V3+溶液f.V2+溶液
溶液d.VO2+溶液e.V3+溶液f.V2+溶液

已知:NH4VO3微溶于冷水,易溶于热水,不溶于乙醇。
回答下列问题:
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有
(2) “氧化反应”反应中还原剂与氧化剂的物质的量之比为
(3)该流程中可循环利用的物质有
(4)已知
 +2H+
+2H+
 +H2O,“沉钒”过程中,主要反应的离子方程式为
+H2O,“沉钒”过程中,主要反应的离子方程式为Ⅱ.全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。如图是钒电池基本工作原理示意图:

请回答下列问题:
(5)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、
 )为正极和负极电极反应的活性物质,电池总反应为V2++
)为正极和负极电极反应的活性物质,电池总反应为V2++ +2H+
+2H+ VO2++V3++H2O。放电时的负极反应式为
VO2++V3++H2O。放电时的负极反应式为(6)钒电池基本工作原理示意图中“负极电解液”可能是
a.
 、VO2+混合液b.V3+、V2+混合液c.
、VO2+混合液b.V3+、V2+混合液c. 溶液d.VO2+溶液e.V3+溶液f.V2+溶液
溶液d.VO2+溶液e.V3+溶液f.V2+溶液
您最近一年使用:0次



