CH4与CO2催化重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
反应I:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH1=247.4kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=41.2kJ·mol-1
反应Ⅲ:CH4(g)+ O2(g)⇌CO(g)+2H2(g) ΔH3=-35.6 kJ·mol-1
O2(g)⇌CO(g)+2H2(g) ΔH3=-35.6 kJ·mol-1
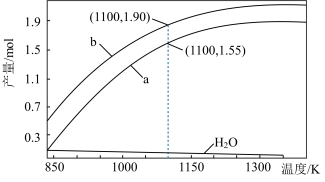
一定条件下,向体积为VL的密闭容器中通入CH4、CO2各1.0mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示。下列说法正确的是
反应I:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH1=247.4kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=41.2kJ·mol-1
反应Ⅲ:CH4(g)+
 O2(g)⇌CO(g)+2H2(g) ΔH3=-35.6 kJ·mol-1
O2(g)⇌CO(g)+2H2(g) ΔH3=-35.6 kJ·mol-1一定条件下,向体积为VL的密闭容器中通入CH4、CO2各1.0mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示。下列说法正确的是

| A.图中曲线b表示H2的平衡产量随温度的变化曲线 |
B.1100K时,CH4与CO2的转化率分别为95%、90%,反应I的平衡常数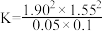 |
| C.反应CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH=206.2kJ·mol-1 |
| D.若选用其它催化剂可能使平衡时H2O的产量随着温度升高而增加 |
22-23高三上·江苏徐州·期中 查看更多[3]
江苏省徐州市第七中学2022-2023学年高三上学期期中抽测化学试题(已下线)仿真卷02-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)江苏省徐州市2022-2023学年高三上学期11月期中考试化学试题
更新时间:2022-11-29 16:59:08
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列说法正确的是
A.固氮反应: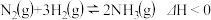 ,升高温度,正反应速率减小 ,升高温度,正反应速率减小 |
B.炭基化法精炼镍: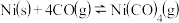 ,增加 ,增加 的用量,可加快该反应速率 的用量,可加快该反应速率 |
C.工业上制水煤气: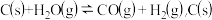 的质量不再改变,反应达到平衡 的质量不再改变,反应达到平衡 |
D.乙苯催化脱氢法制苯乙烯: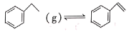 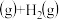 ,恒温恒压下,充入 ,恒温恒压下,充入 ,平衡不移动 ,平衡不移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】硝酸是一种具有强氧化性、腐蚀性的强酸。硝酸工业与合成氨工业紧密相关,氨氧化法是工业生产中制取硝酸的主要途径,其主要流程是将氨和空气的混合气通入灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。生成的一氧化氮利用反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸。4NH3+5O2 4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO。已知4NH3(g)+5O2(g)
4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO。已知4NH3(g)+5O2(g) 4NO(g)+6H2O(g)为可逆反应,下列有关说法不正确的是
4NO(g)+6H2O(g)为可逆反应,下列有关说法不正确的是
 4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO。已知4NH3(g)+5O2(g)
4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO。已知4NH3(g)+5O2(g) 4NO(g)+6H2O(g)为可逆反应,下列有关说法不正确的是
4NO(g)+6H2O(g)为可逆反应,下列有关说法不正确的是| A.反应△S>0 |
| B.反应中生成22.4LNO时,转移2.5mol电子 |
| C.氨气在足量的氧气中,催化氧化的产物是NO |
| D.减压、增加氧气能提高氨气的平衡转化率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列各图叙述正确的是


A.甲表示 与 与 发生反应过程中的能量变化, 发生反应过程中的能量变化, 的燃烧热为 的燃烧热为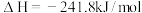 |
B.乙表示恒温恒容条件下反应 中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态 中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C.丙表示A、B两物质的溶解度随温度变化情况,将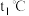 时A、B的饱和溶液分别升温至 时A、B的饱和溶液分别升温至 时,溶质的质量分数 时,溶质的质量分数 |
D.丁表示室温下,将 盐酸滴入 盐酸滴入 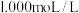 氨水中,溶液pH和温度随加入盐酸体积变化曲线 氨水中,溶液pH和温度随加入盐酸体积变化曲线 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列关于各图象的解释或结论正确的是( )
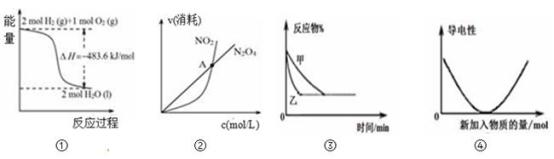

| A.图①可知:热化学方程式是H2(g)+1/2O2(g)=H2O(g)△H=﹣241.8kJ/mol |
B.图②可知:对于恒温恒容条件下的反应2NO2(g) N2O4(g),A点为平衡状态 N2O4(g),A点为平衡状态 |
C.图③可表示:压强对2A(g)+2B(g) 3C(g)+D(s)的影响 3C(g)+D(s)的影响 |
| D.图④可表示:Ba(OH)2溶液中滴加稀硫酸,溶液导电性的变化 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】在3 种不同条件下,分别向容积为2L的恒容密闭容器中充入2 molA和1mol B,发生反应: 2A(g)+B(g) 2D(g)△H=QkJ/mol。相关条件和数据见下表:
2D(g)△H=QkJ/mol。相关条件和数据见下表:
下列说法正确的是
 2D(g)△H=QkJ/mol。相关条件和数据见下表:
2D(g)△H=QkJ/mol。相关条件和数据见下表: | 实验编号 | 实验I | 实验II | 实验III |
| 反应温度/℃ | 700 | 700 | 750 |
| 达平衡时间/min | 40 | 50 | 30 |
| n(D)平衡/mol | 1.5 | 1.5 | 1 |
| 化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是
| A.升高温度能加快反应速率的原理是降低了反应的活化能,使活化分子百分数提高 |
| B.实验III达平衡后,保持其他条件不变,再向容器中通入1molA 和1molD,平衡不移动 |
| C.实验III达平衡后容器内的压强是实验1的9/10倍 |
| D.K3>K2>K1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】可逆反应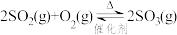 达到平衡状态后,保持温度﹑容器容积不变,向容器中充入一定量的O2,下列说法正确的是(K为平衡常数,Q为浓度商)
达到平衡状态后,保持温度﹑容器容积不变,向容器中充入一定量的O2,下列说法正确的是(K为平衡常数,Q为浓度商)
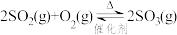 达到平衡状态后,保持温度﹑容器容积不变,向容器中充入一定量的O2,下列说法正确的是(K为平衡常数,Q为浓度商)
达到平衡状态后,保持温度﹑容器容积不变,向容器中充入一定量的O2,下列说法正确的是(K为平衡常数,Q为浓度商)| A.Q不变,K变大,O2的转化率增大 |
| B.Q减小,K不变,O2的转化率减小 |
| C.平衡常数越大表示该反应速率越快 |
| D.化学计量数变为二倍则ΔH值和K值也变为原来的二倍 |
您最近一年使用:0次


 ,达到平衡后,下列措施中不能提高
,达到平衡后,下列措施中不能提高 转化率的是
转化率的是 的浓度
的浓度 液化移出体系
液化移出体系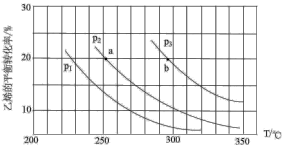
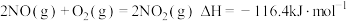 。对于反应
。对于反应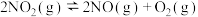 ,下列说法正确的是
,下列说法正确的是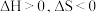
 的平衡转化率
的平衡转化率
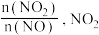 的平衡转化率上升
的平衡转化率上升

