完成下列填空
(1)已知25℃时,水的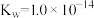 ,醋酸和盐酸是日常生活中常见的酸,在一定条件下,
,醋酸和盐酸是日常生活中常见的酸,在一定条件下, 溶液中存在电离平衡:
溶液中存在电离平衡:
 。下列方法中可以使
。下列方法中可以使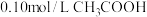 的电离程度增大的是
的电离程度增大的是_______ (填字母)。
a.加入少量 的稀盐酸 b.加热该
的稀盐酸 b.加热该 溶液
溶液
c.加入少量纯 d.加水稀释至
d.加水稀释至
e.加入少量氯化钠晶体 f.加入少量 的NaOH溶液
的NaOH溶液
(2)25℃下,向体积为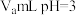 的醋酸溶液中滴加
的醋酸溶液中滴加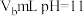 的NaOH溶液,溶液恰好呈中性,则
的NaOH溶液,溶液恰好呈中性,则 与
与 的关系是:
的关系是:
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)常温下将 的盐酸和
的盐酸和 的氢氧化钠溶液等体积混合,则混合后溶液中的
的氢氧化钠溶液等体积混合,则混合后溶液中的
_______  。
。
(4)常温下,测得 悬浊液的
悬浊液的 ,已知
,已知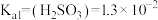 ,
,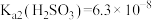 ,忽略第二步水解,
,忽略第二步水解, 约为
约为_______ 。
(5)反应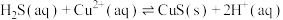 的平衡常数为
的平衡常数为_______ [已知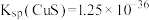 ,
, 的
的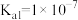 ,
,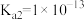 ]
]
(1)已知25℃时,水的
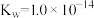 ,醋酸和盐酸是日常生活中常见的酸,在一定条件下,
,醋酸和盐酸是日常生活中常见的酸,在一定条件下, 溶液中存在电离平衡:
溶液中存在电离平衡:
 。下列方法中可以使
。下列方法中可以使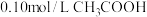 的电离程度增大的是
的电离程度增大的是a.加入少量
 的稀盐酸 b.加热该
的稀盐酸 b.加热该 溶液
溶液c.加入少量纯
 d.加水稀释至
d.加水稀释至
e.加入少量氯化钠晶体 f.加入少量
 的NaOH溶液
的NaOH溶液(2)25℃下,向体积为
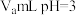 的醋酸溶液中滴加
的醋酸溶液中滴加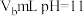 的NaOH溶液,溶液恰好呈中性,则
的NaOH溶液,溶液恰好呈中性,则 与
与 的关系是:
的关系是:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(3)常温下将
 的盐酸和
的盐酸和 的氢氧化钠溶液等体积混合,则混合后溶液中的
的氢氧化钠溶液等体积混合,则混合后溶液中的
 。
。(4)常温下,测得
 悬浊液的
悬浊液的 ,已知
,已知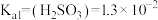 ,
,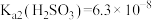 ,忽略第二步水解,
,忽略第二步水解, 约为
约为(5)反应
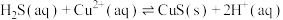 的平衡常数为
的平衡常数为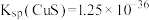 ,
, 的
的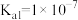 ,
,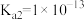 ]
]
更新时间:2022-12-04 19:29:15
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】运用相关原理,回答下列各小题:
I.已知:NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO .
.
(1)常温下,pH=5的NaHSO4溶液中水的电离程度______________ (填“>”、”=”或“<”)pH=9的氨水中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为:______________ (用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH )
)______________ c(SO )(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO
)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO 完全沉淀,则反应后溶液的pH
完全沉淀,则反应后溶液的pH______________ 7(填“>”、”=”或“<”)。
(3)将分别含有MnO 、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有
、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有______________ ,一定不存在的是______________ 。
II.在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为________________ mol·L−1,此时溶液中c(CrO )等于
)等于______________ mol·L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
I.已知:NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO
 .
. (1)常温下,pH=5的NaHSO4溶液中水的电离程度
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为:
 )
) )(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO
)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO 完全沉淀,则反应后溶液的pH
完全沉淀,则反应后溶液的pH(3)将分别含有MnO
 、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有
、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有II.在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为
 )等于
)等于
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】25℃时,将体积为Va、pH=a的某一元强碱与体积为Vb、pH=b的某二元强酸混合。
(1)若所得混合液的pH=11,且a=13,b=2,则Va :Vb=_______ ;
(2)若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4(填“可”或“否”)__ ,其理由是__ 。
(3)为了更好表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg 。25℃时,若溶液呈中性,则AG=
。25℃时,若溶液呈中性,则AG=____ ,溶液的pH与AG的换算公式为AG=_______ (要化简)
(1)若所得混合液的pH=11,且a=13,b=2,则Va :Vb=
(2)若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4(填“可”或“否”)
(3)为了更好表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg
 。25℃时,若溶液呈中性,则AG=
。25℃时,若溶液呈中性,则AG=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】(1)常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是__________ 。
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(2)常温下,浓度均为0.1 mol/L的下列五种溶液的pH如表所示:
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是__________ 。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是________ 。
A.CH3COOH + Na2CO3 ==NaHCO3 + CH3COONa
B.CH3COOH + NaCN ==CH3COONa+ HCN
C.CO2 + H2O+ 2 NaClO ==Na2CO3+2 HClO
D.NaHCO3 + HCN == NaCN+ H2O+ CO2↑
(3)将氨气溶于水得到氨水,是一种弱碱。常温下,现将amol/L氨水和0.01mol/L盐酸等体积混合后,溶液中c(NH4+)=c(Cl-),则氨水的Kb=____________ 。(用含a的代数式表示)
(4)25℃,用0.1000 mol / LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如图。

①为减小实验误差,由图可知滴定时指示剂应选用__________ (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三点所示溶液导电能力最强的是_________ 点对应的溶液;
③比较A、C两点中水的电离程度:A______ C(填“>”、“=”或“<”)。
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(2)常温下,浓度均为0.1 mol/L的下列五种溶液的pH如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是
A.CH3COOH + Na2CO3 ==NaHCO3 + CH3COONa
B.CH3COOH + NaCN ==CH3COONa+ HCN
C.CO2 + H2O+ 2 NaClO ==Na2CO3+2 HClO
D.NaHCO3 + HCN == NaCN+ H2O+ CO2↑
(3)将氨气溶于水得到氨水,是一种弱碱。常温下,现将amol/L氨水和0.01mol/L盐酸等体积混合后,溶液中c(NH4+)=c(Cl-),则氨水的Kb=
(4)25℃,用0.1000 mol / LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如图。

①为减小实验误差,由图可知滴定时指示剂应选用
②A、B、C三点所示溶液导电能力最强的是
③比较A、C两点中水的电离程度:A
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】醋酸是常见的一元弱酸。请运用化学反应原理回答下列问题:
(1)室温下,pH=2的醋酸中,水电离出的c(H+)=___________ mol·L-1该醋酸和pH=2的盐酸溶液相比,导电性___________ (填“相同”“不同”或“无法判断”)。
(2)pH相同的盐酸和醋酸分别与足量的锌粒反应,生成等量的H2时所需时间较短的是___________ 。
(3)向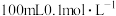 醋酸溶液中滴入
醋酸溶液中滴入 溶液,下列浓度大小顺序不可能出现的是
溶液,下列浓度大小顺序不可能出现的是___________ (填字母)。
a.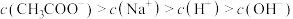
b.
c.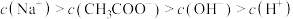
d.
(4)常温下,将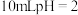 的醋酸溶液稀释至
的醋酸溶液稀释至 ,溶液的
,溶液的
___________ (填“>”“<”或“=”)4;在醋酸稀释过程中下列数值变大的是___________ 。
A. B.
B. C.
C. D.
D.
(5)醋酸中存在平衡: ,下列措施可使醋酸的
,下列措施可使醋酸的 增大,并且电离平衡向右移动的是___________。
增大,并且电离平衡向右移动的是___________。
(1)室温下,pH=2的醋酸中,水电离出的c(H+)=
(2)pH相同的盐酸和醋酸分别与足量的锌粒反应,生成等量的H2时所需时间较短的是
(3)向
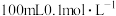 醋酸溶液中滴入
醋酸溶液中滴入 溶液,下列浓度大小顺序不可能出现的是
溶液,下列浓度大小顺序不可能出现的是a.
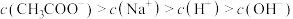
b.

c.
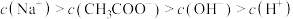
d.

(4)常温下,将
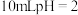 的醋酸溶液稀释至
的醋酸溶液稀释至 ,溶液的
,溶液的
A.
 B.
B. C.
C. D.
D.
(5)醋酸中存在平衡:
 ,下列措施可使醋酸的
,下列措施可使醋酸的 增大,并且电离平衡向右移动的是___________。
增大,并且电离平衡向右移动的是___________。A.加入 溶液 溶液 | B.加入盐酸 | C.加水稀释 | D.对醋酸溶液加热 |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】某化学研究性学习小组通过分组实验来探究盐酸与醋酸电离程度的差异,探究过程如下表:

(1)若甲、乙两组同学用pH试纸测溶液的pH时,均先用蒸馏水润湿pH试纸后再分别测定盐酸、醋酸、醋酸钠、氯化钠4种溶液的pH值,这种操作会导致上述所测的三种溶液的pH值出现偏差,不会出现偏差的溶液是 :____________ ,测得溶液pH>7的有:_____ 。
(2)丙组实验中的两种溶液反应后,收集到的气体体积________ (填“相等”或“不相等”)。
(3)以上3组实验中能证明醋酸是弱酸的是:_____ 及 丙 组(填“甲”、“乙”或“丙”,下同),能证明盐酸是强酸的是____ 组。

(1)若甲、乙两组同学用pH试纸测溶液的pH时,均先用蒸馏水润湿pH试纸后再分别测定盐酸、醋酸、醋酸钠、氯化钠4种溶液的pH值,这种操作会导致上述所测的三种溶液的pH值出现偏差,不会出现偏差的溶液是 :
(2)丙组实验中的两种溶液反应后,收集到的气体体积
(3)以上3组实验中能证明醋酸是弱酸的是:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】焦亚硫酸钠(Na2S2O5)是一种食品添加剂。实验室用如图所示装置制备Na2S2O5,实验步骤如下:

Ⅰ.向Na2CO3溶液中通入SO2至溶液pH为4.1,生成NaHSO3溶液;
Ⅱ.加入碳酸钠粉末至溶液PH为7~8;
Ⅲ.再通入SO2至溶液PH为4.1;
Ⅳ.从过饱和溶液中析出Na2S2O5晶体。
(1)制备焦亚硫酸钠总反应的化学方程式为___________________ 。
(2)Na2S2O5能与水发生化合反应,反应后所得的溶液显酸性。用电离方程式表示溶液显酸性的原因:____________________ 。
(3)利用碘量法可测定Na2S2O5产品中硫的含量。实验中必须使用的试剂有c1mol·L-1的标准碘溶液、c2 mol·L-1的标准Na2S2O3溶液、NaOH溶液、淀粉溶液。已知:Na2S2O5+2I2+3H2O=Na2SO4+H2SO4+4HI,2Na2S2O3+I2= Na2S2O6+2NaI。请补全实验方案:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中,加入—定体积的过量c1 mol • L-1的标准碘溶液,充分反应后滴入NaOH溶液调节溶液pH至中性,____________________________ 。重复上述步骤2次,记录数据。
(4)含铬酸性废水中常含有+ 6价铬。利用Na2S2O5和FeSO4·7H2O分两个阶段先后处理含Cr2O72-的废水, Cr2O72-被还原为Cr3+,实验结果如图。

①0~40 min内用Cr2O72-表示的平均反应速率为____________ mol • L-1 • min-1。
②60~80 min内Cr2O72-与Fe2+发生反应的离子方程式为_________________ 。

Ⅰ.向Na2CO3溶液中通入SO2至溶液pH为4.1,生成NaHSO3溶液;
Ⅱ.加入碳酸钠粉末至溶液PH为7~8;
Ⅲ.再通入SO2至溶液PH为4.1;
Ⅳ.从过饱和溶液中析出Na2S2O5晶体。
(1)制备焦亚硫酸钠总反应的化学方程式为
(2)Na2S2O5能与水发生化合反应,反应后所得的溶液显酸性。用电离方程式表示溶液显酸性的原因:
(3)利用碘量法可测定Na2S2O5产品中硫的含量。实验中必须使用的试剂有c1mol·L-1的标准碘溶液、c2 mol·L-1的标准Na2S2O3溶液、NaOH溶液、淀粉溶液。已知:Na2S2O5+2I2+3H2O=Na2SO4+H2SO4+4HI,2Na2S2O3+I2= Na2S2O6+2NaI。请补全实验方案:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中,加入—定体积的过量c1 mol • L-1的标准碘溶液,充分反应后滴入NaOH溶液调节溶液pH至中性,
(4)含铬酸性废水中常含有+ 6价铬。利用Na2S2O5和FeSO4·7H2O分两个阶段先后处理含Cr2O72-的废水, Cr2O72-被还原为Cr3+,实验结果如图。

①0~40 min内用Cr2O72-表示的平均反应速率为
②60~80 min内Cr2O72-与Fe2+发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】重铬酸钠(Na2Cr2O7)是工业上和实验室常用的强氧化剂,以铬矿石(主要成分Cr2O3,含FeO、MgO、SiO2等杂质)为主要原料制取重铬酸钠晶体Na2Cr2O7·H2O的流程如下:
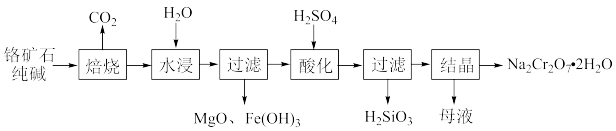
(1)将铬矿石、纯碱混合后在空气中焙烧,有Na2CrO4、NaFeO2和Na2SiO3生成。写出焙烧时生成Na2CrO4的化学反应方程式:_______ 。
(2)写出水浸时NaFeO2所发生反应的化学反应方程式:_______ 。
(3)向过滤后所得MgO、Fe(OH)3沉淀中分批次加入一定量的H2SO4,可以依次溶解MgO和Fe(OH)3。如果要控制溶液中c(Mg2+)>1 mol·L-1、c(Fe3+)<1×10-5 mol·L-1,则需控制溶液的pH的范围是_______ 。{已知Ksp[Mg(OH)2]=1×10-10.8、Ksp[Fe(OH)3]=1×10-37.4}
(4)酸化时Na2CrO4转化为Na2Cr2O7,写出转化时Na2CrO4发生反应的离子方程式:_______ 。
(5)为测定所得Na2Cr2O7·2H2O样品的纯度,现进行如下实验:准确称取样品0.5000g,溶于水配成100mL溶液,取出25.00mL于锥形瓶中,加入足量的硫酸和NaI溶液 的还原产物是Cr3+),充分反应后,滴加淀粉溶液作指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当达到滴定终点时,消耗Na2S2O3标准溶液24.00mL(发生反应I2+2
的还原产物是Cr3+),充分反应后,滴加淀粉溶液作指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当达到滴定终点时,消耗Na2S2O3标准溶液24.00mL(发生反应I2+2 =2I-+
=2I-+ )。计算Na2Cr2O7·2H2O样品的纯度,写出计算过程
)。计算Na2Cr2O7·2H2O样品的纯度,写出计算过程_______ (杂质不参与反应)。

(1)将铬矿石、纯碱混合后在空气中焙烧,有Na2CrO4、NaFeO2和Na2SiO3生成。写出焙烧时生成Na2CrO4的化学反应方程式:
(2)写出水浸时NaFeO2所发生反应的化学反应方程式:
(3)向过滤后所得MgO、Fe(OH)3沉淀中分批次加入一定量的H2SO4,可以依次溶解MgO和Fe(OH)3。如果要控制溶液中c(Mg2+)>1 mol·L-1、c(Fe3+)<1×10-5 mol·L-1,则需控制溶液的pH的范围是
(4)酸化时Na2CrO4转化为Na2Cr2O7,写出转化时Na2CrO4发生反应的离子方程式:
(5)为测定所得Na2Cr2O7·2H2O样品的纯度,现进行如下实验:准确称取样品0.5000g,溶于水配成100mL溶液,取出25.00mL于锥形瓶中,加入足量的硫酸和NaI溶液
 的还原产物是Cr3+),充分反应后,滴加淀粉溶液作指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当达到滴定终点时,消耗Na2S2O3标准溶液24.00mL(发生反应I2+2
的还原产物是Cr3+),充分反应后,滴加淀粉溶液作指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当达到滴定终点时,消耗Na2S2O3标准溶液24.00mL(发生反应I2+2 =2I-+
=2I-+ )。计算Na2Cr2O7·2H2O样品的纯度,写出计算过程
)。计算Na2Cr2O7·2H2O样品的纯度,写出计算过程
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理______________________ 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是_________ (填序号)
A.Ba(NO3)2 B.BaCl2
C.Ba(OH)2 D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是___________ 。
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+ 以Cr(OH)3形式除去,下列说法不正确的是______ (填序号)
A.阳极反应为Fe-2e-═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72-被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作_________ 极(填“正”“负”“阴”或“阳”),其电极反应式为___________ 。

(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是
A.Ba(NO3)2 B.BaCl2
C.Ba(OH)2 D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+ 以Cr(OH)3形式除去,下列说法不正确的是
A.阳极反应为Fe-2e-═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72-被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】工业上以锌矿(主要成分为 ,还有Fe、Mg、Ca等的化合物和
,还有Fe、Mg、Ca等的化合物和 )为原料制备硫酸锌晶体的工艺流程如下。其中沉铁时,通过调控溶液的pH使铁元素形成易过滤的FeOOH铁渣。
)为原料制备硫酸锌晶体的工艺流程如下。其中沉铁时,通过调控溶液的pH使铁元素形成易过滤的FeOOH铁渣。 ;溶液中
;溶液中 较小时,才能顺利析出FeOOH。
较小时,才能顺利析出FeOOH。
回答下列问题:
(1)溶浸过程中,提高浸出率的措施有______ (任写一条即可);滤渣l的成份是______ (填化学式)。
(2)还原时,加入ZnS精矿的目的是转化溶液中 ,反应的离子方程式为
,反应的离子方程式为______ ;沉铁时,适宜调节溶液pH的物质X为______ (填化学式)。若不进行还原而直接沉铁,将导致______ 。
(3)硫酸锌晶体的溶解度与温度的关系如图所示。补全从滤液得到产品级 的操作,
的操作,______ 、过滤、洗涤,干燥。 ,排放前需处理。向废液中加入由
,排放前需处理。向废液中加入由 和
和 组成的缓冲溶液调节pH,通入
组成的缓冲溶液调节pH,通入 发生反应
发生反应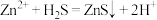 ,处理后的废液中部分微粒浓度见下表。则处理后的废液中
,处理后的废液中部分微粒浓度见下表。则处理后的废液中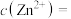
______  [已知:常温下,
[已知:常温下, ,
,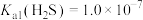 ,
, ,
, ]。
]。
 ,还有Fe、Mg、Ca等的化合物和
,还有Fe、Mg、Ca等的化合物和 )为原料制备硫酸锌晶体的工艺流程如下。其中沉铁时,通过调控溶液的pH使铁元素形成易过滤的FeOOH铁渣。
)为原料制备硫酸锌晶体的工艺流程如下。其中沉铁时,通过调控溶液的pH使铁元素形成易过滤的FeOOH铁渣。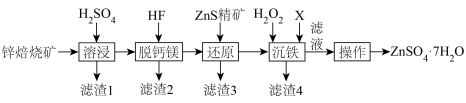
 ;溶液中
;溶液中 较小时,才能顺利析出FeOOH。
较小时,才能顺利析出FeOOH。回答下列问题:
(1)溶浸过程中,提高浸出率的措施有
(2)还原时,加入ZnS精矿的目的是转化溶液中
 ,反应的离子方程式为
,反应的离子方程式为(3)硫酸锌晶体的溶解度与温度的关系如图所示。补全从滤液得到产品级
 的操作,
的操作,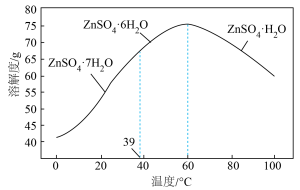
 ,排放前需处理。向废液中加入由
,排放前需处理。向废液中加入由 和
和 组成的缓冲溶液调节pH,通入
组成的缓冲溶液调节pH,通入 发生反应
发生反应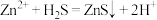 ,处理后的废液中部分微粒浓度见下表。则处理后的废液中
,处理后的废液中部分微粒浓度见下表。则处理后的废液中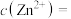
 [已知:常温下,
[已知:常温下, ,
,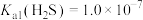 ,
, ,
, ]。
]。微粒 |
|
|
|
浓度/( | 0.2 | 0.1 | 0.2 |
您最近一年使用:0次




