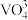运用相关原理,回答下列各小题:
I.已知:NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO .
.
(1)常温下,pH=5的NaHSO4溶液中水的电离程度______________ (填“>”、”=”或“<”)pH=9的氨水中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为:______________ (用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH )
)______________ c(SO )(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO
)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO 完全沉淀,则反应后溶液的pH
完全沉淀,则反应后溶液的pH______________ 7(填“>”、”=”或“<”)。
(3)将分别含有MnO 、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有
、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有______________ ,一定不存在的是______________ 。
II.在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为________________ mol·L−1,此时溶液中c(CrO )等于
)等于______________ mol·L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
I.已知:NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO
 .
. (1)常温下,pH=5的NaHSO4溶液中水的电离程度
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为:
 )
) )(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO
)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO 完全沉淀,则反应后溶液的pH
完全沉淀,则反应后溶液的pH(3)将分别含有MnO
 、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有
、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有II.在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为
 )等于
)等于
更新时间:2017-05-17 08:14:15
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】(1)某温度下,纯水的c(H+)=2×10- 7 mol·L-1,则此时c(OH-)为_______ ;若温度不变,滴入稀盐酸使c(H+)=5×10- 4 mol·L-1则溶液中由水电离产生的c(H+)为_______ ,此时温度_______ (填“高于”、“低于”或“等于”)25℃。
(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+ O2(g)=H2O(g) ΔH2=-242.0 kJ/mol
O2(g)=H2O(g) ΔH2=-242.0 kJ/mol
③CO(g)+ O2(g)=CO2(g) ΔH3=-283. 0 kJ/mol
O2(g)=CO2(g) ΔH3=-283. 0 kJ/mol
写出C(s)与水蒸气反应生成CO和H2的热化学方程式:_______ 。
(3)常温下,取物质的量浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得混合液的pH=12,则原溶液的物质的量浓度为_______ 。(溶液体积变化忽略不计)
(4)常温下,0.l mol·L-1 H3PO4溶液的pH小于7,括号内离子浓度的大小顺序为( 、
、 、
、 、OH- 和H +)
、OH- 和H +)_______ 。
(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+
 O2(g)=H2O(g) ΔH2=-242.0 kJ/mol
O2(g)=H2O(g) ΔH2=-242.0 kJ/mol③CO(g)+
 O2(g)=CO2(g) ΔH3=-283. 0 kJ/mol
O2(g)=CO2(g) ΔH3=-283. 0 kJ/mol写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
(3)常温下,取物质的量浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得混合液的pH=12,则原溶液的物质的量浓度为
(4)常温下,0.l mol·L-1 H3PO4溶液的pH小于7,括号内离子浓度的大小顺序为(
 、
、 、
、 、OH- 和H +)
、OH- 和H +)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】利用所学化学反应原理知识,解决以下问题:
(1)①某温度下,纯水中的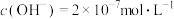 ,若温度不变,滴入稀硫酸使
,若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的
___________ 。
②将99mL 盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的
盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的
___________ 。
(2)①物质的量浓度为0.1mol/L的下列物质:a. ;b.
;b. ;c.
;c. ;d.NaOH,pH由大到小的顺序是:
;d.NaOH,pH由大到小的顺序是:___________ (填编号,下同)。
②物质的量浓度相同的下列四种溶液:a. ;b.
;b. ;c.
;c. ;d.氨水,
;d.氨水, 由大到小的顺序是
由大到小的顺序是___________ 。
(3)已知常温下 的水解常数
的水解常数 。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显___________ (填“酸”“碱”或“中”)性,
___________ (填“>”“<”或“=”) 。该溶液中各离子浓度由大到小的顺序为
。该溶液中各离子浓度由大到小的顺序为___________ 。
(4)常温下,向100mL0.2mol/L的 溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计)。已知25℃时,
溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计)。已知25℃时, 。请回答下列问题:
。请回答下列问题:
①混合后溶液的
___________ 。
②混合后溶液中
___________ mol/L。
(1)①某温度下,纯水中的
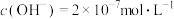 ,若温度不变,滴入稀硫酸使
,若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的
②将99mL
 盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的
盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的
(2)①物质的量浓度为0.1mol/L的下列物质:a.
 ;b.
;b. ;c.
;c. ;d.NaOH,pH由大到小的顺序是:
;d.NaOH,pH由大到小的顺序是:②物质的量浓度相同的下列四种溶液:a.
 ;b.
;b. ;c.
;c. ;d.氨水,
;d.氨水, 由大到小的顺序是
由大到小的顺序是(3)已知常温下
 的水解常数
的水解常数 。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
 。该溶液中各离子浓度由大到小的顺序为
。该溶液中各离子浓度由大到小的顺序为(4)常温下,向100mL0.2mol/L的
 溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计)。已知25℃时,
溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计)。已知25℃时, 。请回答下列问题:
。请回答下列问题:①混合后溶液的

②混合后溶液中

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】已知:25℃时,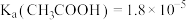 。
。
(1)常温下,将pH和体积均相同的 和
和 溶液分别稀释,溶液pH随加水体积的变化如图:
溶液分别稀释,溶液pH随加水体积的变化如图:___________ 溶液(填“ ”或“
”或“ ”)。
”)。
②a、b两点对应的溶液中,水的电离程度a___________ b(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
③酸度( )也可表示溶液的酸碱性,
)也可表示溶液的酸碱性,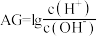 。常温下,
。常温下, 的硝酸溶液
的硝酸溶液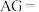
___________ 。
(2)常温下,向某浓度的二元弱酸草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:___________ 。
②如果所得溶液溶质为KHC2O4,则该溶液显___________ (填“酸性”、“碱性”或“中性”);原因是___________ (结合数据计算说明)。
③当所得溶液pH=2.7时,溶液中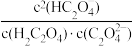 =
=___________ 。
④等浓度等体积的KHC2O4、K2C2O4混合,溶液中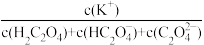 =
=___________ 。
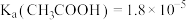 。
。(1)常温下,将pH和体积均相同的
 和
和 溶液分别稀释,溶液pH随加水体积的变化如图:
溶液分别稀释,溶液pH随加水体积的变化如图:
 ”或“
”或“ ”)。
”)。②a、b两点对应的溶液中,水的电离程度a
 ”、“
”、“ ”或“
”或“ ”)。
”)。③酸度(
 )也可表示溶液的酸碱性,
)也可表示溶液的酸碱性,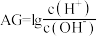 。常温下,
。常温下, 的硝酸溶液
的硝酸溶液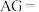
(2)常温下,向某浓度的二元弱酸草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O
 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题: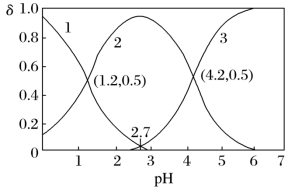
②如果所得溶液溶质为KHC2O4,则该溶液显
③当所得溶液pH=2.7时,溶液中
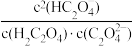 =
=④等浓度等体积的KHC2O4、K2C2O4混合,溶液中
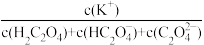 =
=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
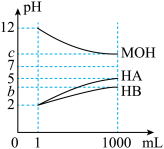
(1)HA为___ 酸,HB为___ 酸(填“强”或“弱”)。
(2)若c=9,则将pH=2的HB与pH=12的MOH等体积混合后,溶液呈__ (填“酸”“碱”或“中”)性。
(3)若c=9,稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为__ (用酸、碱化学式表示)。
(4)常温下,取pH=2的HA、HB各100mL,向其中分别加入适量的Zn粒,反应后两溶液的pH均变为4,设HA中加入的Zn质量为m1,HB中加入的Zn质量为m2,则m1__ m2(选填“<”、“=”或“>”)。
(5)若b+c=14,则MOH为___ 碱(选填“强”或“弱”)。将稀释后的HB溶液和MOH溶液取等体积混合,所得混合溶液的pH__ 7(选填“大于”、“小于”或“等于”)。

(1)HA为
(2)若c=9,则将pH=2的HB与pH=12的MOH等体积混合后,溶液呈
(3)若c=9,稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为
(4)常温下,取pH=2的HA、HB各100mL,向其中分别加入适量的Zn粒,反应后两溶液的pH均变为4,设HA中加入的Zn质量为m1,HB中加入的Zn质量为m2,则m1
(5)若b+c=14,则MOH为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL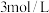 的NaOH溶液吸收标准状况下
的NaOH溶液吸收标准状况下
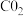 时,所得溶液中各离子浓度由大到小的顺序为
时,所得溶液中各离子浓度由大到小的顺序为______
(2)常温下向一定体积的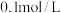 醋酸溶液中加水稀释后,下列说法正确的是
醋酸溶液中加水稀释后,下列说法正确的是______ .
A.溶液中导电粒子的数目减少 醋酸的电离程度增大,
醋酸的电离程度增大, 亦增大
亦增大
C.溶液中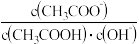 不变
不变 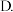 溶液中
溶液中 减小
减小
(3)①常温下将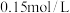 稀硫酸
稀硫酸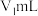 与
与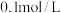 NaOH溶液
NaOH溶液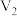 mL棍合,所得溶液的pH为1,则
mL棍合,所得溶液的pH为1,则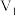 :
: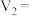
______  溶液体积变化忽略不询.
溶液体积变化忽略不询.
②常温下若溶液由 的HA溶液
的HA溶液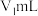 与
与 的NaOH溶液
的NaOH溶液 混合而得,则下列说法正确的是
混合而得,则下列说法正确的是______
A.若反应后溶液呈中性,则
B.若 ,反应后溶液pH一定等于7
,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则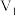 一定大于
一定大于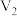
D.若反应后溶液呈碱性,则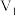 一定小于
一定小于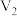
(4)常温下,浓度均为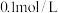 的下列五种溶液的pH值如下表所示:
的下列五种溶液的pH值如下表所示:
①根据表中数据,将浓度均为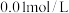 的下列四种酸的溶液分别稀释100倍,pH变化最小的是
的下列四种酸的溶液分别稀释100倍,pH变化最小的是______
A.HCN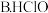
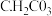
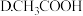
②根据以上数据,判断下列反应可以成立的是______ .
A.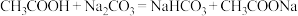
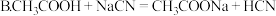
C.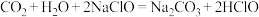

(5)几种离子开始沉淀时的pH如下表:
当向含相同浓度 、
、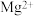 、
、 离子的溶液中滴加NaOH溶液时,
离子的溶液中滴加NaOH溶液时,______  填离子符号
填离子符号 先沉淀,
先沉淀,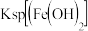
______ 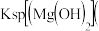 填“
填“ ”、“
”、“ ”或“
”或“ ”
” .
.
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL
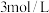 的NaOH溶液吸收标准状况下
的NaOH溶液吸收标准状况下
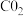 时,所得溶液中各离子浓度由大到小的顺序为
时,所得溶液中各离子浓度由大到小的顺序为(2)常温下向一定体积的
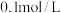 醋酸溶液中加水稀释后,下列说法正确的是
醋酸溶液中加水稀释后,下列说法正确的是A.溶液中导电粒子的数目减少
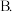 醋酸的电离程度增大,
醋酸的电离程度增大, 亦增大
亦增大C.溶液中
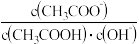 不变
不变 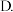 溶液中
溶液中 减小
减小(3)①常温下将
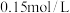 稀硫酸
稀硫酸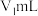 与
与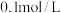 NaOH溶液
NaOH溶液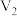 mL棍合,所得溶液的pH为1,则
mL棍合,所得溶液的pH为1,则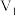 :
: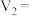
 溶液体积变化忽略不询.
溶液体积变化忽略不询.②常温下若溶液由
 的HA溶液
的HA溶液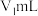 与
与 的NaOH溶液
的NaOH溶液 混合而得,则下列说法正确的是
混合而得,则下列说法正确的是A.若反应后溶液呈中性,则

B.若
 ,反应后溶液pH一定等于7
,反应后溶液pH一定等于7C.若反应后溶液呈酸性,则
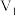 一定大于
一定大于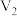
D.若反应后溶液呈碱性,则
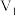 一定小于
一定小于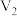
(4)常温下,浓度均为
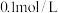 的下列五种溶液的pH值如下表所示:
的下列五种溶液的pH值如下表所示: | 溶质 | 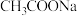 |  |  | NaClO | NaCN |
| pH |  | 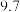 | 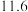 | 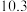 | 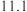 |
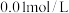 的下列四种酸的溶液分别稀释100倍,pH变化最小的是
的下列四种酸的溶液分别稀释100倍,pH变化最小的是A.HCN
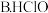
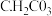
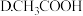
②根据以上数据,判断下列反应可以成立的是
A.
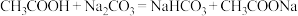
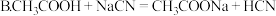
C.
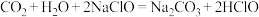

(5)几种离子开始沉淀时的pH如下表:
| 离子 |  |  | 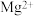 |
| pH | 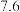 |  |  |
 、
、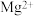 、
、 离子的溶液中滴加NaOH溶液时,
离子的溶液中滴加NaOH溶液时, 填离子符号
填离子符号 先沉淀,
先沉淀,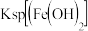
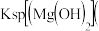 填“
填“ ”、“
”、“ ”或“
”或“ ”
” .
.
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】(1)甲醇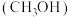 是重要的溶剂和替代燃料,工业上用CO和
是重要的溶剂和替代燃料,工业上用CO和 在一定条件下制备
在一定条件下制备 的反应为:
的反应为: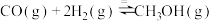 ,在体积为1L的恒容密闭容器中,充入
,在体积为1L的恒容密闭容器中,充入 和
和 ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。

①从反应开始至达到平衡,用氢气表示的平均反应速率
______ 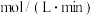 。
。
②下列说法正确的是______  填字母序号
填字母序号 。
。
A.达到平衡时,CO的转化率为
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前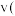 正
正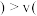 逆
逆 ,2min后
,2min后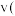 正
正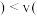 逆
逆
③该条件下反应的平衡常数
______ 。
(2)已知:Ⅰ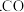 的燃烧热为
的燃烧热为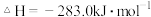
Ⅱ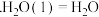
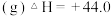

Ⅲ.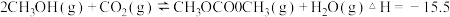

则①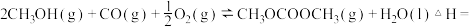
______ 。
②对于可逆反应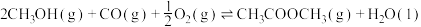 采取以下措施可以提高
采取以下措施可以提高 产率的是
产率的是______  填字母
填字母
A.降低体系的温度 B.压缩容器的体积
C.减少水量 D.选用适当的催化剂
(3)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为: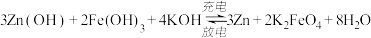 ,则充电时的阳极反应式为
,则充电时的阳极反应式为______ 。
(4)若往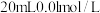 的弱酸
的弱酸 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是______  填序号
填序号 。
。
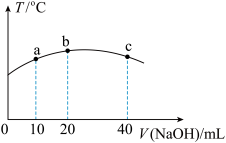
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③ 的电离平衡常数:b点>a点
的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:
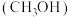 是重要的溶剂和替代燃料,工业上用CO和
是重要的溶剂和替代燃料,工业上用CO和 在一定条件下制备
在一定条件下制备 的反应为:
的反应为: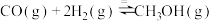 ,在体积为1L的恒容密闭容器中,充入
,在体积为1L的恒容密闭容器中,充入 和
和 ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
①从反应开始至达到平衡,用氢气表示的平均反应速率

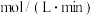 。
。②下列说法正确的是
 填字母序号
填字母序号 。
。A.达到平衡时,CO的转化率为

B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前
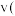 正
正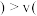 逆
逆 ,2min后
,2min后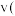 正
正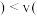 逆
逆
③该条件下反应的平衡常数

(2)已知:Ⅰ
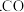 的燃烧热为
的燃烧热为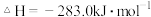
Ⅱ
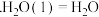
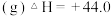

Ⅲ.
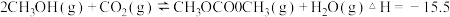

则①
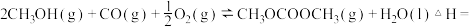
②对于可逆反应
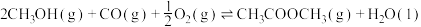 采取以下措施可以提高
采取以下措施可以提高 产率的是
产率的是 填字母
填字母
A.降低体系的温度 B.压缩容器的体积
C.减少水量 D.选用适当的催化剂
(3)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:
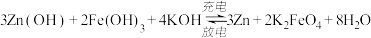 ,则充电时的阳极反应式为
,则充电时的阳极反应式为(4)若往
 的弱酸
的弱酸 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是 填序号
填序号 。
。
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③
 的电离平衡常数:b点>a点
的电离平衡常数:b点>a点④从b点到c点,混合溶液中一直存在:

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】按要求填写下列问题:
(1)某些共价化合物(如H2O、NH3、N2O4等)在液态时会发生微弱的电离,如:2H2O H3O+ + OH—,则液态NH3电离的方程式是
H3O+ + OH—,则液态NH3电离的方程式是_______________________
(2)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=11,则该温度下水的KW=_______ ,在此温度下,将pH=a的H2SO4溶液Va L与pH=b的NaOH溶液Vb L混合,若所得混合液为中性,且a+b=12,则Va:Vb=_________
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。
①常温时,甲酸的电离平衡常数Ka=1.70×10-4。甲酸钠的水溶液呈碱性,请用离子反应方程式表示其原因____________ ,0.1mol/L的甲酸钠溶液pH约为_______ (已知:lg17 ≈1.23, 计算结果保留一位小数)
②向20ml 0.1mol/L的甲酸钠溶液中小心滴加10ml 0.1mol/L的盐酸,混合液呈酸性,请按由大到小的顺序给溶液中离子浓度排序_______________
(4)室温时,M(OH)2(s) M2+(aq) + 2OH-(aq),Ksp=a;c(M2+)=b mol·L−1时,溶液的pH等于
M2+(aq) + 2OH-(aq),Ksp=a;c(M2+)=b mol·L−1时,溶液的pH等于_________
(1)某些共价化合物(如H2O、NH3、N2O4等)在液态时会发生微弱的电离,如:2H2O
 H3O+ + OH—,则液态NH3电离的方程式是
H3O+ + OH—,则液态NH3电离的方程式是(2)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=11,则该温度下水的KW=
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。
①常温时,甲酸的电离平衡常数Ka=1.70×10-4。甲酸钠的水溶液呈碱性,请用离子反应方程式表示其原因
②向20ml 0.1mol/L的甲酸钠溶液中小心滴加10ml 0.1mol/L的盐酸,混合液呈酸性,请按由大到小的顺序给溶液中离子浓度排序
(4)室温时,M(OH)2(s)
 M2+(aq) + 2OH-(aq),Ksp=a;c(M2+)=b mol·L−1时,溶液的pH等于
M2+(aq) + 2OH-(aq),Ksp=a;c(M2+)=b mol·L−1时,溶液的pH等于
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
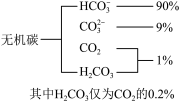
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因______________________ 。已知春季海水pH=8.1,预测冬季海水碱性将会_______ (填“增强”或“减弱”),理由是_________________ 。
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是________ (填字母)。
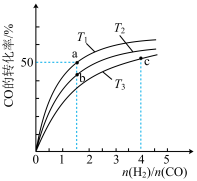
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
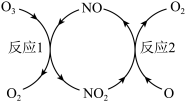
①NO的作用是_________________ 。
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为____________________________ 。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。
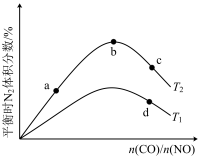
①b点时,平衡体系中C、N原子个数之比接近________ 。
②a、b、c三点CO的转化率从小到大的顺序为________ ;b、c、d三点的平衡常数从大到小的顺序为__________ 。
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为_____ 。

(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是

A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:

①NO的作用是
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。

①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从小到大的顺序为
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】实验小组制备硫代硫酸钠(Na2S2O3)并探究其性质。
资料:ⅰ. 。
。
ⅱ.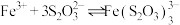 (紫黑色)。
(紫黑色)。
ⅲ. 是难溶于水、可溶于
是难溶于水、可溶于 溶液的白色固体。
溶液的白色固体。
(1)实验室可利用反应: 制备
制备 ,装置如下图。
,装置如下图。
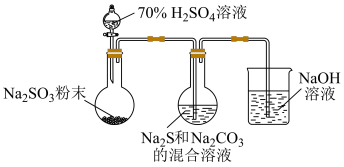
①用化学用语解释 和
和 的混合溶液呈碱性的原因:
的混合溶液呈碱性的原因: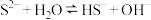 、
、___________ 。
②为了保证 的产量,实验中通入的
的产量,实验中通入的 不能过量。要控制
不能过量。要控制 的生成速率,可以采取的措施有:
的生成速率,可以采取的措施有:___________ (写出一条)。
(2)探究 溶液与不同金属的硫酸盐溶液间反应的多样性。
溶液与不同金属的硫酸盐溶液间反应的多样性。
①Ⅰ中产生白色沉淀的离子方程式为___________ 。
②经检验,现象Ⅱ中的沉淀有 和
和 ,用平衡移动原理解释Ⅱ中的现象:
,用平衡移动原理解释Ⅱ中的现象:___________ 。
③经检验,现象Ⅲ中的无色溶液中含有 。Ⅲ中溶液变为无色的离子方程式为
。Ⅲ中溶液变为无色的离子方程式为___________ 。
④从化学反应速率和限度的角度解释Ⅲ中 与
与 反应的实验现象:
反应的实验现象:___________ 。
以上实验说明: 溶液与金属阳离子反应的多样性和阳离子的性质有关。
溶液与金属阳离子反应的多样性和阳离子的性质有关。
资料:ⅰ.
 。
。ⅱ.
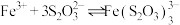 (紫黑色)。
(紫黑色)。ⅲ.
 是难溶于水、可溶于
是难溶于水、可溶于 溶液的白色固体。
溶液的白色固体。(1)实验室可利用反应:
 制备
制备 ,装置如下图。
,装置如下图。
①用化学用语解释
 和
和 的混合溶液呈碱性的原因:
的混合溶液呈碱性的原因: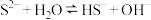 、
、②为了保证
 的产量,实验中通入的
的产量,实验中通入的 不能过量。要控制
不能过量。要控制 的生成速率,可以采取的措施有:
的生成速率,可以采取的措施有:(2)探究
 溶液与不同金属的硫酸盐溶液间反应的多样性。
溶液与不同金属的硫酸盐溶液间反应的多样性。| 实验 | 试剂 | 现象 | |
| 试管 | 滴管 | ||
 | 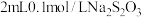 溶液 溶液 |  溶液(浓度约为 溶液(浓度约为 ) ) | Ⅰ.局部生成白色沉淀,振荡后沉淀溶解,得到无色溶液 |
 溶液 溶液 | Ⅱ.一段时间后,生成沉淀 | ||
 溶液 溶液 | Ⅲ.混合后溶液先变成紫黑色, 时溶液几乎变为无色 时溶液几乎变为无色 | ||
②经检验,现象Ⅱ中的沉淀有
 和
和 ,用平衡移动原理解释Ⅱ中的现象:
,用平衡移动原理解释Ⅱ中的现象:③经检验,现象Ⅲ中的无色溶液中含有
 。Ⅲ中溶液变为无色的离子方程式为
。Ⅲ中溶液变为无色的离子方程式为④从化学反应速率和限度的角度解释Ⅲ中
 与
与 反应的实验现象:
反应的实验现象:以上实验说明:
 溶液与金属阳离子反应的多样性和阳离子的性质有关。
溶液与金属阳离子反应的多样性和阳离子的性质有关。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】一种从废钼催化剂(主要成分为MoO3、MoS2,含少量CoO、CoS、NiO、Fe2O3等)中回收有价值金属的工艺流程如图。
②溶液中金属离子开始沉淀和完全沉淀的pH如表:
③钼酸铵[(NH4)2MoO4]为白色晶体,具有很高的水溶性,不溶于乙醇。
回答下列问题:
(1)催化剂中含多种金属元素,其中铁在元素周期表中的位置:第______ 周期第_____ 族。基态Co原子的价电子排布式为______ 。
(2)钼酸铵[(NH4)2MoO4]中Mo元素的化合价为______ ;“焙烧”时MoS2转化为MoO3,该反应的化学方程式为______ 。
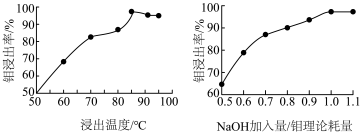
(3)“碱浸”时,浸出温度、NaOH加入量/钼理论耗量对钼浸出率的影响如图。______ 、NaOH加入量/钼理论耗量______ 。
(4)“除铁”时应调节溶液pH的范围为_______ 。
(5)若“沉钴镍”时调节溶液pH=9.5,则此时溶液中p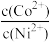 =
=______ (pX=-lgX)。
(6)经过降温结晶、过滤、洗涤、干燥等操作得到(NH4)2MoO4•7H2O晶体,洗涤时所选用的最佳试剂为______ 。

②溶液中金属离子开始沉淀和完全沉淀的pH如表:
| 金属离子 | Fe3+ | Co2+ | Ni2+ |
| 开始沉淀时的pH | 2.2 | 6.4 | 7.2 |
| 沉淀完全时(c=1.0×10-5mol•L-1)的pH | 3.2 | 9.0 | 8.7 |
回答下列问题:
(1)催化剂中含多种金属元素,其中铁在元素周期表中的位置:第
(2)钼酸铵[(NH4)2MoO4]中Mo元素的化合价为
(3)“碱浸”时,浸出温度、NaOH加入量/钼理论耗量对钼浸出率的影响如图。
(4)“除铁”时应调节溶液pH的范围为
(5)若“沉钴镍”时调节溶液pH=9.5,则此时溶液中p
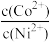 =
=(6)经过降温结晶、过滤、洗涤、干燥等操作得到(NH4)2MoO4•7H2O晶体,洗涤时所选用的最佳试剂为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】电解金属锰阳极渣主要成分 ,杂质为Pb、Fe、Cu元素的化合物和黄铁矿(FeS2)为原料可制备
,杂质为Pb、Fe、Cu元素的化合物和黄铁矿(FeS2)为原料可制备 ,其流程如图所示:
,其流程如图所示:

已知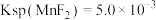 、
、 。
。
(1)“酸浸”过程中, 、
、 的质量浓度、Mn浸出率与时间的关系如图所示。
的质量浓度、Mn浸出率与时间的关系如图所示。

20~80min内,浸出Mn元素主要离子方程式为___________ 。
(2)若“净化”过程中 的浓度为
的浓度为 ,则此时
,则此时 的浓度为
的浓度为___________  。
。
(3) 制取
制取 的一种流程如图,在搅拌下向
的一种流程如图,在搅拌下向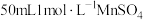 溶液中缓慢滴加
溶液中缓慢滴加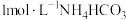 溶液,则加入
溶液,则加入 溶液的体积至少为
溶液的体积至少为___________ mL。

(4) 制取
制取 的另一种流程为:在一定条件下向
的另一种流程为:在一定条件下向 溶液中通入空气及氨水,即可生成
溶液中通入空气及氨水,即可生成 黑色沉淀。已知:反应温度和溶液pH对
黑色沉淀。已知:反应温度和溶液pH对 的纯度和产率影响分别如图1、图2所示,请补充完整由
的纯度和产率影响分别如图1、图2所示,请补充完整由 溶液制备
溶液制备 的实验方案:
的实验方案:___________ ,真空干燥4小时得产品 。实验中须使用的试剂:氨水、空气、蒸馏水、
。实验中须使用的试剂:氨水、空气、蒸馏水、 溶液。
溶液。

 ,杂质为Pb、Fe、Cu元素的化合物和黄铁矿(FeS2)为原料可制备
,杂质为Pb、Fe、Cu元素的化合物和黄铁矿(FeS2)为原料可制备 ,其流程如图所示:
,其流程如图所示:
已知
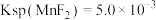 、
、 。
。(1)“酸浸”过程中,
 、
、 的质量浓度、Mn浸出率与时间的关系如图所示。
的质量浓度、Mn浸出率与时间的关系如图所示。
20~80min内,浸出Mn元素主要离子方程式为
(2)若“净化”过程中
 的浓度为
的浓度为 ,则此时
,则此时 的浓度为
的浓度为 。
。(3)
 制取
制取 的一种流程如图,在搅拌下向
的一种流程如图,在搅拌下向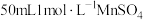 溶液中缓慢滴加
溶液中缓慢滴加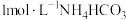 溶液,则加入
溶液,则加入 溶液的体积至少为
溶液的体积至少为
(4)
 制取
制取 的另一种流程为:在一定条件下向
的另一种流程为:在一定条件下向 溶液中通入空气及氨水,即可生成
溶液中通入空气及氨水,即可生成 黑色沉淀。已知:反应温度和溶液pH对
黑色沉淀。已知:反应温度和溶液pH对 的纯度和产率影响分别如图1、图2所示,请补充完整由
的纯度和产率影响分别如图1、图2所示,请补充完整由 溶液制备
溶液制备 的实验方案:
的实验方案: 。实验中须使用的试剂:氨水、空气、蒸馏水、
。实验中须使用的试剂:氨水、空气、蒸馏水、 溶液。
溶液。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
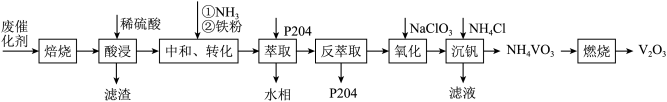
【推荐3】某石油炼化厂废弃的 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
: 、
、 。
。
②不同pH下,五价钒在溶液中的主要存在形式见下表:
③萃取剂P204对 、
、 具有高选择性。
具有高选择性。
④25℃时,
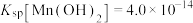


回答下列问题:
(1)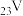 位于元素周期表的第
位于元素周期表的第__________ 周期、第__________ 族。
(2)“中和、转化”时,铁粉的作用除将 还原为
还原为 外,还有
外,还有__________ ;“氧化”时发生反应的离子方程式为______________________________ 。
(3)除萃取剂P204外,流程中可循环使用的物质还有____________________ 。
(4)“沉钒”时需加入过量 ,原因是
,原因是______________________________ ;25℃时,测得“氧化”后滤液中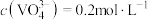 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中 至少为
至少为__________  。
。
(5)“萃取”后的水相经三道工序可回收 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整__________ 。(可供选用的试剂:铁粉、稀硫酸、 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
:
 、
、 。
。②不同pH下,五价钒在溶液中的主要存在形式见下表:
| 4-6 | 6-8 | 8-10 | 10-12 |
主要离子 |
|
|
|
|
 、
、 具有高选择性。
具有高选择性。④25℃时,

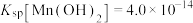


回答下列问题:
(1)
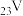 位于元素周期表的第
位于元素周期表的第(2)“中和、转化”时,铁粉的作用除将
 还原为
还原为 外,还有
外,还有(3)除萃取剂P204外,流程中可循环使用的物质还有
(4)“沉钒”时需加入过量
 ,原因是
,原因是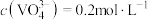 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中 至少为
至少为 。
。(5)“萃取”后的水相经三道工序可回收
 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。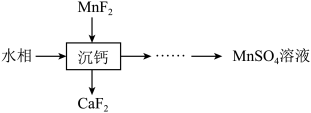
您最近一年使用:0次