碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式_______ 。
已知:①N2(g)+O2(g)=2NO(g) ∆H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) ∆H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) ∆H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l) C6H12O6(s)+6O2(g) ∆H=+669.62 kJ/mol;该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是_______。
C6H12O6(s)+6O2(g) ∆H=+669.62 kJ/mol;该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是_______。
(3)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。

①在转化过程中起催化作用的物质是_______ ;
②写出总反应的化学方程式_______ 。
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l);根据上述反应,填写下列空白
①已知该反应可以自发进行,则∆H_______ 0。(填“>”、“<”或“=”);
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是_______ ;B点处,NH3的平衡转化率为_______ 。

③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=_______ 。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式
已知:①N2(g)+O2(g)=2NO(g) ∆H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) ∆H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) ∆H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)
 C6H12O6(s)+6O2(g) ∆H=+669.62 kJ/mol;该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是_______。
C6H12O6(s)+6O2(g) ∆H=+669.62 kJ/mol;该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是_______。| A.增大CO2的浓度 | B.取走一半C6H12O6 | C.加入催化剂 | D.适当升高温度 |

①在转化过程中起催化作用的物质是
②写出总反应的化学方程式
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l);根据上述反应,填写下列空白
①已知该反应可以自发进行,则∆H
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比
 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的
 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
更新时间:2022-12-03 20:52:40
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】碳的资源化利用是实现碳中和目标的重要环节,将碳氧化物催化氢化制备燃料甲醇,对绿色化与可持续发展意义重大。已知催化氢化时同时存在:
反应I: (主反应)
(主反应)
反应Ⅱ: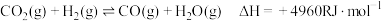 (R为大于0的常数,下同)
(R为大于0的常数,下同)
反应Ⅲ: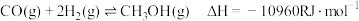
回答下列问题:
(1)在500K下,增大 平衡产率的方法有
平衡产率的方法有___________ (写两条)。
(2)目前应着力开发活性温度___________ (填“更低”或“更高”)的催化剂。
(3)已知 (K为平衡常数,
(K为平衡常数, 、R和C均视为常数),反应Ⅰ在不同温度T下的
、R和C均视为常数),反应Ⅰ在不同温度T下的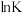 如下表中数据:
如下表中数据:
(i)反应I的
___________ (填“>”或“<”)0,判断理由是___________ 。
(ii)反应I的
___________  (用含常数R的式子表示)。
(用含常数R的式子表示)。
(4)判断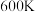 时,反应
时,反应___________ (填“I”或“Ⅲ”)在热力学上趋势更大。
(5)在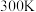 、恒压
、恒压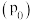 容器中加入
容器中加入 和
和 ,发生上述反应I和Ⅱ,
,发生上述反应I和Ⅱ, 后达平衡,
后达平衡, 平衡转化率为20%,甲醇的选择性(
平衡转化率为20%,甲醇的选择性(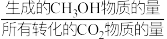 )为50%。
)为50%。
(i)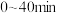 时,
时,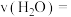
___________ 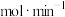 。
。
(ii)反应I的分压平衡常数
___________ (列出计算式)。
反应I:
 (主反应)
(主反应)反应Ⅱ:
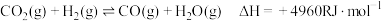 (R为大于0的常数,下同)
(R为大于0的常数,下同)反应Ⅲ:
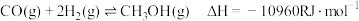
回答下列问题:
(1)在500K下,增大
 平衡产率的方法有
平衡产率的方法有(2)目前应着力开发活性温度
(3)已知
 (K为平衡常数,
(K为平衡常数, 、R和C均视为常数),反应Ⅰ在不同温度T下的
、R和C均视为常数),反应Ⅰ在不同温度T下的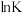 如下表中数据:
如下表中数据: | 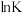 |
| 300 | 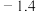 |
| 600 | 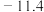 |

(ii)反应I的

 (用含常数R的式子表示)。
(用含常数R的式子表示)。(4)判断
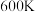 时,反应
时,反应(5)在
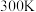 、恒压
、恒压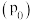 容器中加入
容器中加入 和
和 ,发生上述反应I和Ⅱ,
,发生上述反应I和Ⅱ, 后达平衡,
后达平衡, 平衡转化率为20%,甲醇的选择性(
平衡转化率为20%,甲醇的选择性(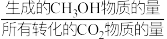 )为50%。
)为50%。(i)
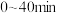 时,
时,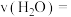
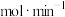 。
。(ii)反应I的分压平衡常数

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氨催化分解既可防治氨气污染,又能得到氢能源。回答下列问题:
(1)已知:①4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)ΔH1=-1266.6kJ·mol-1
②H2(g)+ O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
③H2O(1)=H2O(g)ΔH3=+44.0kJ·mol-1
反应①的热力学趋势很大(平衡常数很大),其原因是________________ 。NH3分解的热化学方程式为________________ 。
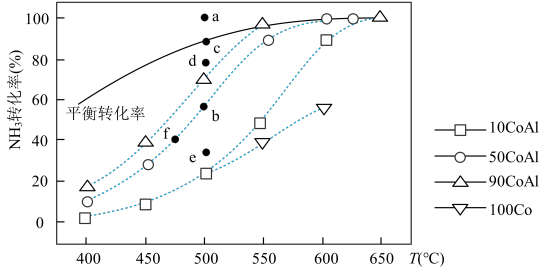
(2)在Co—Al催化剂体系中,压强p0下氨气以一定流速通过反应器,得到不同催化剂下NH3转化率随温度变化的关系如图所示。活化能最小的催化剂为________________ :升高温度,NH3的平衡转化率增大,其原因是________________ ;温度一定时,如果增大气体流速,则b点对应的点可能________________ (填“a”“c”“d”“e”或“f”)。
(3)温度为T时,体积为1L的密闭容器中加入0.8molNH3和0.1molH2,30min达到平衡时,N2的体积分数为20%,则T时反应2NH3(g)⇌N2(g)+3H2(g)的平衡常数K=________________ mol2·L-2,NH3的分解率为________________ ,达到平衡后再加入0.8molNH3和0.1molH2,NH3的转化率________________ (填“增大”“不变”或“减小”)。
(4)将氨溶解于水也可消除氨气的污染。常温下,向10mL0.1mol·L-1氨水中逐滴加入相同浓度的CH3COOH溶液,在滴加过程中 =
=________________ (填标号).
A.始终减小B.始终增大C.先减小后增大D.先增大后减小
(1)已知:①4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)ΔH1=-1266.6kJ·mol-1
②H2(g)+
 O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1③H2O(1)=H2O(g)ΔH3=+44.0kJ·mol-1
反应①的热力学趋势很大(平衡常数很大),其原因是
(2)在Co—Al催化剂体系中,压强p0下氨气以一定流速通过反应器,得到不同催化剂下NH3转化率随温度变化的关系如图所示。活化能最小的催化剂为

(3)温度为T时,体积为1L的密闭容器中加入0.8molNH3和0.1molH2,30min达到平衡时,N2的体积分数为20%,则T时反应2NH3(g)⇌N2(g)+3H2(g)的平衡常数K=
(4)将氨溶解于水也可消除氨气的污染。常温下,向10mL0.1mol·L-1氨水中逐滴加入相同浓度的CH3COOH溶液,在滴加过程中
 =
=A.始终减小B.始终增大C.先减小后增大D.先增大后减小
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.近年来我国大力加强温室气体 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知: 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式: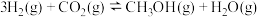
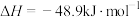 。
。
①总压分别为100kPa、10kPa 时发生该反应,平衡体系中CO2和CH3OH的物质的量分数随温度变化关系如图所示。

100 kPa时,CO2和CH3OH的物质的量分数随温度变化关系的曲线分别是____ 、____ 。
②某温度下,在刚性容器中充入n(H2):n(CO2)=3:1,起始压强为12 kPa,平衡时总压为8 kPa,该反应的平衡常数Kp=_____ kPa (用分压代替平衡浓度,分压=总压×物质的量分数)。
(2)为提高 的产率,理论上应采用的条件是_____(填序号)。
的产率,理论上应采用的条件是_____(填序号)。
(3)催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
根据上表所给数据,用 生产甲醇的最优条件为
生产甲醇的最优条件为______ (填实验编号)。
(4)CO2也能与CH4制备合成气,反应原理是CH4(g)+CO2(g) 2CO(g)+2H2(g),若1 g CH4(g)完全反应吸收热量为15kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为
2CO(g)+2H2(g),若1 g CH4(g)完全反应吸收热量为15kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为______ %(保留一位小数)。
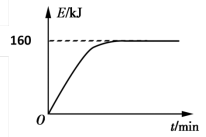
Ⅱ.甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯。已知相关物质的燃烧热如下表:
(5)写出表示乙烯燃烧热的热化学方程式:________ 。
(6)甲烷脱氢反应2CH4(g) ⇌ C2H4(g)+2H2(g) △H=_____
Ⅲ.温度为T1时,在一个容积均为1L的密闭容器中仅发生反应: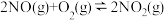
 。实验测得:v正=v (NO)消耗=2v (O2)消耗=k正c2(NO)·c(O2),v逆=v (NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。
。实验测得:v正=v (NO)消耗=2v (O2)消耗=k正c2(NO)·c(O2),v逆=v (NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。
(7)温度为T1时,
______ (填数据);当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m___ n(填“>”、“<”或“=”)
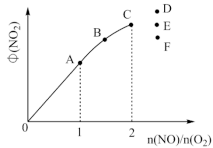
(8)T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数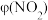 随
随 的变化如图所示,当
的变化如图所示,当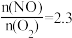 时,达到平衡时
时,达到平衡时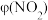 可能是D、E、F三点中的
可能是D、E、F三点中的____ 。
 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:(1)已知:
 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式: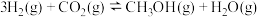
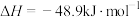 。
。①总压分别为100kPa、10kPa 时发生该反应,平衡体系中CO2和CH3OH的物质的量分数随温度变化关系如图所示。

100 kPa时,CO2和CH3OH的物质的量分数随温度变化关系的曲线分别是
②某温度下,在刚性容器中充入n(H2):n(CO2)=3:1,起始压强为12 kPa,平衡时总压为8 kPa,该反应的平衡常数Kp=
(2)为提高
 的产率,理论上应采用的条件是_____(填序号)。
的产率,理论上应采用的条件是_____(填序号)。| A.高温高压 | B.低温低压 | C.高温低压 | D.低温高压 |
| 实验编号 | 温度/K | 催化剂 |  的转化率/% 的转化率/% | 甲醇的选择性/% |
| A | 543 | 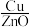 纳米棒 纳米棒 | 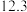 |  |
| B | 543 | 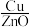 纳米片 纳米片 | 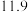 | 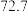 |
| C | 553 | 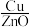 纳米棒 纳米棒 | 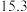 | 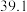 |
| D | 553 | 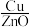 纳米片 纳米片 | 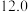 |  |
 生产甲醇的最优条件为
生产甲醇的最优条件为(4)CO2也能与CH4制备合成气,反应原理是CH4(g)+CO2(g)
 2CO(g)+2H2(g),若1 g CH4(g)完全反应吸收热量为15kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为
2CO(g)+2H2(g),若1 g CH4(g)完全反应吸收热量为15kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为
Ⅱ.甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯。已知相关物质的燃烧热如下表:
| 物质 | 氢气 | 甲烷 | 乙烯 |
| 燃烧热(kJ∙mol−1) | 286 | 890 | 1411 |
(6)甲烷脱氢反应2CH4(g) ⇌ C2H4(g)+2H2(g) △H=
Ⅲ.温度为T1时,在一个容积均为1L的密闭容器中仅发生反应:
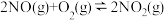
 。实验测得:v正=v (NO)消耗=2v (O2)消耗=k正c2(NO)·c(O2),v逆=v (NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。
。实验测得:v正=v (NO)消耗=2v (O2)消耗=k正c2(NO)·c(O2),v逆=v (NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。| 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
| c(NO) | c(O2) | c(NO2) | c(O2) |
| 0.6 | 0.3 | 0 | 0.2 |

(8)T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数
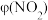 随
随 的变化如图所示,当
的变化如图所示,当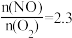 时,达到平衡时
时,达到平衡时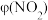 可能是D、E、F三点中的
可能是D、E、F三点中的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】我国提出争取在2030年前实现碳达峰,2060年前实现碳中和。 的相关转化对解决环境问题、能源问题等有重要的意义。
的相关转化对解决环境问题、能源问题等有重要的意义。
Ⅰ.已知:①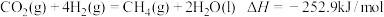
②
(1)

_______  。
。
Ⅱ.目前工业上有一种方法可以利用 生产燃料甲醇,发生的反应为:
生产燃料甲醇,发生的反应为: 。在800℃时,向体积为1L的密闭容器中,充入
。在800℃时,向体积为1L的密闭容器中,充入 和
和 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。 的平均反应速率为
的平均反应速率为_______  。
。
(3)反应达到平衡时,该反应的平衡常数
_______ ; 的转化率为
的转化率为_______ 。
(4)若在上述平衡体系中再充入 和
和 (保持温度不变),则此平衡将
(保持温度不变),则此平衡将_______ 移动(填“向正反应方向”、“不”、“向逆反应方向”)。
(5)若将温度升高到1000℃,测得反应平衡常数为1,则该反应的
_______ 0(填“>”或“<”)。
 的相关转化对解决环境问题、能源问题等有重要的意义。
的相关转化对解决环境问题、能源问题等有重要的意义。Ⅰ.已知:①
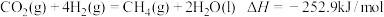
②

(1)


 。
。Ⅱ.目前工业上有一种方法可以利用
 生产燃料甲醇,发生的反应为:
生产燃料甲醇,发生的反应为: 。在800℃时,向体积为1L的密闭容器中,充入
。在800℃时,向体积为1L的密闭容器中,充入 和
和 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。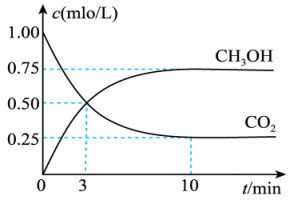
 的平均反应速率为
的平均反应速率为 。
。(3)反应达到平衡时,该反应的平衡常数

 的转化率为
的转化率为(4)若在上述平衡体系中再充入
 和
和 (保持温度不变),则此平衡将
(保持温度不变),则此平衡将(5)若将温度升高到1000℃,测得反应平衡常数为1,则该反应的

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) 2NO(g) ΔH=+196 kJ·mol-1
2NO(g) ΔH=+196 kJ·mol-1
2CO(g)+O2(g) 2CO2(g) ΔH=-554 kJ·mol-1
2CO2(g) ΔH=-554 kJ·mol-1
(1)请写出NO和CO转变为两种无毒无害的物质的热化学方程式_______________ 。
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO物质的量随时间变化如图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=30MPa,则T℃时该反应的压力平衡常数Kp=_______ ;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
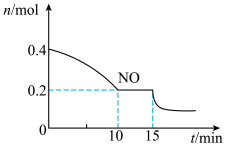
②15 min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_____ (填序号)
A.升温B.增大CO浓度C.加入催化剂D.减小容器体积
(3)在373K时,向体积为2L的恒容真空容器中通入0.40molNO2,发生反应:2NO2(g) N2O4(g) ΔH=−57.0kJ·mol−1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=−57.0kJ·mol−1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
①0~20min内,v(N2O4)=_________________ 。
②上述反应中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为__________ 。
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为2 CH3CHO+H2O CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
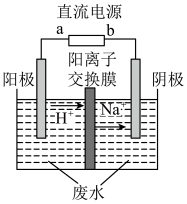
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为4OH--4e-=O2↑+2H2O、__________________ 。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入1m3乙醛的含量为300mg/L的废水,可得到乙醇_______ kg(计算结果保留2位小数)。
Ⅰ.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)
 2NO(g) ΔH=+196 kJ·mol-1
2NO(g) ΔH=+196 kJ·mol-12CO(g)+O2(g)
 2CO2(g) ΔH=-554 kJ·mol-1
2CO2(g) ΔH=-554 kJ·mol-1(1)请写出NO和CO转变为两种无毒无害的物质的热化学方程式
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO物质的量随时间变化如图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=30MPa,则T℃时该反应的压力平衡常数Kp=

②15 min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是
A.升温B.增大CO浓度C.加入催化剂D.减小容器体积
(3)在373K时,向体积为2L的恒容真空容器中通入0.40molNO2,发生反应:2NO2(g)
 N2O4(g) ΔH=−57.0kJ·mol−1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=−57.0kJ·mol−1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:| t/min | 0 | 20 | 40 | 60 | 80 |
| φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20min内,v(N2O4)=
②上述反应中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为2 CH3CHO+H2O
 CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为4OH--4e-=O2↑+2H2O、
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入1m3乙醛的含量为300mg/L的废水,可得到乙醇
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】在一定体积的密闭容器中,进行如下化学反应:CO2 (g) + H2 (g) CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:
CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=________________________ 。
(2)该可逆反应的正反应为_____________ 反应(选填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度满足关系式:3c(CO2)·c(H2) = 5c(CO)·c(H2O),该温度为______ 。
(4)若830℃时,该容器中的反应已达到化学平衡状态:
①在其他条件不变时,再向容器中充入2 mol CO2,达到新平衡后,与原平衡相比,H2的转化率_____ (填“增大”“不变”或“减小”)。
②在其他条件不变时,再向容器中充入1 mol CO、2 mol H2O,达到新平衡后,其化学平衡常数K__ 1.0(选填“>”“<”或“=”)。
(5)若1200℃时,某个时刻,该密闭容器中的CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,此时上述反应________ (填“正向” “逆向”或“处于平衡状态”)。
 CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:
CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:| T/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=
(2)该可逆反应的正反应为
(3)某温度下,各物质的平衡浓度满足关系式:3c(CO2)·c(H2) = 5c(CO)·c(H2O),该温度为
(4)若830℃时,该容器中的反应已达到化学平衡状态:
①在其他条件不变时,再向容器中充入2 mol CO2,达到新平衡后,与原平衡相比,H2的转化率
②在其他条件不变时,再向容器中充入1 mol CO、2 mol H2O,达到新平衡后,其化学平衡常数K
(5)若1200℃时,某个时刻,该密闭容器中的CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,此时上述反应
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】(1)某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
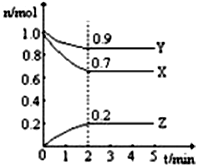
①该反应的化学方程式为______________________________ 。
②从开始至2min,Z的平均反应速率为_____________________ 。
③2min时X的转化率为_____________________ 。
(2)在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g),平衡时测得A 的浓度为0.3 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.18mol/L,则A 的转化率
zC(g),平衡时测得A 的浓度为0.3 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.18mol/L,则A 的转化率___________ ,C 的体积分数_______ 。(填“变大”、“变小”或“不变”)
(3)反应mA(g)+nB(g) pC(g)达到平衡后,当减压后混合体系中C 的百分含量减小。则加压后,C 的百分含量
pC(g)达到平衡后,当减压后混合体系中C 的百分含量减小。则加压后,C 的百分含量_____ (填“变大”、“变小“或“不变"); 若C 是有色物质,A、B是无色物质,减小压强,反应混合物的颜色______________ (填“变深”、“变浅”或“不变”)。
(4)将固体A放入密闭的真空容器中,反应2A(s) 2B(g)+C(g)达到平衡。保持温度不变,增大容器容积,体系重新达到平衡,平衡
2B(g)+C(g)达到平衡。保持温度不变,增大容器容积,体系重新达到平衡,平衡______ (填“向左”、“向右”或“不”) 移动,气体的平均摩尔质量_______ 。(填“变大”、“变小”或“不变”)
(5)在一定温度下,有a、盐酸b、硫酸c、醋酸三种酸,若三者c(H+)相同时,物质的量浓度由大到小的顺序是_________________ ,当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是_________________________ 。

①该反应的化学方程式为
②从开始至2min,Z的平均反应速率为
③2min时X的转化率为
(2)在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)
 zC(g),平衡时测得A 的浓度为0.3 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.18mol/L,则A 的转化率
zC(g),平衡时测得A 的浓度为0.3 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.18mol/L,则A 的转化率(3)反应mA(g)+nB(g)
 pC(g)达到平衡后,当减压后混合体系中C 的百分含量减小。则加压后,C 的百分含量
pC(g)达到平衡后,当减压后混合体系中C 的百分含量减小。则加压后,C 的百分含量(4)将固体A放入密闭的真空容器中,反应2A(s)
 2B(g)+C(g)达到平衡。保持温度不变,增大容器容积,体系重新达到平衡,平衡
2B(g)+C(g)达到平衡。保持温度不变,增大容器容积,体系重新达到平衡,平衡(5)在一定温度下,有a、盐酸b、硫酸c、醋酸三种酸,若三者c(H+)相同时,物质的量浓度由大到小的顺序是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①
 kJ·mol
kJ·mol

②
 kJ⋅mol
kJ⋅mol

③
 kJ⋅mo
kJ⋅mo

回答下列问题:
(1)反应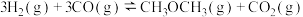 的
的
______ kJ⋅mol ;该反应的平衡常数
;该反应的平衡常数
______ (用 、
、 、
、 表示)。
表示)。
(2)下列措施中,能提高(1)中 产率的有______(填字母)。
产率的有______(填字母)。
(3)一定温度下,将0.2 mol CO和0.1 mol 通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得
通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5 min内
的体积分数为0.1。则0~5 min内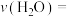
______ ,,CO的转化率为______ 。
(4)将合成气以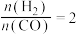 通入1 L的反应器中,一定条件下发生反应:
通入1 L的反应器中,一定条件下发生反应: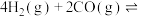

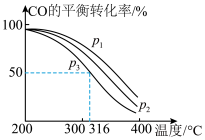
 ,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是______ (填字母)。
A.
B.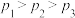
C.若在 和316℃时,起始时
和316℃时,起始时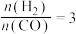 ,则平衡时,
,则平衡时,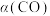 小于50%
小于50%
①

 kJ·mol
kJ·mol

②

 kJ⋅mol
kJ⋅mol

③

 kJ⋅mo
kJ⋅mo

回答下列问题:
(1)反应
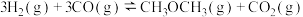 的
的
 ;该反应的平衡常数
;该反应的平衡常数
 、
、 、
、 表示)。
表示)。(2)下列措施中,能提高(1)中
 产率的有______(填字母)。
产率的有______(填字母)。| A.使用过量的CO | B.升高温度 | C.增大压强 | D.加入合适的催化剂 |
(3)一定温度下,将0.2 mol CO和0.1 mol
 通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得
通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5 min内
的体积分数为0.1。则0~5 min内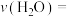
(4)将合成气以
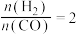 通入1 L的反应器中,一定条件下发生反应:
通入1 L的反应器中,一定条件下发生反应: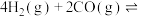

 ,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
A.

B.
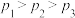
C.若在
 和316℃时,起始时
和316℃时,起始时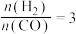 ,则平衡时,
,则平衡时,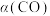 小于50%
小于50%
您最近一年使用:0次
【推荐3】根据实验或图示,完成下列问题。
I.在一个小烧杯里放入20gBa(OH)2·8H2O粉末,将小烧杯放在事先已滴有3~4滴水的木片上,然后加入10gNH4Cl晶体,并用玻璃棒迅速搅拌。实验中观察到的现象是木片上结冰而与小烧杯黏结在一起、有少许刺激性气味,同时反应混合物成糊状。
(1)写出反应的化学方程式_______ 。
(2)判断该反应为_____ 热反应,这是由于反应物的总能量______ 生成物的总能量(填“>”或“<”)。
II.合成氨反应N2(g)+3H2(g) 2NH3(g)过程中的能量变化如图所示。回答下列问题:
2NH3(g)过程中的能量变化如图所示。回答下列问题:
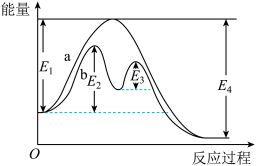
(1)该反应的∆H=______ kJ·mol-1(用E1、E2、E3、E4表示)。反应达到平衡时,升高温度,N2的转化率_______ 。
(2)该反应过程_______ (填“a”或“b”)有催化剂参与。反应达到平衡时,加入催化剂,N2的转化率_______ 。
(3)不使用催化剂时,该反应的活化能为______ (用E1、E2、E3、E4表示)。
(4)将N2和H2以等物质的量之比充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。反应至平衡的过程中,N2的体积分数_______ 。
a.增大 b.不变 c.减小 d.无法判断
I.在一个小烧杯里放入20gBa(OH)2·8H2O粉末,将小烧杯放在事先已滴有3~4滴水的木片上,然后加入10gNH4Cl晶体,并用玻璃棒迅速搅拌。实验中观察到的现象是木片上结冰而与小烧杯黏结在一起、有少许刺激性气味,同时反应混合物成糊状。
(1)写出反应的化学方程式
(2)判断该反应为
II.合成氨反应N2(g)+3H2(g)
 2NH3(g)过程中的能量变化如图所示。回答下列问题:
2NH3(g)过程中的能量变化如图所示。回答下列问题:
(1)该反应的∆H=
(2)该反应过程
(3)不使用催化剂时,该反应的活化能为
(4)将N2和H2以等物质的量之比充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。反应至平衡的过程中,N2的体积分数
a.增大 b.不变 c.减小 d.无法判断
您最近一年使用:0次



