I.如图为元素周期表的一部分:
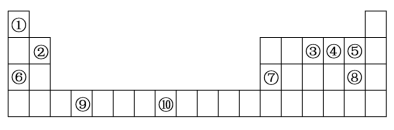
(1)元素③的基态原子轨道表示式为_______ 。
(2)元素③④⑤的第一电离能由大到小的顺序为_______ (填元素符号)。
(3)以下组合的原子间反应最容易形成离子键的是_______。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质。写出元素②的最高价氧化物与NaOH溶液反应的离子方程式_______ 。
II.
(5)如图是部分元素原子的第一电离能I1随原子序数变化关系(其中12号至17号元素的有关数据缺失)。
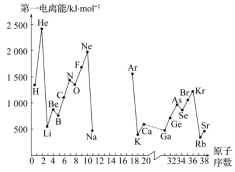
①根据图示变化规律,可推测S的第一电离能的大小(最小)范围为_______ <S<_______ (填元素符号)
②图中第一电离能最小的元素在周期表中的位置_______
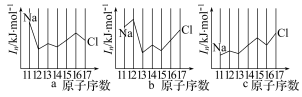
(6)用In表示元素的第n电离能,则图中的a、b、c分别代表_______。

(1)元素③的基态原子轨道表示式为
(2)元素③④⑤的第一电离能由大到小的顺序为
(3)以下组合的原子间反应最容易形成离子键的是_______。
| A.②和⑤ | B.①和⑤ | C.⑤和⑥ | D.⑥和⑧ |
II.
(5)如图是部分元素原子的第一电离能I1随原子序数变化关系(其中12号至17号元素的有关数据缺失)。

①根据图示变化规律,可推测S的第一电离能的大小(最小)范围为
②图中第一电离能最小的元素在周期表中的位置
(6)用In表示元素的第n电离能,则图中的a、b、c分别代表_______。

| A.a为I1、b为I2、c为I3 | B.a为I3、b为I2、c为I1 |
| C.a为I2、b为I3、c为I1 | D.a为I1、b为I3、c为I2 |
更新时间:2022-11-03 16:16:32
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】蛋氨酸铬(Ⅲ)配合物是一种治疗Ⅱ型糖尿病的药物,其结构简式如图所示
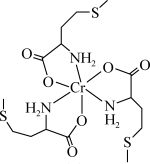
(1)基态Cr原子核外电子的空间运动状态有____ 种,蛋氨酸铬(Ⅲ)配合物的中心铬离子的配位数为_____ ;N的_____ 轨道提供孤电子对与Cr的空轨道形成配位键。
(2)哈勃−韦斯(Haber−Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。则Cu2+、Fe3+、Zn2+、Cr3+能催化双氧水分解的有_____ 种。
(3)Co(Ⅲ)可形成多种配合物。
①已知Co(NH3)5BrSO4中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加BaCl2溶液,无明显现象,则该配合物可表示为_______ 。
②[Co(NH3)6]3+结构如图所示,Co3+位于正八面体中心,若其中两个NH3被Cl-取代,则[Co(NH3)4Cl2]-的空间结构有_____ 种。

(4)①一氯乙烯(C2H3Cl)分子中,C的一个_____ 杂化轨道与Cl的 轨道形成C-Cl
轨道形成C-Cl_____ 键,并且Cl的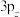 轨道与C的
轨道与C的 轨道形成3中心4电子的大
轨道形成3中心4电子的大 键(
键( )。
)。
②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C-Cl键长的顺序是______ ,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C-Cl键越强;(ⅱ)________ 。
(5)卤化物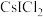 受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为
受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为_______ 。解释X的熔点比Y高的原因________ 。
(6) 晶体中
晶体中 离子作体心立方堆积(如图所示),
离子作体心立方堆积(如图所示), 主要分布在由
主要分布在由 构成的四面体、八面体等空隙中。在电场作用下,
构成的四面体、八面体等空隙中。在电场作用下, 不需要克服太大的阻力即可发生迁移。因此,
不需要克服太大的阻力即可发生迁移。因此, 晶体在电池中可作为
晶体在电池中可作为___________ 。已知阿伏加德罗常数为 ,则
,则 晶体的摩尔体积
晶体的摩尔体积
_____  (列出算式)。
(列出算式)。


(1)基态Cr原子核外电子的空间运动状态有
(2)哈勃−韦斯(Haber−Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。则Cu2+、Fe3+、Zn2+、Cr3+能催化双氧水分解的有
(3)Co(Ⅲ)可形成多种配合物。
①已知Co(NH3)5BrSO4中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加BaCl2溶液,无明显现象,则该配合物可表示为
②[Co(NH3)6]3+结构如图所示,Co3+位于正八面体中心,若其中两个NH3被Cl-取代,则[Co(NH3)4Cl2]-的空间结构有

(4)①一氯乙烯(C2H3Cl)分子中,C的一个
 轨道形成C-Cl
轨道形成C-Cl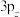 轨道与C的
轨道与C的 轨道形成3中心4电子的大
轨道形成3中心4电子的大 键(
键( )。
)。②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C-Cl键长的顺序是
(5)卤化物
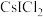 受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为
受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为(6)
 晶体中
晶体中 离子作体心立方堆积(如图所示),
离子作体心立方堆积(如图所示), 主要分布在由
主要分布在由 构成的四面体、八面体等空隙中。在电场作用下,
构成的四面体、八面体等空隙中。在电场作用下, 不需要克服太大的阻力即可发生迁移。因此,
不需要克服太大的阻力即可发生迁移。因此, 晶体在电池中可作为
晶体在电池中可作为 ,则
,则 晶体的摩尔体积
晶体的摩尔体积
 (列出算式)。
(列出算式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1) 基态Ni原子核外电子排布式为________ ;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为_____ ,Ni(CO)4 易 溶于下列_____ (填选项字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO__ FeO(填“>"或“<”),原因为_________ 。
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为_________ ,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为________ 。
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为_______ ,其化学式为________ 。
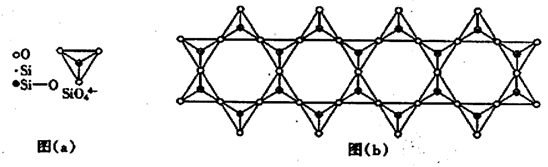
(1) 基态Ni原子核外电子排布式为
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】A、B、C、D、E、F为6种原子序数依次增大的前36号元素,其性质或结构的信息如下表:
回答下列问题:
(1)A基态原子中能量最高的电子,其电子云在空间有______ 个伸展方向,该原子轨道的形状为_________ 。
(2) A、B、C三种元素第一电离能由大到小的顺序为______ ,原子半径由大到小的顺序为______ (用元素符号表示)。
(3)D基态原子的电子排布式为____________ ,其电子的空间运动状态有______ 种。
(4)E在元素周期表中的位置____________ ,其基态原子价电子的轨道表示式为__________________ 。
| 元素 | 性质或结构信息 |
| A | 该元素形成的化合物种类最多 |
| B | 原子核外p轨道电子为半满 |
| C | 地壳中元素含量最高的元素 |
| D | 前四周期中,轨道末成对电子数最多的元素 |
| E | 位于元素周期表的第8列 |
(1)A基态原子中能量最高的电子,其电子云在空间有
(2) A、B、C三种元素第一电离能由大到小的顺序为
(3)D基态原子的电子排布式为
(4)E在元素周期表中的位置
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】东晋 华阳国志
华阳国志 南中志
南中志 卷四中已有关于白铜的记载,云南镍白铜
卷四中已有关于白铜的记载,云南镍白铜 铜镍合金
铜镍合金 闻名中外,曾主要用于造币,亦可用于制作仿银饰品
闻名中外,曾主要用于造币,亦可用于制作仿银饰品 回答下列问题:
回答下列问题:
 镍元素基态原子的电子排布式为
镍元素基态原子的电子排布式为______ ,3d能级上的未成对电子数为______ .
 硫酸镍溶于氨水形成
硫酸镍溶于氨水形成 蓝色溶液.
蓝色溶液.
 中阴离子的立体构型是
中阴离子的立体构型是______ .
 在
在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为___ ,提供孤电子对的成键原子是______ .
 氨是
氨是______ 分子 填“极性”或“非极性”
填“极性”或“非极性” ,中心原子的轨道杂化类型为
,中心原子的轨道杂化类型为______ .
 单质铜及镍都是由
单质铜及镍都是由______ 键形成的晶体;元素铜与镍的第二电离能分别为: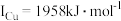 、
、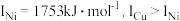 的原因是
的原因是______ .
 某镍白铜合金的立方晶胞结构如图所示.
某镍白铜合金的立方晶胞结构如图所示.
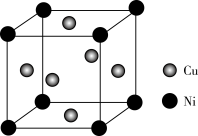
 晶胞中铜原子与镍原子的数量比为
晶胞中铜原子与镍原子的数量比为______ .
 若合金的密度为
若合金的密度为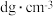 ,晶胞参数
,晶胞参数
______ nm.
 华阳国志
华阳国志 南中志
南中志 卷四中已有关于白铜的记载,云南镍白铜
卷四中已有关于白铜的记载,云南镍白铜 铜镍合金
铜镍合金 闻名中外,曾主要用于造币,亦可用于制作仿银饰品
闻名中外,曾主要用于造币,亦可用于制作仿银饰品 回答下列问题:
回答下列问题: 镍元素基态原子的电子排布式为
镍元素基态原子的电子排布式为 硫酸镍溶于氨水形成
硫酸镍溶于氨水形成 蓝色溶液.
蓝色溶液. 中阴离子的立体构型是
中阴离子的立体构型是 在
在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为 氨是
氨是 填“极性”或“非极性”
填“极性”或“非极性” ,中心原子的轨道杂化类型为
,中心原子的轨道杂化类型为 单质铜及镍都是由
单质铜及镍都是由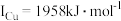 、
、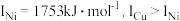 的原因是
的原因是 某镍白铜合金的立方晶胞结构如图所示.
某镍白铜合金的立方晶胞结构如图所示.
 晶胞中铜原子与镍原子的数量比为
晶胞中铜原子与镍原子的数量比为 若合金的密度为
若合金的密度为 ,晶胞参数
,晶胞参数
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
(1)e原子的基态核外电子具有___________ 种不同的空间运动状态。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:___________ 。
(3)o、p两元素的部分电离能数据列于下表:
比较两元素的 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子困难。对此,你的解释是
再失去一个电子困难。对此,你的解释是___________ 。
(4)第3周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是___________ (填Ⅰ图中的序号)。表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是___________ (填元素名称)。

(5)a、d、l三种元素可形成一种离子化合物,其中的化学键类型除了离子键,还包括___________ 。
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | p | |||||||||||||||
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
(3)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
电离能/ |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子困难。对此,你的解释是
再失去一个电子困难。对此,你的解释是(4)第3周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是

(5)a、d、l三种元素可形成一种离子化合物,其中的化学键类型除了离子键,还包括
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铁、铬、锰统称为黑色金属,它们的单质、合金及其化合物在科研和生产中有着重要用途。
请回答下列问题:
(1)铁、铬、锰属于周期表中的___ 区元素。
(2)基态铬原子和基态锰原子中第一电离能较大的是___ (填元素符号),原因为:___ 。
(3)化学式为CrC13·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO3溶液,所得AgCl沉淀的物质的量之比为3:2:1。
①呈暗绿色的配合物内界的化学式为___ 。
②H2O分子的VSEPR模型为___ 。
(4)MnF2和MnCl2均为离子化合物,MnF2的熔点高于MnCl2熔点的原因为___ 。
(5)一氧化锰在医药、冶炼上用途广泛,其立方晶胞结构如图所示。

①该晶胞中由O2-形成的正八面体空隙数目为___ 。
②设NA为阿伏加德罗常数的值,晶胞中距离最近的两个O2-之间的距离为apm,则MnO晶体的密度ρ=___ g·cm-3。(用含a、NA的代数式表示)。
请回答下列问题:
(1)铁、铬、锰属于周期表中的
(2)基态铬原子和基态锰原子中第一电离能较大的是
(3)化学式为CrC13·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO3溶液,所得AgCl沉淀的物质的量之比为3:2:1。
①呈暗绿色的配合物内界的化学式为
②H2O分子的VSEPR模型为
(4)MnF2和MnCl2均为离子化合物,MnF2的熔点高于MnCl2熔点的原因为
(5)一氧化锰在医药、冶炼上用途广泛,其立方晶胞结构如图所示。

①该晶胞中由O2-形成的正八面体空隙数目为
②设NA为阿伏加德罗常数的值,晶胞中距离最近的两个O2-之间的距离为apm,则MnO晶体的密度ρ=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】A~M代表元素周期表的部分元素,其相对位置如表所示。回答下列问题:
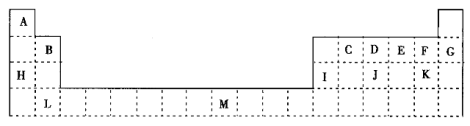
(1)M元素位于元素周期表中的_______ 区;D元素的电子排布式为_______ 。
(2)表中元素电负性最大的是_______ (填元素符号);C、D、F元素的第一电离能的大小顺序为_______ (用元素符号表示)。
(3)D的简单氢化物和J的简单氢化物稳定性更强的是_______ (填化学式)。
(4)A、E、H、J四种元素的原子半径由大到小的排列顺序为_______ (元素符号表示)
(5)H的最高价氧化物的水化物为:_______ (填化学式)。

(1)M元素位于元素周期表中的
(2)表中元素电负性最大的是
(3)D的简单氢化物和J的简单氢化物稳定性更强的是
(4)A、E、H、J四种元素的原子半径由大到小的排列顺序为
(5)H的最高价氧化物的水化物为:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】下表为元素周期表的一部分,请参照元素在表中的位置,回答下列问题: __________ (用元素符号表示)
(2)④、⑤、⑥的原子半径由大到小的顺序为____________ (用元素符号表示)
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________ (用化学式表示)
(4)铁在元素周期表中的位置________ ,属于________ 区(填“s”、“d”、“ds”或“p”),基态Fe的价层电子排布式为________ ,检验溶液中的 常用
常用 溶液,检验的离子方程式为
溶液,检验的离子方程式为_____________ ,铁氰化钾中四种元素的电负性由大到小的顺序为________ 。
(5)第四周期基态原子未成对电子数最多的元素,其价层电子排布轨道表示式为_________ 。

(2)④、⑤、⑥的原子半径由大到小的顺序为
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(4)铁在元素周期表中的位置
 常用
常用 溶液,检验的离子方程式为
溶液,检验的离子方程式为(5)第四周期基态原子未成对电子数最多的元素,其价层电子排布轨道表示式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】铜是人类最早使用的金属之一,用黄铜矿(主要成分为CuFeS2)生产粗铜的反应原理如下:
CuFeS2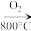 Cu2S
Cu2S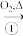 Cu2O
Cu2O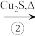 Cu
Cu
回答下列问题:
(1)第三周期主族元素中电负性比S小的元素有_______ 种,H2S分子的空间结构名称为_______ ,H2S的沸点比H2O的_______ (填“高”或“低”),原因是_______ 。
(2)Cu2O和Cu2S均为_______ 晶体,Cu2O的熔点为1235°C,Cu2S的熔点为1130°C,Cu2O熔点较高的原因是_______ 。
(3)反应①、②中会生成气体SO2,其中心原子的杂化方式为_______ 。
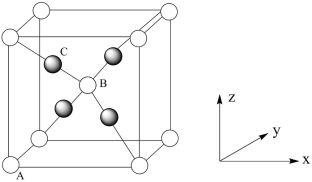
(4)铜的某种氧化物的晶胞如图所示,该氧化物为_______ (填化学式),图中,A原子坐标参数为(0,0,0),B原子为( ,
, ,
, )则C原子的坐标参数为
)则C原子的坐标参数为_______ 。
CuFeS2
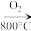 Cu2S
Cu2S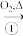 Cu2O
Cu2O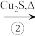 Cu
Cu回答下列问题:
(1)第三周期主族元素中电负性比S小的元素有
(2)Cu2O和Cu2S均为
(3)反应①、②中会生成气体SO2,其中心原子的杂化方式为
(4)铜的某种氧化物的晶胞如图所示,该氧化物为
 ,
, ,
, )则C原子的坐标参数为
)则C原子的坐标参数为
您最近一年使用:0次



