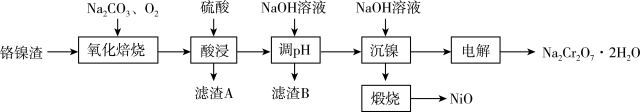
镍、铬等属于宝贵的金属资源。一种回收电化学废渣中铬镍的工艺流程如下:
已知:
①铬镍渣中含有 、
、 、
、 、
、 、
、 等;
等;
②25℃时,部分物质的溶度积表:
③
回答下列问题:
(1)“氧化焙烧”时, 发生的化学方程式
发生的化学方程式_______ 。
(2)“酸浸”使用强力搅拌器搅拌的目的是_______ ,滤渣A主要是_______ (填化学式)。
(3)“调 ”时,若
”时,若 至少为
至少为_______ 时, 沉淀完全。(
沉淀完全。( )
)
(4)“沉镍”后,“煅烧”的化学方程式为_______ 。
(5)已知“电解”操作中的装置如下图所示。
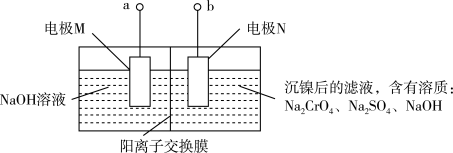
①a接电源的_______ (填“正”或“负”)极。
②电极N上的电极反应式为_______ 。

已知:
①铬镍渣中含有
 、
、 、
、 、
、 、
、 等;
等;②25℃时,部分物质的溶度积表:
| 物质 |  |  |  |  |
 | 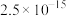 | 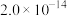 | 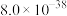 | 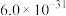 |

回答下列问题:
(1)“氧化焙烧”时,
 发生的化学方程式
发生的化学方程式(2)“酸浸”使用强力搅拌器搅拌的目的是
(3)“调
 ”时,若
”时,若 至少为
至少为 沉淀完全。(
沉淀完全。( )
)(4)“沉镍”后,“煅烧”的化学方程式为
(5)已知“电解”操作中的装置如下图所示。

①a接电源的
②电极N上的电极反应式为
22-23高二下·湖北孝感·开学考试 查看更多[3]
湖北省孝感市部分学校2022-2023学年高二下学期收心考试(开学考试)化学试题安徽省淮北市第一中学2022-2023学年高二下学期第二次月考化学试题(已下线)2023年湖南卷高考真题变式题(工业流程题)
更新时间:2023-02-02 09:59:41
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染。
(1)生物硝化法:在富氧条件下,通过硝酸盐菌的作用,将氨氮(以 NH4+表示,下同)氧化成硝酸盐,其反应的离子方程式为________ 。
(2)MAP 沉淀法:向氨氮废水中投加磷酸盐和镁盐,使之和 NH4+生成难溶复盐MgNH4PO4·6H2O(简称MAP)结晶,是一种比较新颖有效的处理方法。
①用离子方程式表示反应的原理_________ 。
②MAP沉淀法需要控制反应的pH 在 7.5~10 之间。当 pH>10时,由于______ 而不利于MAP的生成。
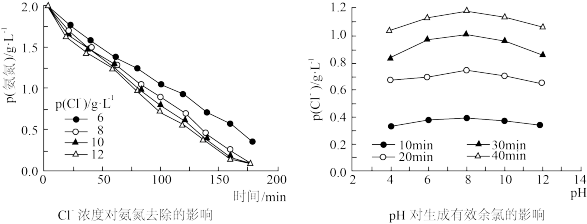
(3)电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用 IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为 85 mA·cm-2下电解,180 min内去除率达到98.22%。
①阳极发生的电极反应式是_______ ; HClO 氧化除去氨氮的反应离子方程式是________ 。
②为了提高氨氮的去除率,需要控制溶液中 Cl-的浓度和 pH,根据下图判断: Cl-的适宜浓度为_________ ,适宜的 pH 为_________ 。
(1)生物硝化法:在富氧条件下,通过硝酸盐菌的作用,将氨氮(以 NH4+表示,下同)氧化成硝酸盐,其反应的离子方程式为
(2)MAP 沉淀法:向氨氮废水中投加磷酸盐和镁盐,使之和 NH4+生成难溶复盐MgNH4PO4·6H2O(简称MAP)结晶,是一种比较新颖有效的处理方法。
①用离子方程式表示反应的原理
②MAP沉淀法需要控制反应的pH 在 7.5~10 之间。当 pH>10时,由于
(3)电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用 IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为 85 mA·cm-2下电解,180 min内去除率达到98.22%。
①阳极发生的电极反应式是
②为了提高氨氮的去除率,需要控制溶液中 Cl-的浓度和 pH,根据下图判断: Cl-的适宜浓度为

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】已知三氯化铁的熔点为 ,沸点为
,沸点为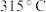 ,易溶于水并且有强烈的吸水性,吸收空气里的水分而潮解,某学习小组对氯气与铁的反应及产物做了如下探究实验。
,易溶于水并且有强烈的吸水性,吸收空气里的水分而潮解,某学习小组对氯气与铁的反应及产物做了如下探究实验。
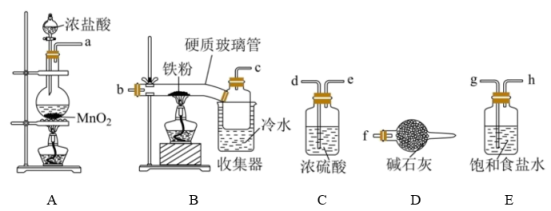
(1)图中装有 的仪器名称为
的仪器名称为___________ ,A中发生反应的离子方程式为___________ 。
(2)为制取纯净的 ,装置连接顺序为a→
,装置连接顺序为a→___________ (用abcdefgh表示)。
(3)B装置中的冷水浴作用是___________ 。
(4)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
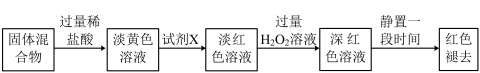
淡红色溶液中加入过量 后溶液红色加深的原因请结合离子方程式解释:
后溶液红色加深的原因请结合离子方程式解释:___________ 。
(5)已知红色褪去的同时有气体生成,经检验为 。该小组同学对红色褪去的原因进行探究。通过查阅资料获知:
。该小组同学对红色褪去的原因进行探究。通过查阅资料获知: 在
在 催化作用下可分解;
催化作用下可分解; 可被氧化剂氧化。据此进行了如下实验:
可被氧化剂氧化。据此进行了如下实验:
①取褪色后溶液三份,第一份滴加 溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和
溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和 溶液,产生白色沉淀。
溶液,产生白色沉淀。
②另取同物质的量浓度的 溶液滴加2滴试剂X,溶液变红,再通入
溶液滴加2滴试剂X,溶液变红,再通入 ,无明显变化。
,无明显变化。
实验①说明溶液红色褪去的原因是___________ (填离子符号)发生了反应;实验②的目的是排除___________ ;最终得出结论:红色褪去的原因是___________ 。
 ,沸点为
,沸点为 ,易溶于水并且有强烈的吸水性,吸收空气里的水分而潮解,某学习小组对氯气与铁的反应及产物做了如下探究实验。
,易溶于水并且有强烈的吸水性,吸收空气里的水分而潮解,某学习小组对氯气与铁的反应及产物做了如下探究实验。
(1)图中装有
 的仪器名称为
的仪器名称为(2)为制取纯净的
 ,装置连接顺序为a→
,装置连接顺序为a→(3)B装置中的冷水浴作用是
(4)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

淡红色溶液中加入过量
 后溶液红色加深的原因请结合离子方程式解释:
后溶液红色加深的原因请结合离子方程式解释:(5)已知红色褪去的同时有气体生成,经检验为
 。该小组同学对红色褪去的原因进行探究。通过查阅资料获知:
。该小组同学对红色褪去的原因进行探究。通过查阅资料获知: 在
在 催化作用下可分解;
催化作用下可分解; 可被氧化剂氧化。据此进行了如下实验:
可被氧化剂氧化。据此进行了如下实验:①取褪色后溶液三份,第一份滴加
 溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和
溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和 溶液,产生白色沉淀。
溶液,产生白色沉淀。②另取同物质的量浓度的
 溶液滴加2滴试剂X,溶液变红,再通入
溶液滴加2滴试剂X,溶液变红,再通入 ,无明显变化。
,无明显变化。实验①说明溶液红色褪去的原因是
您最近一年使用:0次
【推荐3】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、FeO、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
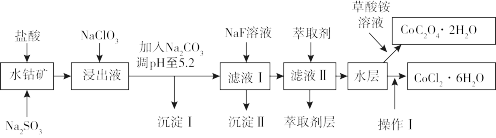
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中氧化剂与还原剂物质的量之比为___ 。
(2)NaClO3在浸出液中发生反应的离子方程式为___ 。
(3)加入Na2CO3调pH至5.2,目的是___ ;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为___ 。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___ 、___ 、过滤、洗涤、减压烘干等过程。
(5)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为___ 。[已知:CoC2O4·2H2O的摩尔质量为183g·mol-1]

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Co(OH)2 | 7.6 | 9.2 |
| Al(OH)3 | 4.0 | 5.2 |
| Mn(OH)2 | 7.7 | 9.8 |
(2)NaClO3在浸出液中发生反应的离子方程式为
(3)加入Na2CO3调pH至5.2,目的是
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,
(5)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
| 温度范围/℃ | 150~210 | 290~320 |
| 固体质量/g | 4.41 | 2.41 |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
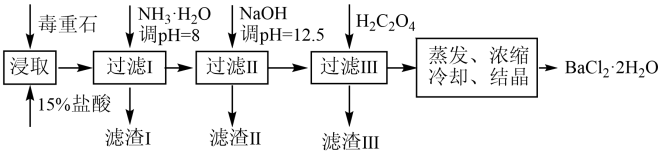
【推荐1】毒重石的主要成分为 (含
(含 、
、 、
、 等杂质)。实验室利用毒重石制备
等杂质)。实验室利用毒重石制备 的流程如下:
的流程如下:
已知:25℃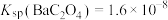 ,
,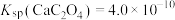
(1)提高毒重石的浸取速率可采取的措施(例举2条)___________ 、___________ 。
(2)加入 调
调 可除去
可除去___________ (填离子符号),滤渣Ⅱ中含___________ (填化学式)。
(3)加入 时应避免过量,原因是
时应避免过量,原因是___________ 。
(4)已知25℃时,将 加入蒸馏水中形成饱和溶液,溶液中的
加入蒸馏水中形成饱和溶液,溶液中的 为
为___________  。
。
 (含
(含 、
、 、
、 等杂质)。实验室利用毒重石制备
等杂质)。实验室利用毒重石制备 的流程如下:
的流程如下:
已知:25℃
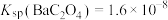 ,
,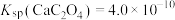
| 离子符号 |  |  |  |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(1)提高毒重石的浸取速率可采取的措施(例举2条)
(2)加入
 调
调 可除去
可除去(3)加入
 时应避免过量,原因是
时应避免过量,原因是(4)已知25℃时,将
 加入蒸馏水中形成饱和溶液,溶液中的
加入蒸馏水中形成饱和溶液,溶液中的 为
为 。
。
您最近一年使用:0次
【推荐2】高铁酸钾是一种高效的多功能水处理剂,具有强氧化性。制备高铁酸钾方法很多。
(1)干法制备高铁酸钾。将Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物。此制备反应中,氧化剂与还原剂的物质的量之比为_____________________ 。
(2)湿法制备高铁酸钾。工业上常采用NaClO氧化法生产,原理如下:
a.3NaClO+2Fe(NO3)3+ 10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
b.Na2FeO4+2KOH =K2FeO4+2NaOH
主要的生产流程如图:

①流程图中“转化”是在某低温下进行的,说明此温度下的溶解度S(K2FeO4)_____ S(Na2FeO4)(填“>”“<”或“=”)。
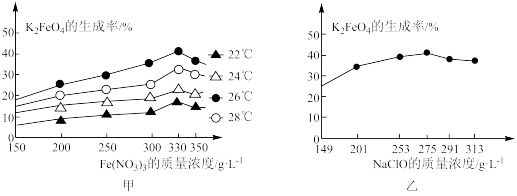
②湿法制备中,反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。如图,图甲为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图乙为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。工业生产中最佳温度为_________ ℃,此时Fe(NO3)3与NaClO 两种溶液最佳质量浓度之比为______________ 。
③若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:_____________________ 。若Fe( NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式为__________________________________ 。
(3)K2FeO4在水溶液中易水解:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。
①在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用__________ 溶液(填序号)。
A.H2O B.CH3COOK、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
②K2FeO4在处理水的过程中所起的作用有_______________________ 。
(4)室温下,向含有Fe3+的CuSO4溶液中加入Cu(OH)2可使Fe3+转化为Fe(O H)3沉淀,从而除去Fe3+。该反应的平衡常数为_____________________ 。(已知常温下的溶度积常数:Ksp[Cu(OH)2]=2.0×10-20, Ksp[Fe(OH)3]=4.0×10-38)。
(1)干法制备高铁酸钾。将Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物。此制备反应中,氧化剂与还原剂的物质的量之比为
(2)湿法制备高铁酸钾。工业上常采用NaClO氧化法生产,原理如下:
a.3NaClO+2Fe(NO3)3+ 10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
b.Na2FeO4+2KOH =K2FeO4+2NaOH
主要的生产流程如图:

①流程图中“转化”是在某低温下进行的,说明此温度下的溶解度S(K2FeO4)
②湿法制备中,反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。如图,图甲为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图乙为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。工业生产中最佳温度为

③若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:
(3)K2FeO4在水溶液中易水解:4FeO42-+10H2O
 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。①在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
A.H2O B.CH3COOK、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
②K2FeO4在处理水的过程中所起的作用有
(4)室温下,向含有Fe3+的CuSO4溶液中加入Cu(OH)2可使Fe3+转化为Fe(O H)3沉淀,从而除去Fe3+。该反应的平衡常数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】生产硫酸时产生的硫铁矿渣是一种重要的化工中间产物。研究人员利用某硫铁矿渣[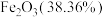 、
、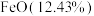 、
、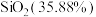 、
、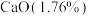 、
、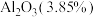 ,还有
,还有 、
、 、
、 、
、 等]制备出高纯氧化铁,工艺流程如下:
等]制备出高纯氧化铁,工艺流程如下:
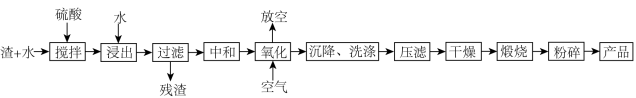
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
已知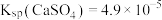 ,回答下列问题:
,回答下列问题:
(1)残渣的成分含有 、
、 、
、 、
、___________ 、___________ (写化学式,每空填一种物质)。
(2)流程中“中和”应调节溶液
___________ (填“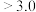 ”、“
”、“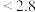 ”或“
”或“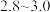 ”),原因是
”),原因是___________ 。
(3)某次酸浸出液中,测得 、
、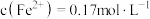 、
、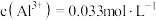 、
、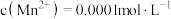 、
、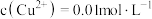 、
、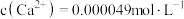 ,则溶液
,则溶液
___________
(4)烧渣中的 可制备
可制备 ,
, 是一种
是一种 的分解催化剂,西南石油大学课题组用
的分解催化剂,西南石油大学课题组用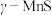 ,在
,在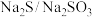 溶液中分解
溶液中分解 制备
制备 ,反应部分历程如下(用
,反应部分历程如下(用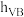 表示催化剂):
表示催化剂):

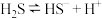
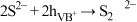
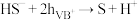
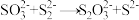
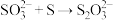
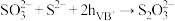
写出反应总离子方程式___________ ,反应中可重复利用的物质是___________ ,用离子方程式表示可重复利用的过程___________ 。
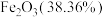 、
、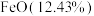 、
、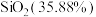 、
、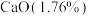 、
、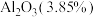 ,还有
,还有 、
、 、
、 、
、 等]制备出高纯氧化铁,工艺流程如下:
等]制备出高纯氧化铁,工艺流程如下:
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |  |
开始沉淀 | 1.1 | 5.8 | 3.0 | 4.4 | 4.2 |
完全沉淀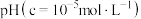 | 2.8 | 8.3 | 4.7 | 10.1 | 6.7 |
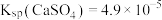 ,回答下列问题:
,回答下列问题:(1)残渣的成分含有
 、
、 、
、 、
、(2)流程中“中和”应调节溶液

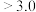 ”、“
”、“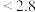 ”或“
”或“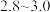 ”),原因是
”),原因是(3)某次酸浸出液中,测得
 、
、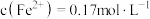 、
、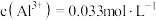 、
、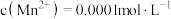 、
、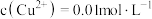 、
、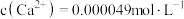 ,则溶液
,则溶液
(4)烧渣中的
 可制备
可制备 ,
, 是一种
是一种 的分解催化剂,西南石油大学课题组用
的分解催化剂,西南石油大学课题组用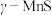 ,在
,在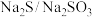 溶液中分解
溶液中分解 制备
制备 ,反应部分历程如下(用
,反应部分历程如下(用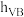 表示催化剂):
表示催化剂):
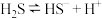
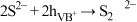
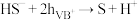
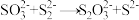
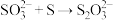
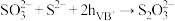
写出反应总离子方程式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】Cl2及其化合物在生产、生活中具有广泛的用途。
(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三 者中所占分数(α)随pH变化的关系如图1所示:
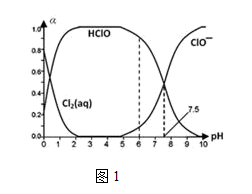
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是_________________ 。
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为__________ 。
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应 的化学方程式_________________ 。
(3)工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2.电解时,NaClO3在______ 极(填阴或阳)生成,生成 的电极反应式为
的电极反应式为_________ 。
(4)一定条件下,在水溶液中 1mol Cl-、1mol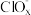 (x=1,2,3,4)的能量大小与化合价的关系如图2所示:
(x=1,2,3,4)的能量大小与化合价的关系如图2所示:

①从能量角度看,C、D、E中最不稳定的离子是_________________ (填离子符号)。
②B→A+D反应的热化学方程式为_________________ (用离子符号表示)。
(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三 者中所占分数(α)随pH变化的关系如图1所示:

①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应 的化学方程式
(3)工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2.电解时,NaClO3在
 的电极反应式为
的电极反应式为(4)一定条件下,在水溶液中 1mol Cl-、1mol
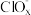 (x=1,2,3,4)的能量大小与化合价的关系如图2所示:
(x=1,2,3,4)的能量大小与化合价的关系如图2所示:
①从能量角度看,C、D、E中最不稳定的离子是
②B→A+D反应的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】NOx、SO2的处理转化对环境保护有着重要意义。
(1)利用反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=n(NO)/n(CO)]的关系如图1所示。
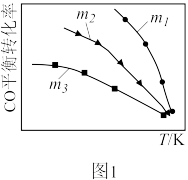
①该反应的ΔH_______ (填“>”“<”或“=”)0。
②下列说法正确的是____ (填字母)。
A.当体系中CO2和CO物质的量浓度之比保持不变时,反应达到平衡状态
B.投料比:m1>m2>m3
C.当投料比m=2时,NO转化率是CO转化率的2倍
D.汽车排气管中的催化剂可提高NO的平衡转化率
③随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为:_____ 。
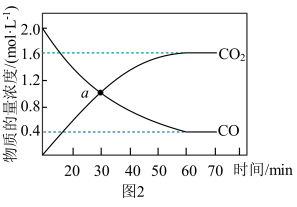
(2)若反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的正、逆反应速率可表示为:v正=k正·c2(NO)·c2(CO);v逆=k逆·c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。一定温度下,在体积为1L的容器中加入2molNO和2molCO发生上述反应,测得CO和CO2物质的量浓度随时间的变化如图2所示,则a点时,v正∶v逆=____ 。
(3)NH3催化还原氮氧化物是目前应用最广泛的烟气脱硝除技术。用活化后的V2O5作催化剂,NH3将NO还原成N2的一种反应历程如图3所示,则总反应方程式为:____ 。
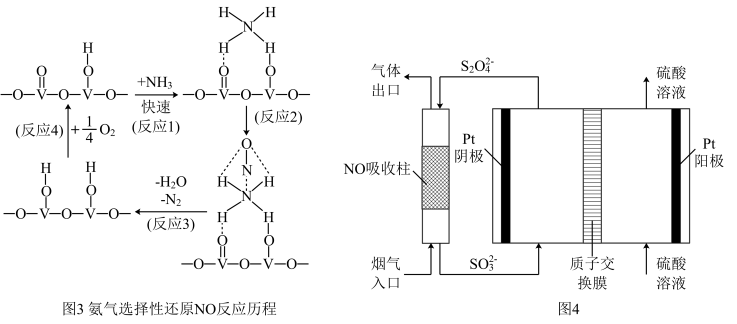
(4)用间接电化学法去除烟气中NO的原理如图4所示,则阴极的电极反应式为:_____ 。
(1)利用反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=n(NO)/n(CO)]的关系如图1所示。

①该反应的ΔH
②下列说法正确的是
A.当体系中CO2和CO物质的量浓度之比保持不变时,反应达到平衡状态
B.投料比:m1>m2>m3
C.当投料比m=2时,NO转化率是CO转化率的2倍
D.汽车排气管中的催化剂可提高NO的平衡转化率
③随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为:
(2)若反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的正、逆反应速率可表示为:v正=k正·c2(NO)·c2(CO);v逆=k逆·c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。一定温度下,在体积为1L的容器中加入2molNO和2molCO发生上述反应,测得CO和CO2物质的量浓度随时间的变化如图2所示,则a点时,v正∶v逆=

(3)NH3催化还原氮氧化物是目前应用最广泛的烟气脱硝除技术。用活化后的V2O5作催化剂,NH3将NO还原成N2的一种反应历程如图3所示,则总反应方程式为:

(4)用间接电化学法去除烟气中NO的原理如图4所示,则阴极的电极反应式为:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】合理利用废旧铅蓄电池可缓解铅资源短缺,同时减少污染。
I.一种从废旧铅蓄电池的铅膏中回收高纯铅的流程如下图(部分产物已略去)。
①不同铅化合物的溶度积(25℃):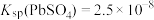 ,
,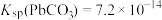 ;
;
②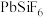 和
和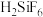 均为能溶于水的强电解质。
均为能溶于水的强电解质。
(1)过程i中,物质a表现___________ (填“氧化”或“还原”)性。
(2)结合平衡移动原理,解释过程ⅱ加入 溶液的作用:
溶液的作用:___________ 。
(3)过程ⅲ发生反应的离子方程式为___________ 。
II.工业上用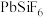 、
、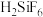 混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如下。
混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如下。___________ 极。
②铅的电解精炼需要调控好溶液中的 。其他条件相同时,测得铅产率随起始时溶液中
。其他条件相同时,测得铅产率随起始时溶液中 的变化趋势如下图。由图可知,随
的变化趋势如下图。由图可知,随 增大,铅产率先增大后减小,减小的原因可能是
增大,铅产率先增大后减小,减小的原因可能是____ 。 以保持溶液中
以保持溶液中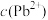 的稳定,结合电极方程式解释原因:
的稳定,结合电极方程式解释原因:______ 。
I.一种从废旧铅蓄电池的铅膏中回收高纯铅的流程如下图(部分产物已略去)。

①不同铅化合物的溶度积(25℃):
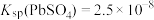 ,
,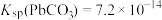 ;
;②
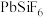 和
和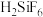 均为能溶于水的强电解质。
均为能溶于水的强电解质。(1)过程i中,物质a表现
(2)结合平衡移动原理,解释过程ⅱ加入
 溶液的作用:
溶液的作用:(3)过程ⅲ发生反应的离子方程式为
II.工业上用
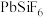 、
、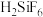 混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如下。
混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如下。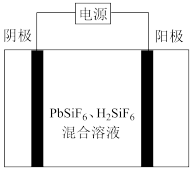
②铅的电解精炼需要调控好溶液中的
 。其他条件相同时,测得铅产率随起始时溶液中
。其他条件相同时,测得铅产率随起始时溶液中 的变化趋势如下图。由图可知,随
的变化趋势如下图。由图可知,随 增大,铅产率先增大后减小,减小的原因可能是
增大,铅产率先增大后减小,减小的原因可能是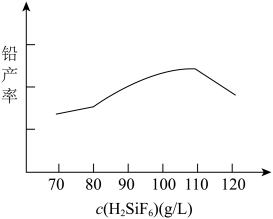
 以保持溶液中
以保持溶液中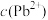 的稳定,结合电极方程式解释原因:
的稳定,结合电极方程式解释原因:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:
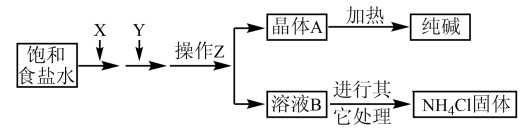
(1)在饱和食盐水中通入X和Y,则X____ (填物质名称)
(2)写出通入X和Y的化学反应方程式_____ 。
(3)操作Z____ (填名称),为了得到化肥(NH4Cl),需要在溶液B中通入NH3、加食盐,其中通入NH3的作用一____ ,作用二____ 。
(4)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:①称取样品ag,加水溶解;②加入足量的BaCl2溶液;③过滤、___ 、烘干、冷却、称量、烘干、冷却、___ ,最终得到固体bg。样品中纯碱的质量分数为____ (用含a、b的代数式)
(5)某课外活动小组要用NaOH溶液和CO2来制备Na2CO3固体,他们只有未知浓度的NaOH溶液50毫升和足量的CO2,他们的设计方案是:首先_____ ,然后_____ ,加热_____ 后,再____ ,最后加热浓缩,冷却结晶,过滤得固体Na2CO3 。

(1)在饱和食盐水中通入X和Y,则X
(2)写出通入X和Y的化学反应方程式
(3)操作Z
(4)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:①称取样品ag,加水溶解;②加入足量的BaCl2溶液;③过滤、
(5)某课外活动小组要用NaOH溶液和CO2来制备Na2CO3固体,他们只有未知浓度的NaOH溶液50毫升和足量的CO2,他们的设计方案是:首先
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】氧锰八面体纳米棒(OMS-2)是一种新型的环保催化剂。用软锰矿和黄铁矿(主要成分分别为MnO2、FeS2)合成OMS-2的工艺流程如下:
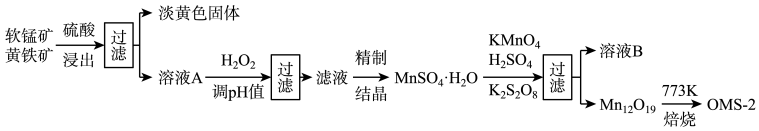
(1)FeS2中硫元素的化合价是_________ 。“调pH并过滤”主要除去______ 元素。
(2)Mn12O19中氧元素化合价均为-2价,锰元素的化合价有两种,则Mn (Ⅲ)、Mn (Ⅳ) 物质的量之比为_______________ 。生产过程中的原料KMnO4、K2S2O8、MnSO4·H2O按物质的量比1:1:5反应,产物中硫元素全部以SO 的形式存在,该反应的离子方程式为
的形式存在,该反应的离子方程式为__________________________ 。
(3)溶液B可进一步分离出两种主要化合物,一种可在该工艺中循环使用,化学式是____________ ;另一种为盐类,在农业生产中可用作___________________________ 。
(4)OMS-2是一种纳米级的分子筛。分别用OMS-2和MnOx对甲醛进行催化氧化,在相同时间内甲醛转化率和温度的关系如图:
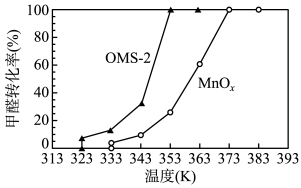
由图可知,OMS-2与MnOx相比,催化效率较高是____________________ ,原因是________________ 。
(5)甲醛(HCHO)在OMS-2催化氧化作用下生成CO2和H2O,现利用OMS-2对某密闭空间的甲醛进行催化氧化实验,实验开始时,该空间内甲醛含量为1.22mg/L,CO2含量为0.590mg/L,一段时间后测得CO2含量升高至1.25mg/L,该实验中甲醛的转化率为_______________________ 。

(1)FeS2中硫元素的化合价是
(2)Mn12O19中氧元素化合价均为-2价,锰元素的化合价有两种,则Mn (Ⅲ)、Mn (Ⅳ) 物质的量之比为
 的形式存在,该反应的离子方程式为
的形式存在,该反应的离子方程式为(3)溶液B可进一步分离出两种主要化合物,一种可在该工艺中循环使用,化学式是
(4)OMS-2是一种纳米级的分子筛。分别用OMS-2和MnOx对甲醛进行催化氧化,在相同时间内甲醛转化率和温度的关系如图:

由图可知,OMS-2与MnOx相比,催化效率较高是
(5)甲醛(HCHO)在OMS-2催化氧化作用下生成CO2和H2O,现利用OMS-2对某密闭空间的甲醛进行催化氧化实验,实验开始时,该空间内甲醛含量为1.22mg/L,CO2含量为0.590mg/L,一段时间后测得CO2含量升高至1.25mg/L,该实验中甲醛的转化率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】硫化银精矿(含 、
、 、
、 、
、 、
、 及
及 等)氯化焙烧提银工艺如图所示:
等)氯化焙烧提银工艺如图所示:

已知:氯化焙烧时,氧化物不参与反应,硫化物转化为氯化物;氯化铅不溶于水,溶于氯化钠溶液。
回答下列问题:
(1)硫化银精矿和食盐在氯化焙烧前需磨碎的目的是________ 。
(2)“氯化焙烧”时,金属硫化物在高温下先氧化为氧化物,再氯化为金属氯化物。
① 焙烧生成氧化银反应的化学方程式为
焙烧生成氧化银反应的化学方程式为________________________ 。
②“烟气处理”时,烟尘进行回收后,还需用碱液处理的目的是________________ 。
(3)已知常温下, 。“水洗”后,“滤液1”中
。“水洗”后,“滤液1”中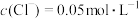 ,则
,则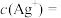
________ 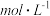 。
。
(4)“滤渣2”主要为 和
和________ (填化学式)。
(5)“滤液3”蒸发的目的是________________________________ 。
(6)粗银(含 及少量
及少量 、
、 、
、 等)可采用电解精炼提纯,用
等)可采用电解精炼提纯,用 、少量
、少量 、
、 配成电解液。电解时,阴极上有少量NO产生,其原因是
配成电解液。电解时,阴极上有少量NO产生,其原因是________ (用电极反应式解释)。
 、
、 、
、 、
、 、
、 及
及 等)氯化焙烧提银工艺如图所示:
等)氯化焙烧提银工艺如图所示:
已知:氯化焙烧时,氧化物不参与反应,硫化物转化为氯化物;氯化铅不溶于水,溶于氯化钠溶液。
回答下列问题:
(1)硫化银精矿和食盐在氯化焙烧前需磨碎的目的是
(2)“氯化焙烧”时,金属硫化物在高温下先氧化为氧化物,再氯化为金属氯化物。
①
 焙烧生成氧化银反应的化学方程式为
焙烧生成氧化银反应的化学方程式为②“烟气处理”时,烟尘进行回收后,还需用碱液处理的目的是
(3)已知常温下,
 。“水洗”后,“滤液1”中
。“水洗”后,“滤液1”中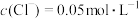 ,则
,则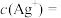
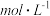 。
。(4)“滤渣2”主要为
 和
和(5)“滤液3”蒸发的目的是
(6)粗银(含
 及少量
及少量 、
、 、
、 等)可采用电解精炼提纯,用
等)可采用电解精炼提纯,用 、少量
、少量 、
、 配成电解液。电解时,阴极上有少量NO产生,其原因是
配成电解液。电解时,阴极上有少量NO产生,其原因是
您最近一年使用:0次



