建造中国空间站,化学材料功不可没,如制造空间站外壳用到钛合金,制造太阳翼伸展机构用到碳化硅,制造“天和”核心舱电推进系统用到氮化硼。回答下列问题:
(1)基态N原子的价电子排布图(轨道表示式)为_______
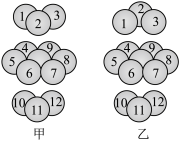
(2)金属钛的晶体属于六方最密堆积,其堆积方式如如图_______ (填“甲”或“乙”),配位数为_______ 。
(3)B、C、N第一电离能由小到大的顺序是_______ ,氮的第一电离能大于氧的原因是_______ 。
(4)碳化硅具有硬度大、耐高温、绝缘性能好等优点,则碳化硅所属晶体类型是_______ ,碳化硅的硬度略小于金刚石,其原因是_______ 。
(5)氮化硼的晶体结构有两种:六方氮化硼和立方氮化硼,前者具有石墨型晶体结构,后者晶体结构如图所示。
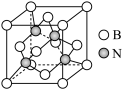
①六方氮化硼晶体中B、N原子的杂化轨道类型均为_______ ,立方氮化硼晶体中B、N原子的杂化轨道类型均为_______ 。
②已知立方氮化硼晶体的密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则立方氮化硼的晶胞参数a=
,则立方氮化硼的晶胞参数a=_______ pm(列出计算式)。
(1)基态N原子的价电子排布图(轨道表示式)为
(2)金属钛的晶体属于六方最密堆积,其堆积方式如如图

(3)B、C、N第一电离能由小到大的顺序是
(4)碳化硅具有硬度大、耐高温、绝缘性能好等优点,则碳化硅所属晶体类型是
(5)氮化硼的晶体结构有两种:六方氮化硼和立方氮化硼,前者具有石墨型晶体结构,后者晶体结构如图所示。

①六方氮化硼晶体中B、N原子的杂化轨道类型均为
②已知立方氮化硼晶体的密度为
 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则立方氮化硼的晶胞参数a=
,则立方氮化硼的晶胞参数a=
更新时间:2023-02-19 20:22:30
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)、鉝(Lv)六种元素。请回答下列问题:
(1)O及与O同周期的相邻元素,第一电离能由大到小的顺序为_________ 。
(2)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法中正确的是______ (填选项字母)。
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤对电子数目相等 D.都含有极性键
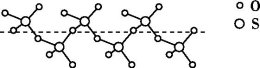
②SO3分子的空间构型为_________ ,与其互为等电子体的阴离子为______ (举一例)。将纯液态SO3冷却到289.8 K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中硫原子的杂化轨道类型是___ 。
(3)元素X与硒同周期,X元素原子核外未成对电子数最多,X为____ (填元素符号),X的基态原子的电子排布式为_____ 。
(4)单质钋(Po)是简单立方堆积的金属晶体,若已知Po的摩尔质量为M g·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为___ g/cm3。
(1)O及与O同周期的相邻元素,第一电离能由大到小的顺序为
(2)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法中正确的是
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤对电子数目相等 D.都含有极性键
②SO3分子的空间构型为
(3)元素X与硒同周期,X元素原子核外未成对电子数最多,X为
(4)单质钋(Po)是简单立方堆积的金属晶体,若已知Po的摩尔质量为M g·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
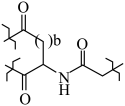
【推荐2】磷、铁及其化合物在生产生活及科研中应用广泛。
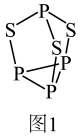
(1)P4S3可用于制造火柴,其分子结构如图1所示。
①基态P原子的价层电子排布式为___________ ,P和S的第一电离能的大小顺序是P___________ S(填“>”、“<”或“=”)。
②每个P4S3分子中含孤电子对的数目为___________ ,P4S3分子中硫原子的杂化轨道类型为___________
(2)磷化铝熔点为2000℃,它与晶体硅结构类似,磷化铝晶胞结构如图2所示。
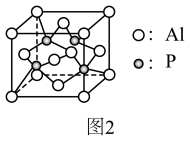
①磷化铝晶体中磷原子与铝原子间的作用力为___________
②磷化铝晶体中由4个P原子围成的空间构型是___________
③已知相邻的P原子与A1原子的核间距是dnm,则磷化铝晶胞的边长是___________ nm。
(3)Fe3+、Co3+与N 、CN-等可形成络合离子。
、CN-等可形成络合离子。
①K3[Fe(CN)6]常用于检验Fe2+,1mol[Fe(CN)6]3-离子中含有σ键的数目为___________
②[Co(N3)(NH3)5]SO4中Co3+的配位数为___________
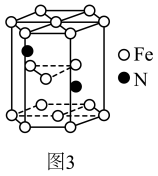
(4)某种磁性氮化铁晶体的结构如图3所示,设底面六边形的边长为anm,六棱柱的高为cnm,该晶体的密度为___________ g·cm-3(用含a、c的代数式表示)。
(1)P4S3可用于制造火柴,其分子结构如图1所示。

①基态P原子的价层电子排布式为
②每个P4S3分子中含孤电子对的数目为
(2)磷化铝熔点为2000℃,它与晶体硅结构类似,磷化铝晶胞结构如图2所示。

①磷化铝晶体中磷原子与铝原子间的作用力为
②磷化铝晶体中由4个P原子围成的空间构型是
③已知相邻的P原子与A1原子的核间距是dnm,则磷化铝晶胞的边长是
(3)Fe3+、Co3+与N
 、CN-等可形成络合离子。
、CN-等可形成络合离子。①K3[Fe(CN)6]常用于检验Fe2+,1mol[Fe(CN)6]3-离子中含有σ键的数目为
②[Co(N3)(NH3)5]SO4中Co3+的配位数为
(4)某种磁性氮化铁晶体的结构如图3所示,设底面六边形的边长为anm,六棱柱的高为cnm,该晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】锂 磷酸氧铜电池正极的活性物质是
磷酸氧铜电池正极的活性物质是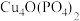 ,可通过下列反应制备:
,可通过下列反应制备: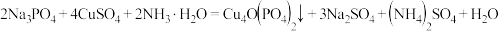
(1)写出基态 价电子的轨道表示式
价电子的轨道表示式_____ ,与 同周期的元素中,与铜原子最外层电子数相等的元素还有
同周期的元素中,与铜原子最外层电子数相等的元素还有_____ (填元素符号),上述方程式中涉及到的 、
、 元素第一电离能由小到大的顺序为
元素第一电离能由小到大的顺序为_____ 。
(2) 的空间构型是
的空间构型是_____ ,其等电子体有_____ (填两个)。
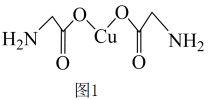
(3)氨基乙酸铜的分子结构如图 ,氮原子的杂化方式为
,氮原子的杂化方式为_____ 。
(4)在硫酸铜溶液中加入过量 ,生成配合物
,生成配合物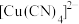 ,则
,则 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为_____ 。
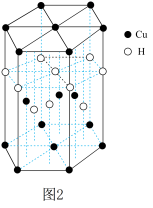
(5) 元素与
元素与 元素可形成一种红色化合物,其晶体结构单元如图
元素可形成一种红色化合物,其晶体结构单元如图 所示。则该化合物的化学式为
所示。则该化合物的化学式为_____ 。
(6)铜晶体为面心立方最密堆积,铜的原子半径为 ,则晶体铜密度的计算式为
,则晶体铜密度的计算式为_____  。
。
 磷酸氧铜电池正极的活性物质是
磷酸氧铜电池正极的活性物质是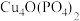 ,可通过下列反应制备:
,可通过下列反应制备: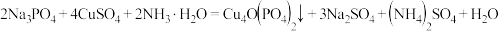


(1)写出基态
 价电子的轨道表示式
价电子的轨道表示式 同周期的元素中,与铜原子最外层电子数相等的元素还有
同周期的元素中,与铜原子最外层电子数相等的元素还有 、
、 元素第一电离能由小到大的顺序为
元素第一电离能由小到大的顺序为(2)
 的空间构型是
的空间构型是(3)氨基乙酸铜的分子结构如图
 ,氮原子的杂化方式为
,氮原子的杂化方式为(4)在硫酸铜溶液中加入过量
 ,生成配合物
,生成配合物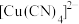 ,则
,则 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为(5)
 元素与
元素与 元素可形成一种红色化合物,其晶体结构单元如图
元素可形成一种红色化合物,其晶体结构单元如图 所示。则该化合物的化学式为
所示。则该化合物的化学式为(6)铜晶体为面心立方最密堆积,铜的原子半径为
 ,则晶体铜密度的计算式为
,则晶体铜密度的计算式为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】卤化物、氢化物在科研和生活中占有重要地位。回答下列问题:
(1)下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是 。
(2) 的VSEPR模型名称为
的VSEPR模型名称为____________ 。
(3)二氟氮烯(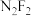 )分子中,每个原子均满足八电子稳定结构,则
)分子中,每个原子均满足八电子稳定结构,则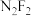 的结构式为
的结构式为____________ 。
(4)C、N、O三种元素都能与H元素形成含A-A(A表示C、N、O元素)键的氢化物。氢化物中A-A键的键能( )如下表:
)如下表:
A-A键的键能依次降低的原因是____________________________________________________________ 。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺( )半导体作为吸光材料。
)半导体作为吸光材料。 的晶胞如图所示,其中
的晶胞如图所示,其中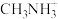 位于顶点(大空心球)位置。已知
位于顶点(大空心球)位置。已知 晶体的晶胞参数为a nm,阿伏加德罗常数的值为
晶体的晶胞参数为a nm,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为____________  。(用最简式表达)
。(用最简式表达)

(1)下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是 。
A. | B. | C.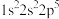 | D. |
 的VSEPR模型名称为
的VSEPR模型名称为(3)二氟氮烯(
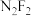 )分子中,每个原子均满足八电子稳定结构,则
)分子中,每个原子均满足八电子稳定结构,则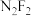 的结构式为
的结构式为(4)C、N、O三种元素都能与H元素形成含A-A(A表示C、N、O元素)键的氢化物。氢化物中A-A键的键能(
 )如下表:
)如下表:
|
| HO-OH |
346 | 247 | 207 |
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(
 )半导体作为吸光材料。
)半导体作为吸光材料。 的晶胞如图所示,其中
的晶胞如图所示,其中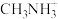 位于顶点(大空心球)位置。已知
位于顶点(大空心球)位置。已知 晶体的晶胞参数为a nm,阿伏加德罗常数的值为
晶体的晶胞参数为a nm,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为 。(用最简式表达)
。(用最简式表达)
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
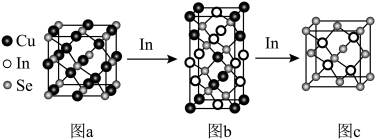
【推荐2】缺陷工程是提高SIBs性能的一种重要手段,由于缺陷的种类多样性和可插入或提取原子的极高选择性,研究人员可以在微观层面精准操控晶体结构,从而实现所需的性能优化。硒(Se)铜材料内部引入铟(In),显著提高了材料对于 的存储能力。回答下列问题:
的存储能力。回答下列问题:
(1)In的原子序数为49号,基态1n的价电子的自旋量子数之和为_______ ,其位于元素周期表的_______ 区。
(2)某磁性材料载体的结构如图所示,该载体中含有的官能团有_______ 种,含氧官能团的名称为_______ 。 的配位数是
的配位数是_______ 。物质中含的大π键,可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则邻氨基吡啶(
),则邻氨基吡啶(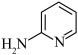 )中环外的N原子与环可形成整体的大π键,则所含大π键可表示为
)中环外的N原子与环可形成整体的大π键,则所含大π键可表示为_______ ,有机物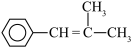 的名称为
的名称为_______ (用系统命名法),其含有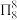 的大π键,则可能共平面的原子数最多有
的大π键,则可能共平面的原子数最多有_______ 个。_______ 。
②图c的晶胞中In的化合价为+1和+3,则两种价态的In原子个数比为_______ 。
 的存储能力。回答下列问题:
的存储能力。回答下列问题:(1)In的原子序数为49号,基态1n的价电子的自旋量子数之和为
(2)某磁性材料载体的结构如图所示,该载体中含有的官能团有
 的配位数是
的配位数是 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则邻氨基吡啶(
),则邻氨基吡啶( )中环外的N原子与环可形成整体的大π键,则所含大π键可表示为
)中环外的N原子与环可形成整体的大π键,则所含大π键可表示为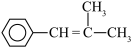 的名称为
的名称为 的大π键,则可能共平面的原子数最多有
的大π键,则可能共平面的原子数最多有
②图c的晶胞中In的化合价为+1和+3,则两种价态的In原子个数比为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】请回答以下问题:
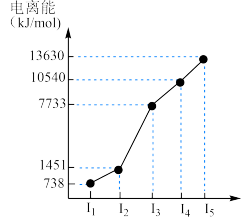
(1)第四周期的某主族元素,其第一至五电离能数据如图所示,则该元素对应原子的M层电子排布式为____________ 。
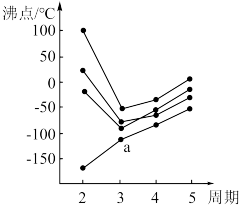
(2)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是______ 。
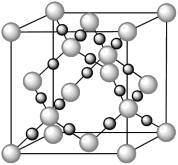
(3)CO2在高温高压下所形成的晶体其晶胞如图所示.该晶体的熔点比SiO2晶体________ (填“高”或“低”),该晶体中碳原子轨道的杂化类型为______ 。
(4)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为____ (填序号)。
A.离子键 B.配位键 C.氢键 D.非极性共价键
若化合物(CH3)3N能溶于水,试解释其原因:_________________________ 。
(5)一种新型储氢化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为__________________ (若含有配位键,要求用箭头表示)
(6)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为______________________ ;正四面体形阳离子中键角小于PCl3的键角原因为_____________________________ ;若PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因______________________ 。
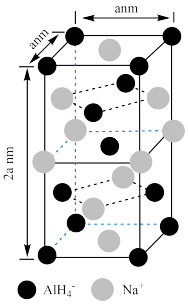
(7)氢化铝钠(NaAlH4)是一种新型轻质材料, NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如下图所示。NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有_________ 个;NaAlH4晶体的密度为___________ g·cm-3(用含a的代数式表示)。
(1)第四周期的某主族元素,其第一至五电离能数据如图所示,则该元素对应原子的M层电子排布式为

(2)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是

(3)CO2在高温高压下所形成的晶体其晶胞如图所示.该晶体的熔点比SiO2晶体

(4)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为
A.离子键 B.配位键 C.氢键 D.非极性共价键
若化合物(CH3)3N能溶于水,试解释其原因:
(5)一种新型储氢化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为
(6)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为
(7)氢化铝钠(NaAlH4)是一种新型轻质材料, NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如下图所示。NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:

(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________ ,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为________ 。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________ ,H3BO3晶体中B原子个数与极性键个数比为________ 。
(3)三种晶体中熔点最低的是________ ,其晶体受热熔化时,克服的微粒之间的相互作用为________________________________________________________________ 。
(4)结合CaF2晶体的晶胞示意图,已知,两个距离最近的Ca2+核间距离为a×10-8 cm,计算CaF2晶体的密度为________ g·cm-3。

(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是
(3)三种晶体中熔点最低的是
(4)结合CaF2晶体的晶胞示意图,已知,两个距离最近的Ca2+核间距离为a×10-8 cm,计算CaF2晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】研究表明,新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”;某些铜的合金具有很好的储氢功能。回答下列问题:
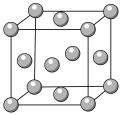
(1)铜的晶胞结构如图所示,铜原子的配位数为___________ ,基态铜原子的电子排布式为___________ 。
(2)白铜(铜镍合金)的立方晶胞结构如下图所示。
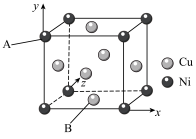
①基态镍原子的价层电子轨道表示式为___________ _
②若原子A的坐标参数为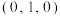 ,原子B的坐标参数为
,原子B的坐标参数为___________ 。
③若该晶体密度为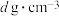 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为___________ cm。( 表示阿伏伽德罗常数)
表示阿伏伽德罗常数)
(1)铜的晶胞结构如图所示,铜原子的配位数为

(2)白铜(铜镍合金)的立方晶胞结构如下图所示。

①基态镍原子的价层电子轨道表示式为
②若原子A的坐标参数为
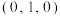 ,原子B的坐标参数为
,原子B的坐标参数为③若该晶体密度为
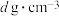 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为 表示阿伏伽德罗常数)
表示阿伏伽德罗常数)
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】金属铜在电力工业和科研领域中的应用广泛,科学家对于铜元素的研究不断深入。请回答下列问题:
(1)基态Cu原子的价电子排布式为_______ 。
(2)已知:高温下Cu2O比CuO稳定。从核外电子排布角度解释高温下Cu2O更稳定的原因为_______ 。
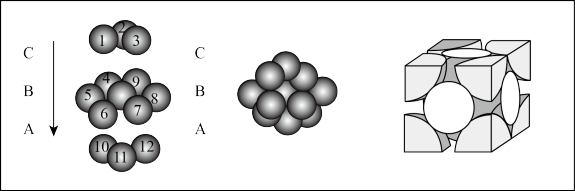
(3)铜晶体中铜原子的堆积方式如图所示,则晶体铜原子的堆积方式为_______ 。
(4)当黄铜受到氨腐蚀时,会生成四氨合铜络合物,出现“龟裂”现象。
①[Cu(NH3)4]2+中各元素电负性由大到小的顺序为_____ ,其中N原子的杂化轨道类型为_____ 。
②[Cu(NH3)4]2+中NH3的键角比独立存在的NH3分子结构中的键角_______ (填“大”或“小”)。
③1mol[Cu(NH3)4]2+中存在_______ 个σ键(用阿伏加德罗常数的数值用NA表示)。
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(白球代表铜原子)。
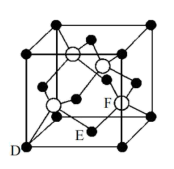
①该晶体的化学式为_______ 。
②已知该晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_______ pm(写出计算式)。
(1)基态Cu原子的价电子排布式为
(2)已知:高温下Cu2O比CuO稳定。从核外电子排布角度解释高温下Cu2O更稳定的原因为
(3)铜晶体中铜原子的堆积方式如图所示,则晶体铜原子的堆积方式为

(4)当黄铜受到氨腐蚀时,会生成四氨合铜络合物,出现“龟裂”现象。
①[Cu(NH3)4]2+中各元素电负性由大到小的顺序为
②[Cu(NH3)4]2+中NH3的键角比独立存在的NH3分子结构中的键角
③1mol[Cu(NH3)4]2+中存在
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(白球代表铜原子)。

①该晶体的化学式为
②已知该晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】金属陶瓷是一种复合材料,兼有金属和陶瓷的优点,应用非常广泛,金属基体可为 ,
, ,
, ,陶瓷基体为碳化硅等.回答下列问题:
,陶瓷基体为碳化硅等.回答下列问题:
(1) 位于元素周期表中第四周期
位于元素周期表中第四周期_______ 族, 与
与 的基态原子核外未成对电子数之比为
的基态原子核外未成对电子数之比为_______ 。
(2)与C相比, 原子之间难以形成双键的原因是
原子之间难以形成双键的原因是_______ 。
(3)已知 的一种晶体结构与
的一种晶体结构与 、
、 相似,则该
相似,则该 晶体的熔点比
晶体的熔点比 晶体的
晶体的_______ (填“高”、“低"),原因是_______ 。
(4)钴献菁可显著提升二次电池的充放电效率,为增强水溶性将其改性为四氨基钴酞菁,其结构如图所示:
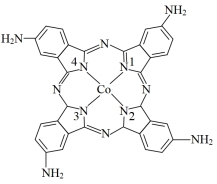
四氨基钴酞菁中与钴离子通过配位键结合的氮原子的编号是_______ ;水溶性得到有效改善的原因是_______ 。
(5) 的晶胞结构如图所示.晶胞参数为
的晶胞结构如图所示.晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,
, 晶体的密度为
晶体的密度为_______  .以晶胞参数为单位长度建立的坐标系,可以表示晶胞中各原子的位置,称作原子的分数坐标,若图中原子1的分数坐标为
.以晶胞参数为单位长度建立的坐标系,可以表示晶胞中各原子的位置,称作原子的分数坐标,若图中原子1的分数坐标为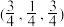 ,则原于2的分数坐标为
,则原于2的分数坐标为_______ 。
 ,
, ,
, ,陶瓷基体为碳化硅等.回答下列问题:
,陶瓷基体为碳化硅等.回答下列问题:(1)
 位于元素周期表中第四周期
位于元素周期表中第四周期 与
与 的基态原子核外未成对电子数之比为
的基态原子核外未成对电子数之比为(2)与C相比,
 原子之间难以形成双键的原因是
原子之间难以形成双键的原因是(3)已知
 的一种晶体结构与
的一种晶体结构与 、
、 相似,则该
相似,则该 晶体的熔点比
晶体的熔点比 晶体的
晶体的(4)钴献菁可显著提升二次电池的充放电效率,为增强水溶性将其改性为四氨基钴酞菁,其结构如图所示:

四氨基钴酞菁中与钴离子通过配位键结合的氮原子的编号是
(5)
 的晶胞结构如图所示.晶胞参数为
的晶胞结构如图所示.晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,
, 晶体的密度为
晶体的密度为 .以晶胞参数为单位长度建立的坐标系,可以表示晶胞中各原子的位置,称作原子的分数坐标,若图中原子1的分数坐标为
.以晶胞参数为单位长度建立的坐标系,可以表示晶胞中各原子的位置,称作原子的分数坐标,若图中原子1的分数坐标为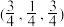 ,则原于2的分数坐标为
,则原于2的分数坐标为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】华为Mate 60 Pro手机于2023年8月底发售,它使用了高性能的国产芯片,体现了我国的芯片技术的飞速发展。
Ⅰ.硅在自然界中有三种稳定的核素,相关信息如下:
(1)硅元素的相对原子量为___________ (保留两位小数),12 g SiO2中29Si的质量为___________ (保留两位小数)。
(2)硅与碳化硅(SiC)均可以作为芯片的材料,比较硅与碳化硅的熔点高低,并说明理由___________ 。
(3)下列能说明碳的非金属大于硅的是___________。
Ⅱ.华为Mate 60 Pro手机利用石墨烯薄片液冷散热系统,是全球最强散热手机系统。石墨烯可以看成单层的石墨,它的结构如下:

(4)在石墨烯晶体中,碳原子所形成的六元环数、碳原子数、C-C键数之比为___________ 。
(5)下列关于石墨烯的说法错误的是___________。
Ⅲ.废弃的手机主板中可以提取出Au、Ag等贵金属。主板中的Ag用硝酸溶解后,过滤得到AgNO3溶液,加入NaCl溶液,过滤,向得到固体的加入氨水,得到无色溶液A,A用水合肼( )还原得到银单质,同时生成一种空气中常见的单质。
)还原得到银单质,同时生成一种空气中常见的单质。
已知:水合肼是一种二元弱碱,其电离常数为: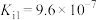 ,
, 。
。
(6)溶液A中含量最高的阳离子的化学式为___________ ,写出水合肼与溶液A反应的离子方程式___________ 。
(7)水合肼在工业上常用作还原剂,广泛用于纳米材料的制备,指出无机制备时水合肼作为还原剂的两个优点___________ 。
(8)写出水合肼一级电离的方程式___________ 。
(9)常温下,向水合肼溶液中加入盐酸,使溶液中的含氮微粒浓度: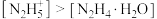 ,需调节的pH范围为
,需调节的pH范围为___________ 。
Ⅰ.硅在自然界中有三种稳定的核素,相关信息如下:
| 核素符号 | 相对原子量 | 丰度(%) |
| 28Si | 27.977 | 92.23 |
| 29Si | 28.976 | 4.67 |
| 30Si | 29.974 | 3.10 |
(2)硅与碳化硅(SiC)均可以作为芯片的材料,比较硅与碳化硅的熔点高低,并说明理由
(3)下列能说明碳的非金属大于硅的是___________。
| A.甲烷的分解温度高于SiH4 | B.碳与SiO2高温下置换出硅 |
| C.二氧化碳通入硅酸钠溶液得到白色沉淀 | D.CH4中氢为+1价,SiH4中氢为-1价 |
Ⅱ.华为Mate 60 Pro手机利用石墨烯薄片液冷散热系统,是全球最强散热手机系统。石墨烯可以看成单层的石墨,它的结构如下:

(4)在石墨烯晶体中,碳原子所形成的六元环数、碳原子数、C-C键数之比为
(5)下列关于石墨烯的说法错误的是___________。
| A.石墨烯是一种多烯烃 |
| B.石墨烯中碳原子与苯环中碳原子杂化类型相同 |
| C.石墨烯与金刚石互为同分异构体 |
| D.石墨烯只存在非极性键 |
Ⅲ.废弃的手机主板中可以提取出Au、Ag等贵金属。主板中的Ag用硝酸溶解后,过滤得到AgNO3溶液,加入NaCl溶液,过滤,向得到固体的加入氨水,得到无色溶液A,A用水合肼(
 )还原得到银单质,同时生成一种空气中常见的单质。
)还原得到银单质,同时生成一种空气中常见的单质。已知:水合肼是一种二元弱碱,其电离常数为:
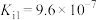 ,
, 。
。(6)溶液A中含量最高的阳离子的化学式为
(7)水合肼在工业上常用作还原剂,广泛用于纳米材料的制备,指出无机制备时水合肼作为还原剂的两个优点
(8)写出水合肼一级电离的方程式
(9)常温下,向水合肼溶液中加入盐酸,使溶液中的含氮微粒浓度:
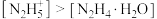 ,需调节的pH范围为
,需调节的pH范围为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】硼是第ⅢA族唯一的非金属元素,是农作物生长必需的微量营养元素。硼的单质及化合物都有重要用途。
回答下列问题:
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别是_______ 、_______ (填标号)。
A. B.
B.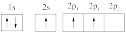
C.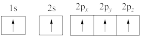 D.
D.
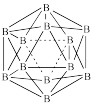
(2)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图所示),若其中有两个原子为 ,其余为
,其余为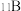 ,则该结构单元有
,则该结构单元有_______ 种不同的结构类型。
(3)氨硼烷(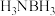 )含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
①在第二周期中,第一电离能介于B和N之间的有_______ 种元素。
②原子个数和价电子数目均相等的微粒互称为等电子体。则与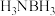 电子数也相等的等电子体分子是
电子数也相等的等电子体分子是_______ (写分子式)。
(4)硼酸是一元弱酸,但 本身不能电离,只能通过结合来自水中的
本身不能电离,只能通过结合来自水中的 而释放出
而释放出 ,则在水溶液中
,则在水溶液中 的电离方程式为
的电离方程式为_______ 。
(5)硼与第ⅤA族元素组成的化合物氮化硼(BN)、磷化硼(BP)、砷化硼(BAs)的晶体结构与单晶硅相似,其中氮化硼(BN)和磷化硼(BP)是受到高度关注的耐磨涂料,砷化硼(BAs)是一种超高热导率半导体材料。
①氮化硼晶体的熔点要比磷化硼晶体高,其原因是_______ 。
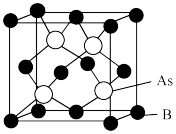
②砷化硼(BAs)的晶胞结构如下图所示,已知阿伏加德罗常数的值为 ,若晶胞中B原子到As原子最近距离为a pm,则该晶体的密度ρ=
,若晶胞中B原子到As原子最近距离为a pm,则该晶体的密度ρ=_______  (列出含a、
(列出含a、 的计算式即可)。
的计算式即可)。
回答下列问题:
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别是
A.
 B.
B.
C.
 D.
D.
(2)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图所示),若其中有两个原子为
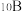 ,其余为
,其余为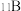 ,则该结构单元有
,则该结构单元有
(3)氨硼烷(
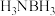 )含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。①在第二周期中,第一电离能介于B和N之间的有
②原子个数和价电子数目均相等的微粒互称为等电子体。则与
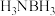 电子数也相等的等电子体分子是
电子数也相等的等电子体分子是(4)硼酸是一元弱酸,但
 本身不能电离,只能通过结合来自水中的
本身不能电离,只能通过结合来自水中的 而释放出
而释放出 ,则在水溶液中
,则在水溶液中 的电离方程式为
的电离方程式为(5)硼与第ⅤA族元素组成的化合物氮化硼(BN)、磷化硼(BP)、砷化硼(BAs)的晶体结构与单晶硅相似,其中氮化硼(BN)和磷化硼(BP)是受到高度关注的耐磨涂料,砷化硼(BAs)是一种超高热导率半导体材料。
①氮化硼晶体的熔点要比磷化硼晶体高,其原因是
②砷化硼(BAs)的晶胞结构如下图所示,已知阿伏加德罗常数的值为
 ,若晶胞中B原子到As原子最近距离为a pm,则该晶体的密度ρ=
,若晶胞中B原子到As原子最近距离为a pm,则该晶体的密度ρ= (列出含a、
(列出含a、 的计算式即可)。
的计算式即可)。
您最近一年使用:0次





