废旧锂离子电池经处理得到的正极活性粉体中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 等,采用以下工艺流程可从废旧锂离子电池中分离回收钻、镍、锰,制备正极材料的前驱体(
等,采用以下工艺流程可从废旧锂离子电池中分离回收钻、镍、锰,制备正极材料的前驱体( )。
)。

回答下列问题:
(1)“酸浸”温度为85℃,“酸浸”过程中温度不能过高的原因可能是_______ ;粉体中的钴(以 形式存在)发生反应的化学方程式为
形式存在)发生反应的化学方程式为_______ ;浸渣为_______ (填化学式)。
(2)“除铁”时需将溶液的pH调至3左右,加入的化合物X是_______ (填化学式)。
(3)“除铜”时获得萃余液的操作名称是_______ 。
(4)“除铝”时反应的离子方程式为_______ 。萃余液中 为
为 ,通过计算说明,常温下“除铝”控制溶液pH为4.5,是否造成
,通过计算说明,常温下“除铝”控制溶液pH为4.5,是否造成 的损失?
的损失?_______ (列出算式并给出结论)。已知: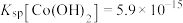 。
。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 等,采用以下工艺流程可从废旧锂离子电池中分离回收钻、镍、锰,制备正极材料的前驱体(
等,采用以下工艺流程可从废旧锂离子电池中分离回收钻、镍、锰,制备正极材料的前驱体( )。
)。
回答下列问题:
(1)“酸浸”温度为85℃,“酸浸”过程中温度不能过高的原因可能是
 形式存在)发生反应的化学方程式为
形式存在)发生反应的化学方程式为(2)“除铁”时需将溶液的pH调至3左右,加入的化合物X是
(3)“除铜”时获得萃余液的操作名称是
(4)“除铝”时反应的离子方程式为
 为
为 ,通过计算说明,常温下“除铝”控制溶液pH为4.5,是否造成
,通过计算说明,常温下“除铝”控制溶液pH为4.5,是否造成 的损失?
的损失?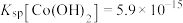 。
。
2023高三·全国·专题练习 查看更多[2]
更新时间:2023-02-19 11:27:59
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】Ⅰ.(1)按要求写出方程式:硫酸铁和氢氧化钡溶液反应(离子方程式)________ 。
(2)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O
①该反应中氧化剂是_______ (用化学式表示,下同),______ 元素被氧化,氧化产物为______ 。
②用单线桥在方程式中标出电子转移的情况:___________ 。
③当反应中有1 mol Na2FeO4生成,转移的电子有________ mol。
Ⅱ.(1)在KIO3+5KI+3H2SO4 = 3I2+3K2SO4+3H2O中,氧化产物与还原产物的物质的量之比:_______ 。
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2 ,完成下列化学方程式(横线上填系数,括号内填物质):___ KMnO4+____ K2S+______ =___ K2MnO4+___ K2SO4+___ S↓+______ H2O 。
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为__________ L。
(2)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O
①该反应中氧化剂是
②用单线桥在方程式中标出电子转移的情况:
③当反应中有1 mol Na2FeO4生成,转移的电子有
Ⅱ.(1)在KIO3+5KI+3H2SO4 = 3I2+3K2SO4+3H2O中,氧化产物与还原产物的物质的量之比:
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2 ,完成下列化学方程式(横线上填系数,括号内填物质):
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究。
[查阅资料]
i.NaN3受撞击会生成Na、N2。
ii.NaN3遇盐酸、H2SO4溶液无气体生成。
iii.叠氮化钠(NaN3)的一种生产工艺流程如下:

[问题探究]
(1)汽车受撞击后,30毫秒内引发NaN3迅速分解,该反应的化学方程式为_______ ;
(2)①反应器(Ⅰ)发生反应的基本反应类型为_______ ;液态氨需过量,其原因是________ 。
②反应器(Ⅱ)中反应的化学方程式为_______ 。
(3)工业级NaN3中常含有少量的Na2CO3,其原因是_______ (用化学方程式表示)。
[查阅资料]
i.NaN3受撞击会生成Na、N2。
ii.NaN3遇盐酸、H2SO4溶液无气体生成。
iii.叠氮化钠(NaN3)的一种生产工艺流程如下:

[问题探究]
(1)汽车受撞击后,30毫秒内引发NaN3迅速分解,该反应的化学方程式为
(2)①反应器(Ⅰ)发生反应的基本反应类型为
②反应器(Ⅱ)中反应的化学方程式为
(3)工业级NaN3中常含有少量的Na2CO3,其原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如图:

(1)“酸浸”时,提高浸出速率的具体措施有_______ 、_______ 。(写出两个)
(2)“碱溶”的目的是_______ 。物质X的电子式为_______ 。该工艺设计中,过量X参与反应的离子方程式是:_______ 。
(3)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:_______ 。

(1)“酸浸”时,提高浸出速率的具体措施有
(2)“碱溶”的目的是
(3)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】金属及其化合物在人类生活、生产中发挥着重要作用.印刷电路板由高分子材料和铜箔复合而成,刻制印刷电路时,工业上常用FeCl3溶液作为“腐蚀液”,有CuCl2和FeCl2生成.如图是某工程师为了从使用过的腐蚀废液中回收铜、并重新获得FeCl3溶液所采用的工艺流程图:

请回答下列问题:
(1)实验室中检验溶液中存在Fe3+的试剂是________ ,证明Fe3+存在的现象是_________ ;
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:__________ ;
(3)写出上述流程图中加入或生成的有关物质的化学式:①_________ ,②________ ,④_________ ;
(4)含有②的滤液与⑤反应的化学方程式为__________ ;
(5)如向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是_________ 。
A.有铜单质剩余但无铁单质剩余
B.有铁单质剩余但无铜单质剩余
C.铁、铜单质都有剩余
D.铁、铜单质都无剩余

请回答下列问题:
(1)实验室中检验溶液中存在Fe3+的试剂是
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:
(3)写出上述流程图中加入或生成的有关物质的化学式:①
(4)含有②的滤液与⑤反应的化学方程式为
(5)如向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.有铜单质剩余但无铁单质剩余
B.有铁单质剩余但无铜单质剩余
C.铁、铜单质都有剩余
D.铁、铜单质都无剩余
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如图:
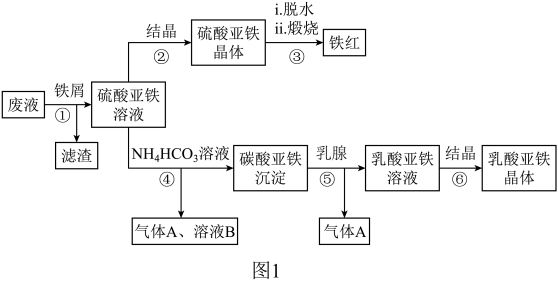
已知:乳酸可以和碳酸根生成二氧化碳气体。请回答:
(1)步骤④需控制反应温度低于35℃,其目的是___ 。
(2)步骤④反应的离子方程式是___ 。
(3)已知:FeCO3(s) ⇌Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因___ 。
(4)Fe3+对H2O2的分解具有催化作用。利用如图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的___ (填“深”或“浅”),其原因是___ 。


已知:乳酸可以和碳酸根生成二氧化碳气体。请回答:
(1)步骤④需控制反应温度低于35℃,其目的是
(2)步骤④反应的离子方程式是
(3)已知:FeCO3(s) ⇌Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因
(4)Fe3+对H2O2的分解具有催化作用。利用如图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】硫化铋在光电、催化及储能方面有着广泛应用,还可用作新型锂离子电池的电极材料。以浮选过的辉铋矿(主要成分是Bi2S3,还含少量Fe2O3、SiO2等杂质)为原料制备高纯 Bi2S3的工艺流程如下:

已知:铋单质不溶于盐酸,可溶于硝酸,BiCl3极易水解生成BiOCl沉淀。
回答下列问题:
(1)为了提高“浸出”的速率和效率,可以采取的措施有:___________ (请写出2条合理的措施)。
(2)滤渣1的主要成分是S和___________ 。“浸出”时加入盐酸,既可提高铋的浸出率,又可___________ ;
(3)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,写出Bi2S3与FeCl3溶液反应的离子方程式:___________ 。
(4)“还原”过程中过量的铁粉可用___________ 除去。
(5)如把铋粉空气氧化后“酸溶”改为直接用浓硝酸氧化铋粉,不足之处是___________ 。
(6)已知辉铋矿在转化过程中铋元素有10%的损耗,一吨某种辉铋矿可以制得高纯 Bi2S3的771kg,则该辉铋矿中铋元素的质量分数为___________ 。

已知:铋单质不溶于盐酸,可溶于硝酸,BiCl3极易水解生成BiOCl沉淀。
回答下列问题:
(1)为了提高“浸出”的速率和效率,可以采取的措施有:
(2)滤渣1的主要成分是S和
(3)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,写出Bi2S3与FeCl3溶液反应的离子方程式:
(4)“还原”过程中过量的铁粉可用
(5)如把铋粉空气氧化后“酸溶”改为直接用浓硝酸氧化铋粉,不足之处是
(6)已知辉铋矿在转化过程中铋元素有10%的损耗,一吨某种辉铋矿可以制得高纯 Bi2S3的771kg,则该辉铋矿中铋元素的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】盐湖卤水(主要含Na+、Mg2+、Li+、Cl-、 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如图:
的工艺流程如图:
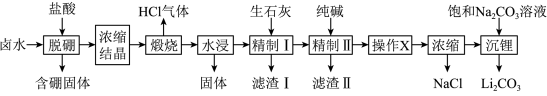
已知:常温下, 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。

回答下列问题:
(1)含硼固体中的B(OH)3在水中存在平衡: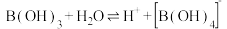 (常温下,
(常温下, );B(OH)3与
);B(OH)3与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中,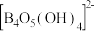 水解生成等物质的量浓度的B(OH)3和
水解生成等物质的量浓度的B(OH)3和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为___________ ,该溶液pH=___________ 。
(2)滤渣Ⅰ的主要成分是___________ (填化学式);精制Ⅰ后溶液中Li+浓度为 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在___________  以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加
以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加___________ 的用量(填化学式)。
(3)精制Ⅱ的目的是___________ ;进行操作X时应选择的试剂是___________ 。
 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如图:
的工艺流程如图:
已知:常温下,
 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。 
回答下列问题:
(1)含硼固体中的B(OH)3在水中存在平衡:
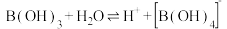 (常温下,
(常温下, );B(OH)3与
);B(OH)3与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中,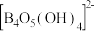 水解生成等物质的量浓度的B(OH)3和
水解生成等物质的量浓度的B(OH)3和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为(2)滤渣Ⅰ的主要成分是
 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在 以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加
以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加(3)精制Ⅱ的目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】某以硼镁石[主要含MgB3O3(OH)5,还含少量Fe2O3、Al2O3]为原料制Mg(OH)2·4MgCO3·5H2O的工艺流程如下:___________ 。
(2)(NH4)2SO4焙烧分解得到NH3、H2O、SO2和N2四种物质,其中SO2和N2的体积比为___________ 。
(3)B2O3易溶于水,溶于水后生成硼酸H3BO3,硼酸在冷水中溶解度小,溶于水的硼酸可发生电离: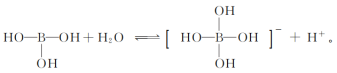 ,硼酸属于
,硼酸属于___________ 元酸。
(4)用氨水调pH的目的是沉淀Fe3+和Al3+,已知实验条件下,部分金属离子开始沉淀的pH和对应氢氧化物的Ksp如下表所示;溶液中金属离子浓度<1×10-5 mol·L-1,可以认为沉淀完全。
Fe3+刚好完全沉淀时溶液的pH为___________ ,调pH除去Fe3+和Al3+需控制的范围是___________ 。
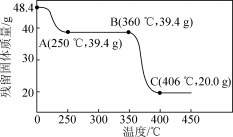
(5)取48.4 g Mg(OH)2·4MgCO3·5H2O加热分解,所得残留固体的质量与温度的关系如图所示。250℃时所得固体的成分为___________ 。
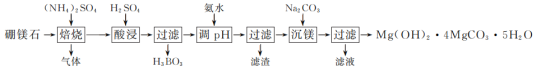
(2)(NH4)2SO4焙烧分解得到NH3、H2O、SO2和N2四种物质,其中SO2和N2的体积比为
(3)B2O3易溶于水,溶于水后生成硼酸H3BO3,硼酸在冷水中溶解度小,溶于水的硼酸可发生电离:
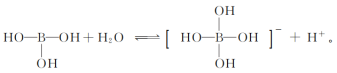 ,硼酸属于
,硼酸属于(4)用氨水调pH的目的是沉淀Fe3+和Al3+,已知实验条件下,部分金属离子开始沉淀的pH和对应氢氧化物的Ksp如下表所示;溶液中金属离子浓度<1×10-5 mol·L-1,可以认为沉淀完全。
| Mg2+ | Al3+ | Fe3+ | |
| 开始沉淀的pH | 8.6 | 3.7 | 2.2 |
| 氢氧化物的Ksp | 1×10-10.7 | 1×10-33 | 1×10-38 |
(5)取48.4 g Mg(OH)2·4MgCO3·5H2O加热分解,所得残留固体的质量与温度的关系如图所示。250℃时所得固体的成分为
您最近一年使用:0次
【推荐3】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:

(1)“550℃焙烧”的目的是_____________________________ 。
(2)“浸出液”的主要成分是__________________ 。
(3)“钴浸出”过程中Co3+转化为Co2+,该反应的离子方程式为_________________________ 。
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是__________________ 。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-6mol/L,则滤液中 c(Mg2+)为__________________ 。[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
(6)为测定制得样品的纯度,现称取1.000g样品,将其用适当试剂转化,得到草酸铵溶液,再用过量稀硫酸酸化,用0.1000mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液24.00mL,则草酸钴样品的纯度为___________ 。
(7)取一定质量的CoC2O4·2H2O分解后的钴氧化物(Co的化合价为+2、+3),用480ml 5mol/L 盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为___________ 。

(1)“550℃焙烧”的目的是
(2)“浸出液”的主要成分是
(3)“钴浸出”过程中Co3+转化为Co2+,该反应的离子方程式为
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-6mol/L,则滤液中 c(Mg2+)为
(6)为测定制得样品的纯度,现称取1.000g样品,将其用适当试剂转化,得到草酸铵溶液,再用过量稀硫酸酸化,用0.1000mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液24.00mL,则草酸钴样品的纯度为
(7)取一定质量的CoC2O4·2H2O分解后的钴氧化物(Co的化合价为+2、+3),用480ml 5mol/L 盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】工业以浓缩海水为原料提取溴的部分过程如图:
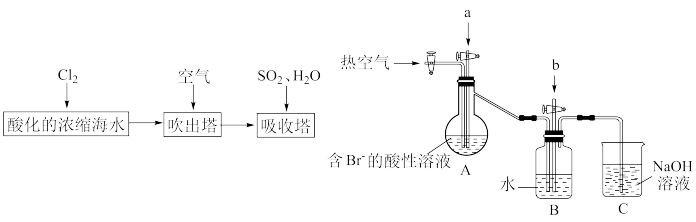
某课外小组在实验室模拟上述过程设计如图装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。
(1)实验开始时,A装置中不通热空气,先通入a气体的目的是(用离子方程式表示)____ 。
(2)A装置中通入a气体一段时间后,停止通入,改通热空气,通入热空气的目的是____ 。
(3)反应过程中,B装置中Br2与SO2反应的化学方程式为____ 。
(4)C装置的作用是____ 。
(5)为提取B装置中的溴元素进行如下实验:向反应后B装置的溶液中通入氯气,充分反应得到混合液。再加入苯,充分振荡、静置,待分层后,____ (将实验操作补充完整)。
(6)一定条件下,氯气和溴单质反应可制得BrCl。结合原子结构知识解释BrCl中Br呈正价的原因____ 。

某课外小组在实验室模拟上述过程设计如图装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。
(1)实验开始时,A装置中不通热空气,先通入a气体的目的是(用离子方程式表示)
(2)A装置中通入a气体一段时间后,停止通入,改通热空气,通入热空气的目的是
(3)反应过程中,B装置中Br2与SO2反应的化学方程式为
(4)C装置的作用是
(5)为提取B装置中的溴元素进行如下实验:向反应后B装置的溶液中通入氯气,充分反应得到混合液。再加入苯,充分振荡、静置,待分层后,
(6)一定条件下,氯气和溴单质反应可制得BrCl。结合原子结构知识解释BrCl中Br呈正价的原因
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】铟(In)是制造半导体、电光源等的重要原料,广泛用于航空航天、光电信息、太阳能电池等领域,从铜冶炼过程中产生的铟砷烟灰(主要成分为难溶于水的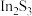 、
、 ,还含有ZnO、PbO、
,还含有ZnO、PbO、 、
、 等杂质)中提取锢的流程如下图所示
等杂质)中提取锢的流程如下图所示 价离子形式存在;
价离子形式存在;
②萃取剂可以用 表示,可在酸性溶液中萃取
表示,可在酸性溶液中萃取 价的金属离子
价的金属离子
回答下列问题:
(1)铟在元素周期表中的位置为___________ 。
(2)氧化酸浸过程中,硫元素被氧化为最高化合价,写出发生此转化反应的离子方程式:___________ 。
(3)还原铁步骤的目的是___________ 。
(4)实验室进行萃取操作时首先需要___________ ,萃取时若温度过高会使萃取剂挥发过快,造成的不利影响是___________ 。
(5)萃取过程中发生的主要反应为 ,则反萃取时需要加入的试剂为
,则反萃取时需要加入的试剂为___________ (填名称)。
(6)已知置换步骤会产生易燃易爆性气体单质,写出该步骤的化学方程式___________ ,置换后所得的粗铟需要洗涤,检验其已洗净的操作和现象为___________ 。
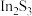 、
、 ,还含有ZnO、PbO、
,还含有ZnO、PbO、 、
、 等杂质)中提取锢的流程如下图所示
等杂质)中提取锢的流程如下图所示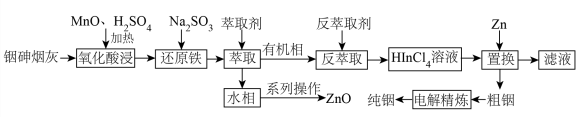
 价离子形式存在;
价离子形式存在;②萃取剂可以用
 表示,可在酸性溶液中萃取
表示,可在酸性溶液中萃取 价的金属离子
价的金属离子回答下列问题:
(1)铟在元素周期表中的位置为
(2)氧化酸浸过程中,硫元素被氧化为最高化合价,写出发生此转化反应的离子方程式:
(3)还原铁步骤的目的是
(4)实验室进行萃取操作时首先需要
(5)萃取过程中发生的主要反应为
 ,则反萃取时需要加入的试剂为
,则反萃取时需要加入的试剂为(6)已知置换步骤会产生易燃易爆性气体单质,写出该步骤的化学方程式
您最近一年使用:0次



