汽车尾气中含有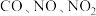 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:
①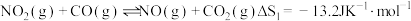
②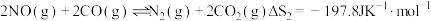
③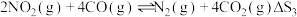
(1)已知 ,(忽略
,(忽略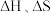 随温度的影响),则
随温度的影响),则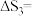
_________ 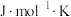 。
。
(2)反应①的平衡常数 的关系如图1:
的关系如图1:
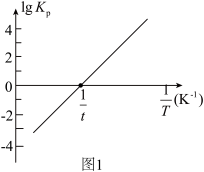
反应①为___________ (填“吸热”或“放热”)反应;温度为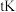 下,向恒容密闭容器中加入
下,向恒容密闭容器中加入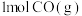 和
和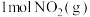 (若只发生反应①),测得起始压强为
(若只发生反应①),测得起始压强为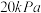 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为___________ ; 的分压为
的分压为___________  。
。
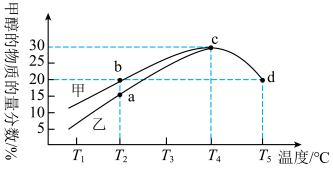
(3)向体积均为 的容器中加入
的容器中加入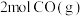 和
和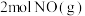 (若只发生反应②),其中甲为绝热恒容,乙为恒温恒容,两容器中压强随时间变化曲线如图2:
(若只发生反应②),其中甲为绝热恒容,乙为恒温恒容,两容器中压强随时间变化曲线如图2:
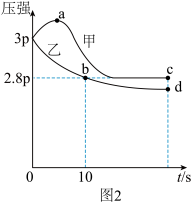
①甲容器中,开始压强增大的原因是___________
②c点的逆反应速率大于b点的逆反应速率的原因是___________
③c点对应的平衡常数___________ d点对应的平衡常数(填“大于”、“小于”或“等于”)。
 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:①
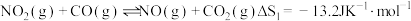
②
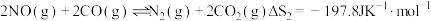
③
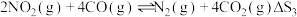
(1)已知
 ,(忽略
,(忽略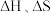 随温度的影响),则
随温度的影响),则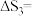
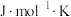 。
。(2)反应①的平衡常数
 的关系如图1:
的关系如图1:
反应①为
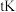 下,向恒容密闭容器中加入
下,向恒容密闭容器中加入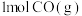 和
和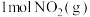 (若只发生反应①),测得起始压强为
(若只发生反应①),测得起始压强为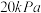 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为 的分压为
的分压为 。
。(3)向体积均为
 的容器中加入
的容器中加入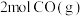 和
和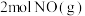 (若只发生反应②),其中甲为绝热恒容,乙为恒温恒容,两容器中压强随时间变化曲线如图2:
(若只发生反应②),其中甲为绝热恒容,乙为恒温恒容,两容器中压强随时间变化曲线如图2:
①甲容器中,开始压强增大的原因是
②c点的逆反应速率大于b点的逆反应速率的原因是
③c点对应的平衡常数
更新时间:2023-03-31 18:04:08
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】按要求作答:
(1)FeCl3水溶液呈酸性,原因是(用离子方程式表示):___________________ ,实验室配制FeCl3溶液的方法是__________________________ 。
(2)泡沫灭火剂中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂,写出使用时发生反应的离子方程式____________________________
(3)写出难溶电解质的溶度积表达式,Mg(OH)2:____________ ;在Mg(OH)2悬浊液中加入MgCl2固体,平衡________ 移动(填“正向”“逆向”或“不”),Ksp________ (填“增大”“减小”或“不变”)。
(4)1 g炭与水蒸气反应生成CO和H2,需吸收a kJ热量,此反应的热化学方程式为______________________________________________ 。
(5)火箭发射时可用肼(N2H4)为燃料,以二氧化氮做氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)===2NO2(g),ΔH=+67.7 kJ·mol-1;N2H4(g)+O2(g)===N2(g)+2H2O(g),ΔH=-534 kJ·mol-1,则N2H4和NO2反应的热化学方程式___________ 。
(1)FeCl3水溶液呈酸性,原因是(用离子方程式表示):
(2)泡沫灭火剂中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂,写出使用时发生反应的离子方程式
(3)写出难溶电解质的溶度积表达式,Mg(OH)2:
(4)1 g炭与水蒸气反应生成CO和H2,需吸收a kJ热量,此反应的热化学方程式为
(5)火箭发射时可用肼(N2H4)为燃料,以二氧化氮做氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)===2NO2(g),ΔH=+67.7 kJ·mol-1;N2H4(g)+O2(g)===N2(g)+2H2O(g),ΔH=-534 kJ·mol-1,则N2H4和NO2反应的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】减少 的排放量以及利用
的排放量以及利用 与
与 的反应合成新能源是实现世界气候峰会目标的有效途径。
的反应合成新能源是实现世界气候峰会目标的有效途径。
已知:①
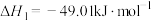
②
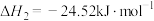
③
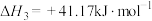
(1)

___________ 
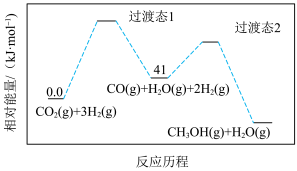
(2)一定条件下, 的反应历程如下图所示。该反应的反应速率由第
的反应历程如下图所示。该反应的反应速率由第___________ (填“1”或“2”)步决定。
(3)向2L恒容密闭容器中充入 和
和 ,在一定条件下,仅发生上述反应①;在甲、乙两种不同催化剂的作用下,反应时间均为
,在一定条件下,仅发生上述反应①;在甲、乙两种不同催化剂的作用下,反应时间均为 时,测得甲醇的物质的量分数随温度的变化如下图所示。
时,测得甲醇的物质的量分数随温度的变化如下图所示。
①相同温度下,催化剂效果更好的是___________ (填“甲”或“乙”)。
② 和
和 下,平衡常数:
下,平衡常数:
___________ (填“>”、“<”或“=”) 。
。
③ 下,反应开始时容器中的总压为
下,反应开始时容器中的总压为 ,该温度下该反应达到平衡时甲醇的分压
,该温度下该反应达到平衡时甲醇的分压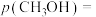
___________ Pa(平衡分压=总压×物质的量分数,只需列出计算式,不必化简)。
(4)已知 的选择性为
的选择性为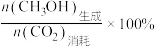 。其他条件相同时,反应温度对
。其他条件相同时,反应温度对 的转化率和
的转化率和 的选择性的影响分别如下图所示。
的选择性的影响分别如下图所示。
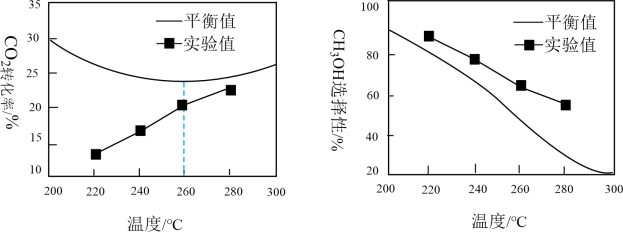
①由温度对 的转化率图可知,实验中反应均未达到化学平衡状态的依据是
的转化率图可知,实验中反应均未达到化学平衡状态的依据是___________ 。
②温度高于260℃时, 的平衡转化率呈上升变化的原因是
的平衡转化率呈上升变化的原因是___________ 。
③由图可知,温度相同时 选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是
选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是___________ 。
 的排放量以及利用
的排放量以及利用 与
与 的反应合成新能源是实现世界气候峰会目标的有效途径。
的反应合成新能源是实现世界气候峰会目标的有效途径。已知:①

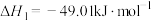
②

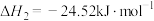
③

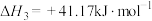
(1)



(2)一定条件下,
 的反应历程如下图所示。该反应的反应速率由第
的反应历程如下图所示。该反应的反应速率由第
(3)向2L恒容密闭容器中充入
 和
和 ,在一定条件下,仅发生上述反应①;在甲、乙两种不同催化剂的作用下,反应时间均为
,在一定条件下,仅发生上述反应①;在甲、乙两种不同催化剂的作用下,反应时间均为 时,测得甲醇的物质的量分数随温度的变化如下图所示。
时,测得甲醇的物质的量分数随温度的变化如下图所示。
①相同温度下,催化剂效果更好的是
②
 和
和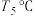 下,平衡常数:
下,平衡常数:
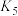 。
。③
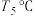 下,反应开始时容器中的总压为
下,反应开始时容器中的总压为 ,该温度下该反应达到平衡时甲醇的分压
,该温度下该反应达到平衡时甲醇的分压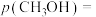
(4)已知
 的选择性为
的选择性为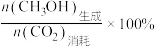 。其他条件相同时,反应温度对
。其他条件相同时,反应温度对 的转化率和
的转化率和 的选择性的影响分别如下图所示。
的选择性的影响分别如下图所示。
①由温度对
 的转化率图可知,实验中反应均未达到化学平衡状态的依据是
的转化率图可知,实验中反应均未达到化学平衡状态的依据是②温度高于260℃时,
 的平衡转化率呈上升变化的原因是
的平衡转化率呈上升变化的原因是③由图可知,温度相同时
 选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是
选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】含碳化合物对环境、生产和人类生命活动具有很大影响。回答下列问题:
(1)治理汽车尾气污染对保护环境至关重要。
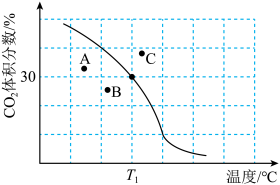
①汽车尾气中含有大量CO和NO等大气污染物,反应为:2NO(g) +2C0(g) N2(g) +2CO2(g),其他条件不变时,NO平衡转化率随温度变化的曲线如下图:
N2(g) +2CO2(g),其他条件不变时,NO平衡转化率随温度变化的曲线如下图:
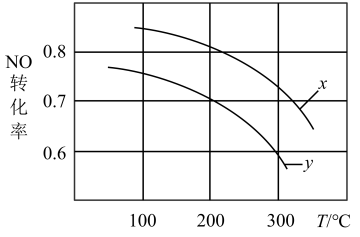
由图象知:∆H_________ 0(填“>"或“<");图中曲线x变为y时,对压强的改变为______ (填“加压"或“减压")。
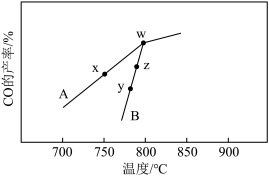
②在催化剂存在时,也可用CH4还原氮氧化合物使其生成无毒气体,改善汽车尾气对环境的影响。

对于反应a加入催化剂,可使Eal_____ (填“ 增大”“减小”或“不变”);相同条件下,反应b比反应a_____ ( 填“易”或“难" )发生,理由是________________ ;反应CH4(g) +2NO2(g)=N2(g)+2H2O(g) +CO2(g) ∆H=______ kJ·mol -1(用含∆H1、∆H2的代数表示)。
(2)碳资源化处理对于缓解能源危机有重要意义。对于反应:CO(g) +2H2(g)→CH3OH ∆H<0,在催化剂作用下,分别在T1°C和T2°C时(T1 >T2),向容积为2 L的密闭容器内加入4mol的CO和8molH2,随反应进行CH3OH的物质的量的变化情况如下图:

①比较ab点反应速率大小:va_____ vb,(填“大于”“小于”或“等于”)。
②T2时,前4 min内用H2表示的反应速率v(H2)为_____ ,T1时,反应的化学平衡常数K=__________ 。
③已知:反应速率v=v正-v逆= k正x(CO)x2(H2) -k逆x(CH3OH),k正和k逆分别为正、逆反应速率常数,x为物质的量分数,计算a点v正:v逆=_______ ( 保留两位有效数字)。
④若容器容积不变,下列措施可增加甲醇产率的是______ (填字母标号)。
A.按相同比例再向容器中充人原料气体 B. 将生成的CH3OH从体系中分离
C.选用高效催化剂 D.充入He,使体系的总压增大
(1)治理汽车尾气污染对保护环境至关重要。
①汽车尾气中含有大量CO和NO等大气污染物,反应为:2NO(g) +2C0(g)
 N2(g) +2CO2(g),其他条件不变时,NO平衡转化率随温度变化的曲线如下图:
N2(g) +2CO2(g),其他条件不变时,NO平衡转化率随温度变化的曲线如下图:
由图象知:∆H
②在催化剂存在时,也可用CH4还原氮氧化合物使其生成无毒气体,改善汽车尾气对环境的影响。

对于反应a加入催化剂,可使Eal
(2)碳资源化处理对于缓解能源危机有重要意义。对于反应:CO(g) +2H2(g)→CH3OH ∆H<0,在催化剂作用下,分别在T1°C和T2°C时(T1 >T2),向容积为2 L的密闭容器内加入4mol的CO和8molH2,随反应进行CH3OH的物质的量的变化情况如下图:

①比较ab点反应速率大小:va
②T2时,前4 min内用H2表示的反应速率v(H2)为
③已知:反应速率v=v正-v逆= k正x(CO)x2(H2) -k逆x(CH3OH),k正和k逆分别为正、逆反应速率常数,x为物质的量分数,计算a点v正:v逆=
④若容器容积不变,下列措施可增加甲醇产率的是
A.按相同比例再向容器中充人原料气体 B. 将生成的CH3OH从体系中分离
C.选用高效催化剂 D.充入He,使体系的总压增大
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】将氯化氢转化为氯气的技术是当前科学研究的热点。回答下列问题:
(1)1868年Deacon发明的用氯化铜做催化剂直接氧化法(地康法制氯气)为:4HClg)+O2(g) 2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应ΔH_______ 0(填“大于”或“小于”)。设HCl初始浓度度为c0,根据进料浓度比c(HCl):c(O2)=1:1的数据计算K(400℃)=_______ (列出计算式)。按化学技量比进料可以保持反应物高转化率,同时降低产物分离的能料。进料浓度比c(HCl):c(O2)过低、过高的不利影响分别是_______ 、_______ 。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=83kJ/mol
Cl2(g) ΔH1=83kJ/mol
CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20kJ/mol
Cl2(g) ΔH2=-20kJ/mol
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121kJ/mol
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_______ 。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是_______ 、_______ 。(写出2种)
(1)1868年Deacon发明的用氯化铜做催化剂直接氧化法(地康法制氯气)为:4HClg)+O2(g)
 2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
可知反应ΔH
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=83kJ/mol
Cl2(g) ΔH1=83kJ/molCuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20kJ/mol
Cl2(g) ΔH2=-20kJ/molCuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121kJ/mol
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】 催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: 。回答下列问题:
。回答下列问题:
(1)已知相关物质的燃烧热 :
:
则 催化重整反应的
催化重整反应的
___________  。
。
(2)在体积为 的恒容密闭容器中分别通入
的恒容密闭容器中分别通入 和
和 ,发生反应:
,发生反应: 。
。
①该反应的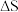
___________ 0(填“>”“<”或“=”),在(填“高温”或“低温”)条件下能自发进行。
②下列情况,能判断该反应达到平衡状态的是___________ (填字母)。
A.反应体系的密度保持不变 B.混合气体的平均摩尔质量不变
C. 和
和 的物质的量之比不变 D.混合气体中
的物质的量之比不变 D.混合气体中 的体积分数不变
的体积分数不变
(3)将原料按初始组成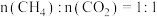 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应,达到平衡时
发生反应,达到平衡时 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
① 下,
下, (平衡时气体)
(平衡时气体) (初始气体)=
(初始气体)=___________ ;该温度下,此反应的平衡常数
___________  (以分压表示,列出计算式)。
(以分压表示,列出计算式)。
②若 三点表示不同温度和压强下已达平衡时
三点表示不同温度和压强下已达平衡时 的体积分数,
的体积分数,___________ 点对应的平衡常数最小,理由是___________ 。
(4)其它条件相同,在不同催化剂 作用下,反应
作用下,反应 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图:
的产率随反应温度的变化如图:
在催化剂 作用下,它们正、逆反应活化能差值分别用
作用下,它们正、逆反应活化能差值分别用 表示,则
表示,则
___________ 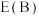 (填“>”、“<”或“=”下同)。
(填“>”、“<”或“=”下同)。
(5) 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
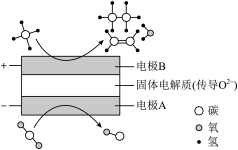
①阴极上的反应式为___________ 。
②若生成的乙烯和乙烷的体积比为3∶1,则消耗的 和
和 的体积比为
的体积比为___________ 。
 催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: 。回答下列问题:
。回答下列问题:(1)已知相关物质的燃烧热
 :
:| 物质 |  |  |  |
燃烧热 |  |  |  |
 催化重整反应的
催化重整反应的
 。
。(2)在体积为
 的恒容密闭容器中分别通入
的恒容密闭容器中分别通入 和
和 ,发生反应:
,发生反应: 。
。①该反应的
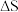
②下列情况,能判断该反应达到平衡状态的是
A.反应体系的密度保持不变 B.混合气体的平均摩尔质量不变
C.
 和
和 的物质的量之比不变 D.混合气体中
的物质的量之比不变 D.混合气体中 的体积分数不变
的体积分数不变(3)将原料按初始组成
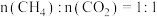 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应,达到平衡时
发生反应,达到平衡时 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
①
 下,
下, (平衡时气体)
(平衡时气体) (初始气体)=
(初始气体)=
 (以分压表示,列出计算式)。
(以分压表示,列出计算式)。②若
 三点表示不同温度和压强下已达平衡时
三点表示不同温度和压强下已达平衡时 的体积分数,
的体积分数,(4)其它条件相同,在不同催化剂
 作用下,反应
作用下,反应 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图:
的产率随反应温度的变化如图:
在催化剂
 作用下,它们正、逆反应活化能差值分别用
作用下,它们正、逆反应活化能差值分别用 表示,则
表示,则
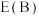 (填“>”、“<”或“=”下同)。
(填“>”、“<”或“=”下同)。(5)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
①阴极上的反应式为
②若生成的乙烯和乙烷的体积比为3∶1,则消耗的
 和
和 的体积比为
的体积比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO2催化还原为CH3OH。已知CO2催化加氢的主要反应有:
(i)CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H1 K1
CH3OH(g)+H2O(g) ∆H1 K1
(ii)CO2(g)+H2(g) CO(g)+H2O(g) ∆H2 K2
CO(g)+H2O(g) ∆H2 K2
(1)一定温度下,向aL密闭容器中充入1molCO2和4molH2,发生上述两个反应。当反应达平衡后容器内CH3OH(g)为0.3mol,CO2(g)为0.6mol,则H2的平衡转化率为_______ ,反应i的平衡常数K1=_______ (列出计算式即可)。
(2)在恒温恒压反应器中通入3molH2、1molCO2气体,CO2的平衡转化率及CH3OH的平衡产率随温度变化关系如图a。反应(i)和反应(ii)的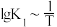 、
、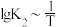 均满足线性关系,如图b所示。已知:CH3OH的产率=
均满足线性关系,如图b所示。已知:CH3OH的产率= ×100%。
×100%。
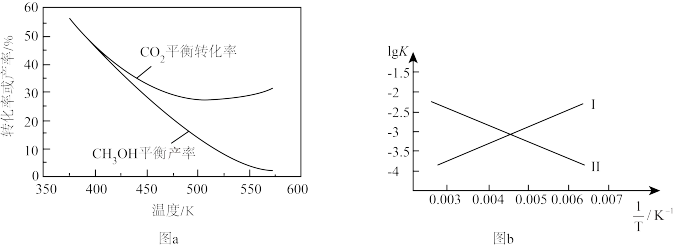
①反应过程中,若气体密度维持不变,则能判断_______ 达到平衡。
a.反应(i) b.反应(ii) c.反应(i)和(ii) d.不能说明反应( i)或(ii)
②反应(ii) 的∆H2_______ 0 (填“大于”或“小于”或“等于"),判断的理由是_______ 。
③根据图b,确定直线I表示的反应是_______ [填 “反应(i)”或“反应(ii)”]
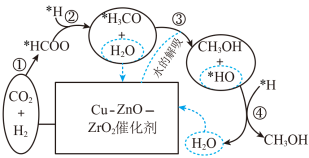
(3)我国科研人员研究出在Cu-ZnO-ZrO2催化剂上CO2氢化合成甲醇的反应历程如图所示。结合历程分析在反应气中加入少量的水蒸气_______ (填“可以”或“不可以")提高甲醇产率,其可能的原因为_______ 。
(i)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H1 K1
CH3OH(g)+H2O(g) ∆H1 K1(ii)CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2 K2
CO(g)+H2O(g) ∆H2 K2(1)一定温度下,向aL密闭容器中充入1molCO2和4molH2,发生上述两个反应。当反应达平衡后容器内CH3OH(g)为0.3mol,CO2(g)为0.6mol,则H2的平衡转化率为
(2)在恒温恒压反应器中通入3molH2、1molCO2气体,CO2的平衡转化率及CH3OH的平衡产率随温度变化关系如图a。反应(i)和反应(ii)的
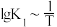 、
、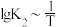 均满足线性关系,如图b所示。已知:CH3OH的产率=
均满足线性关系,如图b所示。已知:CH3OH的产率= ×100%。
×100%。
①反应过程中,若气体密度维持不变,则能判断
a.反应(i) b.反应(ii) c.反应(i)和(ii) d.不能说明反应( i)或(ii)
②反应(ii) 的∆H2
③根据图b,确定直线I表示的反应是
(3)我国科研人员研究出在Cu-ZnO-ZrO2催化剂上CO2氢化合成甲醇的反应历程如图所示。结合历程分析在反应气中加入少量的水蒸气

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】在一恒容密闭容器中,发生反应:CO2(g) +H2(g) CO(g) +H2O(g) △H。其平衡常数(K)和温度(T)的关系如下表:
CO(g) +H2O(g) △H。其平衡常数(K)和温度(T)的关系如下表:
试回答下列问题:
(1)该反应的平衡常数表达式为K=___________ 。
(2)上述反应为_______ (填“放热”成“吸热”反应,升高温度,平衡向______ (填“正反应”或“逆反应”)方向移动。
(3)800℃时,向恒容密用容器中加入混合物,起始浓度分别为c(CO)=0.01mol/L、c(H2O)=0.03 mol/L、c(CO2)=0.1mol/L、c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率____ (填“ >”"<"或"=")生成速率。
(4)某温度下,在体积为2L的恒容密闭容器中通入2molCO2(g)和4molH2(g)发生上述反应,5min时反应达到平衡,测得CO2(g)的转化率是75%。
①v(H2O)=_____ mol/(L·min)
②该温度下反应的平衡常数K=________ 。
(5)可逆反应: CO2(g) +H2(g)⇌CO(g) +H2O(g) 的化学反应速率(v)与时间(t)的关系如图所示,在图中t2时只改变一个条件,则改变的条件是_________ 。

(6)生产水煤气的过程如下:
①C(s) +CO2(g)⇌2CO(g) △H1
②C(s) + H2O(g)⇌CO(g) +H2(g) △H2
反应CO2(g) +H2(g)⇌CO(g) +H2O(g) △H=_______ (用含△H1、△H2的代数式表示)。
 CO(g) +H2O(g) △H。其平衡常数(K)和温度(T)的关系如下表:
CO(g) +H2O(g) △H。其平衡常数(K)和温度(T)的关系如下表:| T/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的平衡常数表达式为K=
(2)上述反应为
(3)800℃时,向恒容密用容器中加入混合物,起始浓度分别为c(CO)=0.01mol/L、c(H2O)=0.03 mol/L、c(CO2)=0.1mol/L、c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率
(4)某温度下,在体积为2L的恒容密闭容器中通入2molCO2(g)和4molH2(g)发生上述反应,5min时反应达到平衡,测得CO2(g)的转化率是75%。
①v(H2O)=
②该温度下反应的平衡常数K=
(5)可逆反应: CO2(g) +H2(g)⇌CO(g) +H2O(g) 的化学反应速率(v)与时间(t)的关系如图所示,在图中t2时只改变一个条件,则改变的条件是

(6)生产水煤气的过程如下:
①C(s) +CO2(g)⇌2CO(g) △H1
②C(s) + H2O(g)⇌CO(g) +H2(g) △H2
反应CO2(g) +H2(g)⇌CO(g) +H2O(g) △H=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】将 ,气体充入
,气体充入 固定容积的密闭容器中发生如下反应:
固定容积的密闭容器中发生如下反应: 。在
。在 和
和 时,测得
时,测得 的物质的量随时间的变化如图1所示:
的物质的量随时间的变化如图1所示:

(1) 时,
时, 内用
内用 表示该反应的平均反应速率为
表示该反应的平均反应速率为_______________  。
。
(2)
_______________ (填“>”“<”或“=”)0。
(3)改变条件重新达到平衡时,要使 的值变小,可采取的措施有
的值变小,可采取的措施有_____________ (填序号)。
a.增大 的起始浓度 b.升高温度
的起始浓度 b.升高温度
c.向混合气体中通入 d.使用高效催化剂
d.使用高效催化剂
(4)在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化的曲线如图所示。下列说法正确的是
的体积分数随压强变化的曲线如图所示。下列说法正确的是_____________ (填序号)。
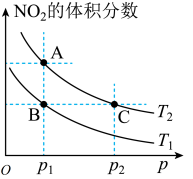
a.A、C两点的反应速率:
b.A、B两点 的转化率:
的转化率:
c.由A点到B点,可以采用加热的方法
 ,气体充入
,气体充入 固定容积的密闭容器中发生如下反应:
固定容积的密闭容器中发生如下反应: 。在
。在 和
和 时,测得
时,测得 的物质的量随时间的变化如图1所示:
的物质的量随时间的变化如图1所示:
(1)
 时,
时, 内用
内用 表示该反应的平均反应速率为
表示该反应的平均反应速率为 。
。(2)

(3)改变条件重新达到平衡时,要使
 的值变小,可采取的措施有
的值变小,可采取的措施有a.增大
 的起始浓度 b.升高温度
的起始浓度 b.升高温度c.向混合气体中通入
 d.使用高效催化剂
d.使用高效催化剂(4)在温度为
 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化的曲线如图所示。下列说法正确的是
的体积分数随压强变化的曲线如图所示。下列说法正确的是
a.A、C两点的反应速率:

b.A、B两点
 的转化率:
的转化率:
c.由A点到B点,可以采用加热的方法
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】在2L密闭容器内,800℃时反应: 体系中,n(NO)随时间的变化如表:
体系中,n(NO)随时间的变化如表:
(1)已知:K300℃>K350℃,则该反应是___________ 热反应。
(2)下图中表示 的变化的曲线是
的变化的曲线是___________ 。

用 表示从0~2s内该反应的平均速率v=
表示从0~2s内该反应的平均速率v=___________ 。
(3)能说明该反应已达到平衡状态的是___________ 。
a. b.容器内压强保持不变
b.容器内压强保持不变
c. d.容器内密度保持不变
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是___________ 。
a.及时分离除 气体 b.适当升高温度
气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(5)已知某化学反应的平衡常数表达式为 ,在不同的温度下该反应的平衡常数值见下表,下列有关叙述错误的是
,在不同的温度下该反应的平衡常数值见下表,下列有关叙述错误的是___________ 。
a.该反应的化学方程式是:
b.该反应的正反应是放热反应
c.如果在一定体积的密闭容器中加入CO和 各
各 ,再把温度升高到
,再把温度升高到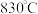 ,此时测得
,此时测得 为
为 时,这时可逆反应处于平衡状态。
时,这时可逆反应处于平衡状态。
d.若平衡浓度关系符合 ,可判断此时温度是
,可判断此时温度是
(6)某恒温密闭容器中,可逆反应 ,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是___________
a.产物B的状态只能为固态或液态
b.容器中气体的摩尔质量不再改变,说明反应已达平衡状态
c.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
d.若开始时向容器中加入1molB和1molC,达到平衡时放出热量
 体系中,n(NO)随时间的变化如表:
体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,则该反应是
(2)下图中表示
 的变化的曲线是
的变化的曲线是
用
 表示从0~2s内该反应的平均速率v=
表示从0~2s内该反应的平均速率v=(3)能说明该反应已达到平衡状态的是
a.
 b.容器内压强保持不变
b.容器内压强保持不变c.
 d.容器内密度保持不变
d.容器内密度保持不变(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除
 气体 b.适当升高温度
气体 b.适当升高温度c.增大O2的浓度 d.选择高效催化剂
(5)已知某化学反应的平衡常数表达式为
 ,在不同的温度下该反应的平衡常数值见下表,下列有关叙述错误的是
,在不同的温度下该反应的平衡常数值见下表,下列有关叙述错误的是| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
a.该反应的化学方程式是:

b.该反应的正反应是放热反应
c.如果在一定体积的密闭容器中加入CO和
 各
各 ,再把温度升高到
,再把温度升高到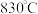 ,此时测得
,此时测得 为
为 时,这时可逆反应处于平衡状态。
时,这时可逆反应处于平衡状态。d.若平衡浓度关系符合
 ,可判断此时温度是
,可判断此时温度是
(6)某恒温密闭容器中,可逆反应
 ,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是a.产物B的状态只能为固态或液态
b.容器中气体的摩尔质量不再改变,说明反应已达平衡状态
c.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
d.若开始时向容器中加入1molB和1molC,达到平衡时放出热量

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g) CH3OH(g) △H1=-90.1kJ/mol;
CH3OH(g) △H1=-90.1kJ/mol;
3CH3OH(g) CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CO与H2合成CH3CH=CH2的热化学方程式为________ 。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2molH2,发生反应:CO(g)+2H2(g) CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
①5min时三个容器中的反应达到化学平衡状态的是容器_______ (填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______ 。
③当三个容器中的反应均达到平衡状态时,CO的转化率最高的是容器___________ 。(填序号,下同);平衡常数最小的是容器_____________ 。
(3)CO常用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中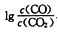 与温度(T)的关系如图2所示。下列说法正确的是
与温度(T)的关系如图2所示。下列说法正确的是_____ (填字母)。
a.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
b.CO用于工业冶炼金属铬(Cr)时,还原效率不高
c.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
d.CO还原PbO2的反应△H>0
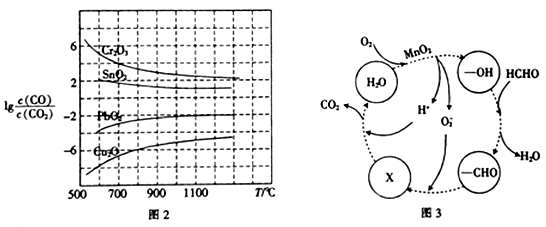
(4)工业废水中含有甲醛,该厂降解甲醛的反应机理如图3所示,则X表示的粒子是_____ ,总反应的化学方程式为_________ 。
(1)已知:CO(g)+2H2(g)
 CH3OH(g) △H1=-90.1kJ/mol;
CH3OH(g) △H1=-90.1kJ/mol;3CH3OH(g)
 CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol CO与H2合成CH3CH=CH2的热化学方程式为
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2molH2,发生反应:CO(g)+2H2(g)
 CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。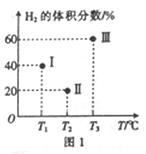
①5min时三个容器中的反应达到化学平衡状态的是容器
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=
③当三个容器中的反应均达到平衡状态时,CO的转化率最高的是容器
(3)CO常用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中
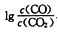 与温度(T)的关系如图2所示。下列说法正确的是
与温度(T)的关系如图2所示。下列说法正确的是
a.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
b.CO用于工业冶炼金属铬(Cr)时,还原效率不高
c.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
d.CO还原PbO2的反应△H>0
(4)工业废水中含有甲醛,该厂降解甲醛的反应机理如图3所示,则X表示的粒子是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】SO2和H2S是大气污染物,这两种气体的转化研究对资源综合利用和环境保护有重要意义。
Ⅰ.水煤气还原法,已知:①

②

(1)写出CO(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式___________ ;若该反应在恒温恒容体系中进行,则其达到平衡的标志___________ (填字母)。
A.单位时间内,生成nmolCO的同时生成nmolCO2
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D.CO2(g)与H2(g)的体积比保持不变
(2)在温度为T℃下,将1.4molH2和1molSO2通入2L恒容密闭容器中发生上述反应① ,反应体系中气体的总压强随时间变化如图所示。SO2的平衡转化率为
,反应体系中气体的总压强随时间变化如图所示。SO2的平衡转化率为___________ 。

(3)某密闭容器中发生上述反应② ,平衡时CO的体积分数(%)与压强和温度的关系如图所示。
,平衡时CO的体积分数(%)与压强和温度的关系如图所示。
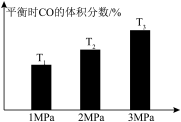
则T1、T2、T3由小到大的关系顺序是___________ ,判断的理由是___________ 。
Ⅱ.将等物质的量的A和B混合于2L的密闭容器中,发生如下反应: ,5min后测得
,5min后测得 ,
, ,C的反应速率是0.15mol·L-1·min-1。
,C的反应速率是0.15mol·L-1·min-1。
(4)x=___________ 。
(5)此时容器内的压强与开始时之比为___________ 。
Ⅰ.水煤气还原法,已知:①


②


(1)写出CO(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式
A.单位时间内,生成nmolCO的同时生成nmolCO2
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D.CO2(g)与H2(g)的体积比保持不变
(2)在温度为T℃下,将1.4molH2和1molSO2通入2L恒容密闭容器中发生上述反应①
 ,反应体系中气体的总压强随时间变化如图所示。SO2的平衡转化率为
,反应体系中气体的总压强随时间变化如图所示。SO2的平衡转化率为
(3)某密闭容器中发生上述反应②
 ,平衡时CO的体积分数(%)与压强和温度的关系如图所示。
,平衡时CO的体积分数(%)与压强和温度的关系如图所示。
则T1、T2、T3由小到大的关系顺序是
Ⅱ.将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:
 ,5min后测得
,5min后测得 ,
, ,C的反应速率是0.15mol·L-1·min-1。
,C的反应速率是0.15mol·L-1·min-1。(4)x=
(5)此时容器内的压强与开始时之比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇水气时发烟生成(HSiO)2O等,写出该反应的化学方程式___ 。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=48kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH=___ kJ·mol-1。
(3)对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
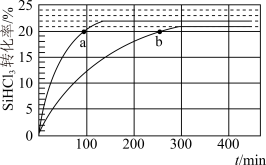
①343K时反应的平衡转化率α=___ %。
②比较a、b处反应速率大小:va___ vb(填“大于”“小于”或“等于”)。
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇水气时发烟生成(HSiO)2O等,写出该反应的化学方程式
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=48kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH=
(3)对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。

①343K时反应的平衡转化率α=
②比较a、b处反应速率大小:va
您最近一年使用:0次



