第IIB族元素(Zn、Cd、Hg)和第VIA族元素(S、Se、Te)组成的某些二元化合物常用作半导体材料,应用十分广泛。
(1)基态Se原子价电子排布式为_______ ,有_______ 种空间运动状态。
(2)碲酸(H6TeO6)是白色固体,经X射线衍射研究证明在碲酸分子内的6个羟基排列在碲原子的周围成八面体结构,碲酸中碲原子的价层电子对数为_______ 。
(3)CdTe可用作太阳能电池的吸收层,研究从太阳能电池的碲化镉吸收层(主要含CdTe、CdS)中回收碲具有重要的意义。某回收工艺的流程如图:

①碲化镉吸收层中的CdTe参与反应的化学方程式为_______ ,该反应需要控制温度为50℃的原因为_______ ;滤渣1含有的一种单质是_______ 。
②常温下,向含Cd2+、Te4+滤液中加入NaOH溶液调节pH,当pH=10时,溶液中c(Cd2+)=_______ 。(已知Ksp[Cd(OH)2]=5.3×10-15)。
(1)基态Se原子价电子排布式为
(2)碲酸(H6TeO6)是白色固体,经X射线衍射研究证明在碲酸分子内的6个羟基排列在碲原子的周围成八面体结构,碲酸中碲原子的价层电子对数为
(3)CdTe可用作太阳能电池的吸收层,研究从太阳能电池的碲化镉吸收层(主要含CdTe、CdS)中回收碲具有重要的意义。某回收工艺的流程如图:

①碲化镉吸收层中的CdTe参与反应的化学方程式为
②常温下,向含Cd2+、Te4+滤液中加入NaOH溶液调节pH,当pH=10时,溶液中c(Cd2+)=
更新时间:2023-05-12 16:18:31
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】镍是重要的金属资源,一种从某高镁低品位铜镍矿(主要成分为 、
、 、NiO、MgO、
、NiO、MgO、 等)中回收Cu、Ni的工艺流程如图-1。
等)中回收Cu、Ni的工艺流程如图-1。
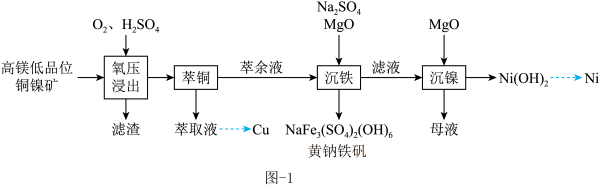
(1)镍离子的外围电子排布式为___________ ;“氧压浸出”过程的滤渣有S和___________ (写化学式)。
(2)“萃铜”时发生的反应为 ,通过分液得到
,通过分液得到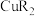 (有机相),向
(有机相),向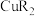 (有机相)中加入
(有机相)中加入___________ (写名称)进行“反萃取”可获得 溶液。
溶液。
(3)①“沉铁”过程生成黄钠铁矾沉淀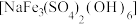 ,其中Fe元素的化合价为
,其中Fe元素的化合价为___________ 。
②“沉铁”过程中,沉淀的成分与温度、pH的关系如图-2(阴影部分 为黄钠铁矾):

a.若控制条件温度为140℃、pH=6,则所得沉淀的主要成分为___________ (填化学式)。
b.制备黄钠铁矾的最佳条件为___________ (填字母标号)。
A.20℃,pH=2 B.80℃,pH=2 C.80℃,pH=4
(4)单质镍与碳、镁形成某晶体的晶胞结构如图-3,该晶胞的化学式为___________ 。

(5)“沉镍”过程发生的离子方程式___________ ;“沉镍”时为确保 沉淀完全,理论上应调节溶液pH≥
沉淀完全,理论上应调节溶液pH≥___________ (已知:25℃时,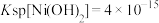 ;lg2=0.3;当溶液中c(Ni2+)≤1.0×10-5mol/L时,可认为该
;lg2=0.3;当溶液中c(Ni2+)≤1.0×10-5mol/L时,可认为该 沉淀完全)。
沉淀完全)。
(6)实验室用“配位滴定法”测定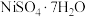 粗品的纯度。取100.0g
粗品的纯度。取100.0g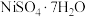 粗品溶于水(滴加几滴稀硫酸)配成100.0mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴紫脲酸胺指示剂(紫色试剂,遇
粗品溶于水(滴加几滴稀硫酸)配成100.0mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴紫脲酸胺指示剂(紫色试剂,遇 显橙黄色),用浓度为1.000
显橙黄色),用浓度为1.000 的
的 标准液滴定,平行测定3次,平均消耗标准液50.00mL。粗品中
标准液滴定,平行测定3次,平均消耗标准液50.00mL。粗品中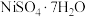 的纯度是
的纯度是___________ %。(已知: )
)
 、
、 、NiO、MgO、
、NiO、MgO、 等)中回收Cu、Ni的工艺流程如图-1。
等)中回收Cu、Ni的工艺流程如图-1。
(1)镍离子的外围电子排布式为
(2)“萃铜”时发生的反应为
 ,通过分液得到
,通过分液得到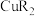 (有机相),向
(有机相),向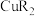 (有机相)中加入
(有机相)中加入 溶液。
溶液。(3)①“沉铁”过程生成黄钠铁矾沉淀
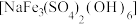 ,其中Fe元素的化合价为
,其中Fe元素的化合价为②“沉铁”过程中,沉淀的成分与温度、pH的关系如图-2(

a.若控制条件温度为140℃、pH=6,则所得沉淀的主要成分为
b.制备黄钠铁矾的最佳条件为
A.20℃,pH=2 B.80℃,pH=2 C.80℃,pH=4
(4)单质镍与碳、镁形成某晶体的晶胞结构如图-3,该晶胞的化学式为

(5)“沉镍”过程发生的离子方程式
 沉淀完全,理论上应调节溶液pH≥
沉淀完全,理论上应调节溶液pH≥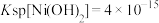 ;lg2=0.3;当溶液中c(Ni2+)≤1.0×10-5mol/L时,可认为该
;lg2=0.3;当溶液中c(Ni2+)≤1.0×10-5mol/L时,可认为该 沉淀完全)。
沉淀完全)。(6)实验室用“配位滴定法”测定
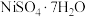 粗品的纯度。取100.0g
粗品的纯度。取100.0g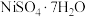 粗品溶于水(滴加几滴稀硫酸)配成100.0mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴紫脲酸胺指示剂(紫色试剂,遇
粗品溶于水(滴加几滴稀硫酸)配成100.0mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴紫脲酸胺指示剂(紫色试剂,遇 显橙黄色),用浓度为1.000
显橙黄色),用浓度为1.000 的
的 标准液滴定,平行测定3次,平均消耗标准液50.00mL。粗品中
标准液滴定,平行测定3次,平均消耗标准液50.00mL。粗品中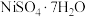 的纯度是
的纯度是 )
)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】无水 是有机合成催化剂,还可做作水处理剂等。实验室可用
是有机合成催化剂,还可做作水处理剂等。实验室可用 和亚硫酰氯(
和亚硫酰氯( )制备无水
)制备无水 ,装置如图所示(加热及夹持装置略)。已知无水
,装置如图所示(加热及夹持装置略)。已知无水 能吸收空气里的水分而潮解;
能吸收空气里的水分而潮解; 沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
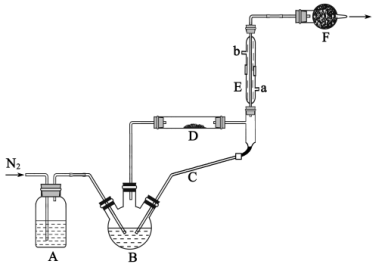
(1)仪器B的名称是______ ,其加热的合理方式为______ ;F装置中填充的试剂是______ (填名称);仪器E的作用为__________________________ 。
(2)已知六水合氯化铁在水中的溶解度如下表:
则由 溶液制得
溶液制得 晶体的方法为:
晶体的方法为:____________________ 。最后过滤洗涤干燥。常温下,若 溶液的pH控制不当会使
溶液的pH控制不当会使 沉淀,当调节溶液的
沉淀,当调节溶液的 时,溶液中
时,溶液中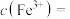
______ mol⋅L 。(常温下
。(常温下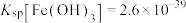 ).
).
(3)已知: 过量,请写出D中在加热时产生
过量,请写出D中在加热时产生 的化学方程式:
的化学方程式:_____________ 。
(4)为了检验D中最终产品是否含有 ,取少量产品溶于盐酸,
,取少量产品溶于盐酸,_____________ (填操作和现象),则产品含不 。
。
 是有机合成催化剂,还可做作水处理剂等。实验室可用
是有机合成催化剂,还可做作水处理剂等。实验室可用 和亚硫酰氯(
和亚硫酰氯( )制备无水
)制备无水 ,装置如图所示(加热及夹持装置略)。已知无水
,装置如图所示(加热及夹持装置略)。已知无水 能吸收空气里的水分而潮解;
能吸收空气里的水分而潮解; 沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
(1)仪器B的名称是
(2)已知六水合氯化铁在水中的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100g ) ) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
 溶液制得
溶液制得 晶体的方法为:
晶体的方法为: 溶液的pH控制不当会使
溶液的pH控制不当会使 沉淀,当调节溶液的
沉淀,当调节溶液的 时,溶液中
时,溶液中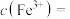
 。(常温下
。(常温下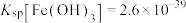 ).
).(3)已知:
 过量,请写出D中在加热时产生
过量,请写出D中在加热时产生 的化学方程式:
的化学方程式:(4)为了检验D中最终产品是否含有
 ,取少量产品溶于盐酸,
,取少量产品溶于盐酸, 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】Cr2O3可作为某些化学反应的催化剂。工业上利用铬铁矿生产Cr2O3的工艺流程如图:

铬铁矿的主要成分有Cr2O3•FeO、FeO、SiO2、Al2O3,铵铁矾的化学式为NH4Fe(SO4)2•12H2O。回答下列问题:
(1)“酸浸氧化”时,为提高反应速率,除采用120~150℃外,还可采取的措施为____ 。
(2)“酸浸氧化”时,Cr2O3•FeO发生反应的化学方程式为____ 。
(3)流程中,第二次加氨水的目的是___ 。
(4)已知:常温下,Al(OH)3+H2O Al(OH)
Al(OH) +H+Ka=10-13.37;Al(OH)3(s)
+H+Ka=10-13.37;Al(OH)3(s) 3OH-(aq)+Al3+(aq)Ksp=1.9×10-33;通常认为离子浓度小于10-5mol·L-1为沉淀完全。用pH计精确测得“沉淀”工序实际操作时pH为7.87,经“沉淀”后所得滤液中Al(OH)
3OH-(aq)+Al3+(aq)Ksp=1.9×10-33;通常认为离子浓度小于10-5mol·L-1为沉淀完全。用pH计精确测得“沉淀”工序实际操作时pH为7.87,经“沉淀”后所得滤液中Al(OH) 的浓度为
的浓度为____ mol·L-1,c(Al3+)____ (填“已”或“未”)达到沉淀完全的标准。
(5)将“滤液1”中的主要溶质回收后的用途为____ 。
(6)“分离”时,反应的离子方程式为____ 。
(7)已知:亚铁氧化物(含FeO、Cr2O3•FeO中的FeO部分)在铬铁矿中的质量分数为28%,当处理1t铬铁矿时,至少需要消耗CrO3____ t(保留2位有效数字)。

铬铁矿的主要成分有Cr2O3•FeO、FeO、SiO2、Al2O3,铵铁矾的化学式为NH4Fe(SO4)2•12H2O。回答下列问题:
(1)“酸浸氧化”时,为提高反应速率,除采用120~150℃外,还可采取的措施为
(2)“酸浸氧化”时,Cr2O3•FeO发生反应的化学方程式为
(3)流程中,第二次加氨水的目的是
(4)已知:常温下,Al(OH)3+H2O
 Al(OH)
Al(OH) +H+Ka=10-13.37;Al(OH)3(s)
+H+Ka=10-13.37;Al(OH)3(s) 3OH-(aq)+Al3+(aq)Ksp=1.9×10-33;通常认为离子浓度小于10-5mol·L-1为沉淀完全。用pH计精确测得“沉淀”工序实际操作时pH为7.87,经“沉淀”后所得滤液中Al(OH)
3OH-(aq)+Al3+(aq)Ksp=1.9×10-33;通常认为离子浓度小于10-5mol·L-1为沉淀完全。用pH计精确测得“沉淀”工序实际操作时pH为7.87,经“沉淀”后所得滤液中Al(OH) 的浓度为
的浓度为(5)将“滤液1”中的主要溶质回收后的用途为
(6)“分离”时,反应的离子方程式为
(7)已知:亚铁氧化物(含FeO、Cr2O3•FeO中的FeO部分)在铬铁矿中的质量分数为28%,当处理1t铬铁矿时,至少需要消耗CrO3
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,回答下列问题:
(1)基态Ni2+的电子排布式为_______ 。
(2)①在1mol[Ni(NH3)6]2+中含有σ键的数目为_______ 。
②Ni、N、O三种元素的第一电离能由小到大的顺序是为_____ 。
③液氨中存在电离平衡2NH3⇌NH + NH
+ NH ,根据价层电子对互斥理论,可推知NH2—的空间构型为
,根据价层电子对互斥理论,可推知NH2—的空间构型为_______ ,液氨体系内,氮原子的杂化轨道类型为_____ 。NH3比PH3更容易液化的原因为_____ 。
(3)氧化镍晶胞如图所示,镍离子的配位数为_______ 。
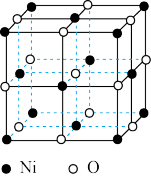
已知晶胞参数为a cm,NA为阿伏加德罗常数的值,则氧化镍晶体密度为______ g/cm3。
(1)基态Ni2+的电子排布式为
(2)①在1mol[Ni(NH3)6]2+中含有σ键的数目为
②Ni、N、O三种元素的第一电离能由小到大的顺序是为
③液氨中存在电离平衡2NH3⇌NH
 + NH
+ NH ,根据价层电子对互斥理论,可推知NH2—的空间构型为
,根据价层电子对互斥理论,可推知NH2—的空间构型为(3)氧化镍晶胞如图所示,镍离子的配位数为

已知晶胞参数为a cm,NA为阿伏加德罗常数的值,则氧化镍晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】短周期元素A、B、C、D的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1∶2,D的最高化合价和最低化合价代数和等于4。
(1)基态B原子的价电子排布图为_______ ;基态D原子核外电子占据最高能级的电子云轮廓图为_______ 形。
(2)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp2杂化、空间结构为平面三角形的是_______ (填分子式,下同),属于极性分子的是_______ ,键角由大到小的顺序为_______ 。
(3)(DC)4为热色性固体,且有色温效应,其颜色在低于30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色,(DC)4属于_______ 晶体,在淡黄色→橙黄色→深红色的转化中,破坏的作用力是_______ ;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______ 。
(4)A、C形成立方晶体,晶体结构类似于金刚石,如图所示(白色球代表A原子,黑色球代表C原子)。已知:该晶体边长为anm,NA代表阿伏加德罗常数的值。
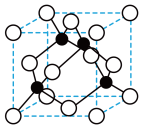
①该晶体的化学式为_______ 。
②该晶体的密度为_______ g/cm3。
(1)基态B原子的价电子排布图为
(2)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp2杂化、空间结构为平面三角形的是
(3)(DC)4为热色性固体,且有色温效应,其颜色在低于30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色,(DC)4属于
(4)A、C形成立方晶体,晶体结构类似于金刚石,如图所示(白色球代表A原子,黑色球代表C原子)。已知:该晶体边长为anm,NA代表阿伏加德罗常数的值。

①该晶体的化学式为
②该晶体的密度为
您最近一年使用:0次
【推荐3】有A、B、D、E、F、G六种前四周期的元素,A是宇宙中最丰富的元素,B和D的原子都有1个未成对电子,B+比D少一个电子层,D原子得一个电子填入3p轨道后,3p轨道全充满;E原子的2p轨道中有3个未成对电子, F的最高化合价和最低化合价的代数和为4。R是由B、F两元素形成的离子化合物,其中B+与F2-离子数之比为2∶1。G位于周期表第6纵行且是六种元素中原子序数最大的。请回答下列问题:
(1)D元素的电负性_______ F元素的电负性(填“>”、“<”或“=”)。
(2)G的价电子排布图_________________________________ 。
(3)B形成的晶体堆积方式为________ ,区分晶体和非晶体最可靠的科学方法是对固体进行_______ 实验。
(4)D-的最外层共有______ 种不同运动状态的电子,有___ 种能量不同的电子。F2D2广泛用于橡胶工业,各原子均满足八电子稳定结构,F2D2中F原子的杂化类型是___________ ,F2D2是______ 分子(填“极性”或“非极性”)。
(5)A与E形成的最简单化合物分子空间构型为_____ ,在水中溶解度很大。该分子是极性分子的原因是_____ 。
(6)R的晶胞如图所示,设F2-半径为r1 cm,B+半径为r2cm。试计算R晶体的密度为______ 。(阿伏加 德罗常数用NA表示,写表达式,不化简)


(1)D元素的电负性
(2)G的价电子排布图
(3)B形成的晶体堆积方式为
(4)D-的最外层共有
(5)A与E形成的最简单化合物分子空间构型为
(6)R的晶胞如图所示,设F2-半径为r1 cm,B+半径为r2cm。试计算R晶体的密度为


您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】Li、Na、Mg、C、N、O、S等元素的研究一直在进行中,其单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)钠在火焰上灼烧的黄光是一种_____ (填字母)
A.吸收光谱;B.发射光谱。
(2)H2S的VSEPR模型为________ ,其分子的空间构型为________ ;结合等电子体的知识判断离子N3–的空间构型为________ 。
(3)Li2O是离子晶体,其晶格能可通过下图的Born-Haber循环计算得到。
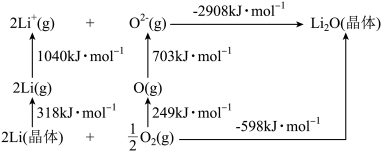
可知Li2O晶格能为______ kJ·mol-1。
(4)N、O、Mg元素的前3级电离能如下表所示:
X、Y、Z中为N元素的是______ ,判断理由是_____________________________ 。
(5)N5–为平面正五边形,科学家预测将来会制出含N4–、N6–等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则N4–离子中的大π键应表示为
),则N4–离子中的大π键应表示为_________ 。
(1)钠在火焰上灼烧的黄光是一种
A.吸收光谱;B.发射光谱。
(2)H2S的VSEPR模型为
(3)Li2O是离子晶体,其晶格能可通过下图的Born-Haber循环计算得到。
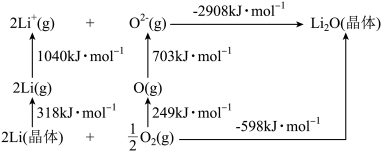
可知Li2O晶格能为
(4)N、O、Mg元素的前3级电离能如下表所示:
| 元素 | I1/kJ mol-1 mol-1 | I2/kJ mol-1 mol-1 | I3/kJ mol-1 mol-1 |
| X | 737.7 | 1450.7 | 7732.7 |
| T | 1313.9 | 3388.3 | 5300.5 |
| Z | 1402.3 | 2856.0 | 4578.1 |
(5)N5–为平面正五边形,科学家预测将来会制出含N4–、N6–等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则N4–离子中的大π键应表示为
),则N4–离子中的大π键应表示为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】磷元素存在于人体所有细胞中,是维持骨骼和牙齿的必要物质。近年来,很多磷化物 开始广泛应用在电化学、生物学、光学、催化等方面。
(1)PCl5在晶体状态时,由PCl 、PCl
、PCl 两种离子构成, PC1
两种离子构成, PC1 的空间结构名称为
的空间结构名称为 ____ ,基态磷原子电子排布式为 _____ 。
(2)由磷原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p3、②[Ne]3s23p24s1、③ [Ne]3s23p2, 有关这些微粒的叙述,不正确的是 。
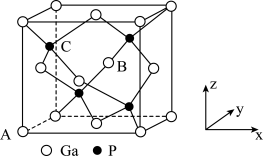
(3)氮化硼、磷化铝、磷化镓(镓为IⅠIA 族元素)晶胞结构都与金刚石的晶胞相似,氮化硼的 硬度仅次于金刚石,磷化铝和磷化镓都是很好的半导体材料,熔点如表所示,分析其变化的原因:_____ 。
(4)磷化镓的晶胞结构如图所示,与镓原子距离最近且相等的镓原子有_____ 个;A点坐标 为(0,0,0), B 点坐标为(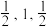 ), 则C 点坐标为
), 则C 点坐标为 ______ ;已知晶胞棱长为a pm, 阿伏加德罗常数为NA, 则磷化镓晶胞密度为 ______ gcm3 (列出计算式)。
(1)PCl5在晶体状态时,由PCl
 、PCl
、PCl 两种离子构成, PC1
两种离子构成, PC1 的空间结构名称为
的空间结构名称为 (2)由磷原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p3、②[Ne]3s23p24s1、③ [Ne]3s23p2, 有关这些微粒的叙述,不正确的是 。
| A.微粒半径:②>①>③ |
| B.电子排布属于基态原子(或离子)的是:①③ |
| C.电离一个电子所需最低能量:①>③>② |
| D.得电子能力:①>③ |
| 物质 | 氮化硼 | 磷化铝 | 磷化镓 |
| 熔点 | 3000℃ | 2000℃ | 1477℃ |
(4)磷化镓的晶胞结构如图所示,与镓原子距离最近且相等的镓原子有
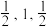 ), 则C 点坐标为
), 则C 点坐标为 
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】水是清洁、可持续的氢能来源。利用太阳能从水中获取氢气符合可持续发展的理念。“太阳能直接热分解水制氢”通过集中阳光产生2000K以上高温,促使 分解为
分解为 和
和 ;若温度进一步升高至5000K,
;若温度进一步升高至5000K, 与
与 会分解为气态原子。
会分解为气态原子。
(1) 分解过程中断裂的化学键属于
分解过程中断裂的化学键属于___________ 。
A.离子键 B.极性共价键 C.非极性共价键
(2)在相同条件下,同时存在如下两个过程:
i.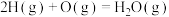 ii.
ii.
比较下列量的相对大小(均从选项中选择):①放出热量___________ ;②反应速率___________ 。
A.i>ii B.i=ii C.i<ii
“太阳能光催化分解水制氢”原理可以表示为: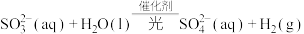 。
。
(3)已知 呈平面正三角形结构,推测
呈平面正三角形结构,推测 的立体构型为
的立体构型为___________ 。
A.平面正三角形 B.正四面体型 C.三角锥型
(4)能说明氯的非金属性比硫强的事实是___________。
(5) 与
与 结构相似,但
结构相似,但 的沸点高于
的沸点高于 ,原因是
,原因是___________ 。
(6)反应开始一段时间后,取出一定量溶液,写出检验溶液中 的操作方法:
的操作方法:________ 。
“太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生 。如常见的铁氧化物循环制氢过程如图所示。
。如常见的铁氧化物循环制氢过程如图所示。
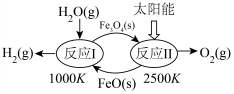
(7)写出反应I的化学方程式:___________ ;若该反应生成标准状况下 氢气,转移电子数目为
氢气,转移电子数目为___________ 。
(8)科学家想要用组成相似的钴氧化物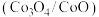 代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的
代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的 值随温度
值随温度 变化如图所示。
变化如图所示。
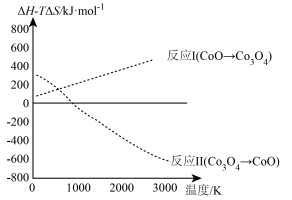
结合图像判断能否用钴氧化物代替铁氧化物进行热化学循环制氢?若可行,举出采用钴氧化物的一个优势;若不可行,说明理由___________ 。
(9)除了上述“直接热分解”、“光催化分解”和“热化学循环”外,请再设计一种利用太阳能从水中获取氢气的方法:___________ (简述即可,不必展开)。
 分解为
分解为 和
和 ;若温度进一步升高至5000K,
;若温度进一步升高至5000K, 与
与 会分解为气态原子。
会分解为气态原子。(1)
 分解过程中断裂的化学键属于
分解过程中断裂的化学键属于A.离子键 B.极性共价键 C.非极性共价键
(2)在相同条件下,同时存在如下两个过程:
i.
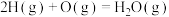 ii.
ii.
比较下列量的相对大小(均从选项中选择):①放出热量
A.i>ii B.i=ii C.i<ii
“太阳能光催化分解水制氢”原理可以表示为:
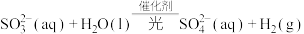 。
。(3)已知
 呈平面正三角形结构,推测
呈平面正三角形结构,推测 的立体构型为
的立体构型为A.平面正三角形 B.正四面体型 C.三角锥型
(4)能说明氯的非金属性比硫强的事实是___________。
A.溶解性: | B.氧化性: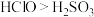 |
C.热稳定性: | D.酸性: |
(5)
 与
与 结构相似,但
结构相似,但 的沸点高于
的沸点高于 ,原因是
,原因是(6)反应开始一段时间后,取出一定量溶液,写出检验溶液中
 的操作方法:
的操作方法:“太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生
 。如常见的铁氧化物循环制氢过程如图所示。
。如常见的铁氧化物循环制氢过程如图所示。
(7)写出反应I的化学方程式:
 氢气,转移电子数目为
氢气,转移电子数目为(8)科学家想要用组成相似的钴氧化物
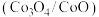 代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的
代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的 值随温度
值随温度 变化如图所示。
变化如图所示。
结合图像判断能否用钴氧化物代替铁氧化物进行热化学循环制氢?若可行,举出采用钴氧化物的一个优势;若不可行,说明理由
(9)除了上述“直接热分解”、“光催化分解”和“热化学循环”外,请再设计一种利用太阳能从水中获取氢气的方法:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】硫酸铁铵晶体[NH4Fe(SO4)2•xH2O]用途十分广泛,可用作聚合催化剂、媒染剂等。实验室可用废铁屑制备硫酸铁铵,流程如图所示。

回答下列问题:
(1)步骤②需要加热的目的是_____ ,温度保持80~95℃,采用的合适加热方式是_____ 。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_____ (填标号)。
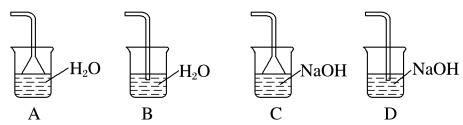
(2)步骤③中选用足量的H2O2,理由是____ 。
(3)步骤⑤的具体实验操作有____ 、____ 、____ ,经干燥得到硫酸铁铵晶体样品。
(4)称取硫酸铁铵产品4.820g溶于水中,转入100mL容量瓶定容。每次取20.00mL溶液放入烧杯,加入NaOH溶液调节至碱性,再加入足量BaCl2溶液后过滤,将沉淀干燥并灼烧至恒重,称取固体质量。三次称量固体的平均值为1.092g。通过计算写出该硫酸铁铵晶体的化学式为____ 。

回答下列问题:
(1)步骤②需要加热的目的是

(2)步骤③中选用足量的H2O2,理由是
(3)步骤⑤的具体实验操作有
(4)称取硫酸铁铵产品4.820g溶于水中,转入100mL容量瓶定容。每次取20.00mL溶液放入烧杯,加入NaOH溶液调节至碱性,再加入足量BaCl2溶液后过滤,将沉淀干燥并灼烧至恒重,称取固体质量。三次称量固体的平均值为1.092g。通过计算写出该硫酸铁铵晶体的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的ⅥB族,F元素的基态原子中有4个未成对电子。
(1)A元素单质的结构式为___________ ;基态E元素原子价层电子排布图为___________ 。
(2)A的氢化物A2H4分子属于___________ 分子(填“极性或非极性”);A与B形成的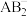 的空间构型为
的空间构型为___________ 。
(3)火箭推动剂由A2H4和H2B2组成,加热反应时有A元素的单质生成,写出该化学反应方程式:___________ 。
(4)酸性条件下,E元素的离子 和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:
和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:___________ 。
(5)元素C和D组成的简单化合物空间构型为___________ ,基态F3+未成对电子数为___________ 个。
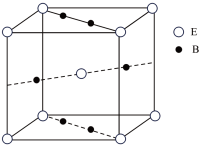
(6)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数(边长)为a pm,NA为阿伏加德罗常数的值,则该晶胞的密度为___________ g·cm-3。
(1)A元素单质的结构式为
(2)A的氢化物A2H4分子属于
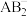 的空间构型为
的空间构型为(3)火箭推动剂由A2H4和H2B2组成,加热反应时有A元素的单质生成,写出该化学反应方程式:
(4)酸性条件下,E元素的离子
 和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:
和D元素的阴离子反应可生成D单质,E元素被还原为+3价,写出离子方程式:(5)元素C和D组成的简单化合物空间构型为
(6)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数(边长)为a pm,NA为阿伏加德罗常数的值,则该晶胞的密度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某小组探究Na2O2与H2O的反应,实验方案及现象如下:
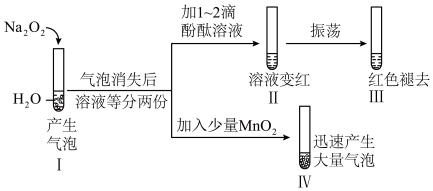
(1)Ⅰ中Na2O2与H2O反应生成O2的化学方程式是______ 。
(2)证明Ⅰ中反应后的溶液中存在H2O2的实验证据是______ 。
(3)针对Ⅲ中“振荡后溶液红色褪去”提出假设:
已知:ⅰ.酚酞溶液遇浓NaOH溶液先变红后褪色,加水后恢复红色
ⅱ.一定条件下,酚酞易被强氧化剂氧化
假设1:溶液中NaOH浓度过大,使溶液先变红后褪色;
假设2:______ 。
设计如下实验进行探究,请将实验方案、实验现象补充完整。

(1)Ⅰ中Na2O2与H2O反应生成O2的化学方程式是
(2)证明Ⅰ中反应后的溶液中存在H2O2的实验证据是
(3)针对Ⅲ中“振荡后溶液红色褪去”提出假设:
已知:ⅰ.酚酞溶液遇浓NaOH溶液先变红后褪色,加水后恢复红色
ⅱ.一定条件下,酚酞易被强氧化剂氧化
假设1:溶液中NaOH浓度过大,使溶液先变红后褪色;
假设2:
设计如下实验进行探究,请将实验方案、实验现象补充完整。
序号 | 实验方案 | 实验现象 | 实验结论 |
① | 向Ⅲ中溶液加入 | 溶液不变红 | 假设1不成立 |
② | 分别向Ⅲ和Ⅳ中溶液滴加2滴酚酞溶液 | Ⅲ中 | 假设2成立 |
您最近一年使用:0次



