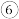物质的类别和核心元素的化合价是研究物质性质的两个重要角度。部分含氮及氯物质的价类二维图如下,回答下列问题:
(1)关于上述部分物质间转化的说法正确的是___________(填字母)。
(2)固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:

a.该转化过程①②③反应中___________ 为氧化还原反应(填编号)。
b.参与该人工固氮转化的物质中含有的化学键类型有___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D.氢键
c.假设每一步均完全转化,每生成1 mol NH3,同时生成___________ molO2。
(3)在常温下铁、铜与e的浓溶液组成原电池,请写出电极反应式负极:___________ ;正极:___________ 。
(4)由氮和氯组成的一种二元化合物分子中,各原子最外层均达到8电子的稳定结构,该液态化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:___________ 。

(1)关于上述部分物质间转化的说法正确的是___________(填字母)。
| A.a和c可在一定条件下反应生成b |
| B.工业上通过a→b→d→e来制备HNO3 |
| C.浓的a'溶液和浓的c'溶液反应可以得到b' |
| D.a和a'在空气中相遇产生白烟 |

a.该转化过程①②③反应中
b.参与该人工固氮转化的物质中含有的化学键类型有
A.离子键 B.极性键 C.非极性键 D.氢键
c.假设每一步均完全转化,每生成1 mol NH3,同时生成
(3)在常温下铁、铜与e的浓溶液组成原电池,请写出电极反应式负极:
(4)由氮和氯组成的一种二元化合物分子中,各原子最外层均达到8电子的稳定结构,该液态化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:
更新时间:2023-05-13 10:56:22
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________ (填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
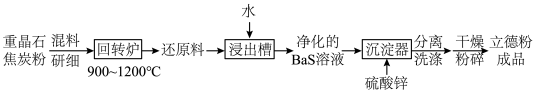
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________ 。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______________________ 。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的___________ (填化学式)。
③沉淀器中反应的离子方程式为______________________ 。
(3)成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L−1的I2−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L−1Na2S2O3溶液滴定,反应式为I2+2 =2I−+
=2I−+ 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________ ,样品中S2−的含量为______________ (写出表达式)。
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:

①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的
③沉淀器中反应的离子方程式为
(3)成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L−1的I2−KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L−1Na2S2O3溶液滴定,反应式为I2+2
 =2I−+
=2I−+ 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】工业上利用冶炼烟尘(主要成分TeO2、SeO2、PbO、Au、Ag等)回收Se、TeO2的工艺流程如下:
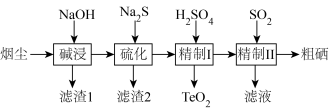
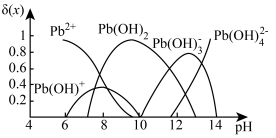
已知:①水溶液中各形态铅的分布系数 (x)与溶液pH的关系如图所示。
(x)与溶液pH的关系如图所示。
②SeO2是酸性氧化物,TeO2、PbO是两性氧化物。回答下列问题:
(1)Se在元素周期表中的位置为__ 。
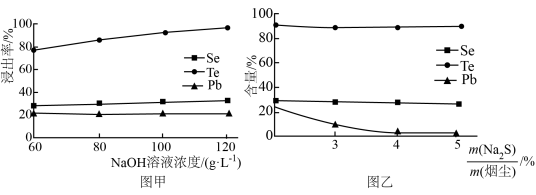
(2)碱浸时,NaOH溶液对元素浸出率的影响如图甲所示,实际生产中所用NaOH溶液的浓度为__ 100g/L,浓度不能过大的原因是__ ;硫化时,Na2S加入量对元素含量的影响如图乙所示,反应的离子方程式为__ 。
(3)精制1时控制pH范围为5.5~6.5,pH过低导致TeO2中会混有Se和黄色固体杂质,原因是__ (用离子方程式表示),pH过低还会导致沉磅率降低的原因是__ 。
(4)精制Ⅱ后的滤液可循环使用,应当导入到__ 操作中(填操作单元的名称)。
(5)测定粗硒样品中硒的含量:称量0.2500g粗硒样品,用浓H2SO4将样品中的Se氧化得到SeO2,生成的SeO2加入硫酸酸化的KI溶液中充分反应,加入淀粉溶液,用0.4000mol/L的Na2S2O3标准溶液滴定至终点时消耗20.00mL(杂质不参与反应)。则粗硒样品中硒的质量分数为__ 。测定原理为:SeO2+4I-+4H+=Se+2I2+2H2O;I2+2S2O =2I-+S4O
=2I-+S4O

已知:①水溶液中各形态铅的分布系数
 (x)与溶液pH的关系如图所示。
(x)与溶液pH的关系如图所示。
②SeO2是酸性氧化物,TeO2、PbO是两性氧化物。回答下列问题:
(1)Se在元素周期表中的位置为
(2)碱浸时,NaOH溶液对元素浸出率的影响如图甲所示,实际生产中所用NaOH溶液的浓度为

(3)精制1时控制pH范围为5.5~6.5,pH过低导致TeO2中会混有Se和黄色固体杂质,原因是
(4)精制Ⅱ后的滤液可循环使用,应当导入到
(5)测定粗硒样品中硒的含量:称量0.2500g粗硒样品,用浓H2SO4将样品中的Se氧化得到SeO2,生成的SeO2加入硫酸酸化的KI溶液中充分反应,加入淀粉溶液,用0.4000mol/L的Na2S2O3标准溶液滴定至终点时消耗20.00mL(杂质不参与反应)。则粗硒样品中硒的质量分数为
 =2I-+S4O
=2I-+S4O
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】铁及其化合物在生活中的应用广泛,其中氯化铁主要用于金属蚀刻、污水处理。
I.以废铁屑(Fe和Fe2O3的混合物)为原料获得FeCl3的流程如图。

(1)电解氯化钠水溶液的离子方程式为___________ 。
(2)W溶液为___________ (填名称)。
(3)“氧化”时发生反应的离子方程式为___________ ;若“氧化”时由电解NaCl水溶液得到的Z恰好完全反应,得到amolFeCl3,则发生电解的NaCl的物质的量为___________ (用含a的代数式表示)mol。
II.电子工业常用30%的FeCl3溶液作为腐蚀液覆在绝缘板的铜箔上,制造印刷电路板。
(4)某化学兴趣小组测得含有FeCl3、FeCl2、CuCl2的腐蚀废液中Fe2+、Cu2+、Fe2+的物质的量之比为3:2:1,向其中加入适量铁粉,充分反应后,测得溶液中Fe3+、Cu2+、Fe2+的物质的量之比变为1:2:4.则参加反应的铁粉与原溶液中Fe3+的物质的量之比为___________ 。
I.以废铁屑(Fe和Fe2O3的混合物)为原料获得FeCl3的流程如图。

(1)电解氯化钠水溶液的离子方程式为
(2)W溶液为
(3)“氧化”时发生反应的离子方程式为
II.电子工业常用30%的FeCl3溶液作为腐蚀液覆在绝缘板的铜箔上,制造印刷电路板。
(4)某化学兴趣小组测得含有FeCl3、FeCl2、CuCl2的腐蚀废液中Fe2+、Cu2+、Fe2+的物质的量之比为3:2:1,向其中加入适量铁粉,充分反应后,测得溶液中Fe3+、Cu2+、Fe2+的物质的量之比变为1:2:4.则参加反应的铁粉与原溶液中Fe3+的物质的量之比为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
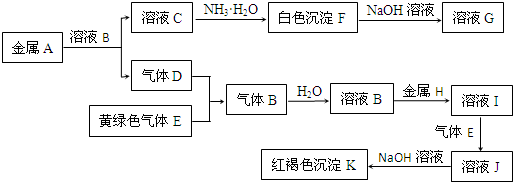
(1)写出下列物质的化学式:B是_________________ , F是_________________ ,K是_________________ 。
(2)写出反应 “A→C”的离子方程式:_________________________________________ 。
(3)写出反应 “I→J”的化学方程式:_________________________________________ 。
(4)在溶液中滴加NaOH溶液,可观察到的现象是_____________________________ 。

(1)写出下列物质的化学式:B是
(2)写出反应 “A→C”的离子方程式:
(3)写出反应 “I→J”的化学方程式:
(4)在溶液中滴加NaOH溶液,可观察到的现象是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】目前,世界上多采用电解熔融氯化钠的方法来生产金属钠: 。已知A、B、C、D、E、F有如下转化关系:
。已知A、B、C、D、E、F有如下转化关系:
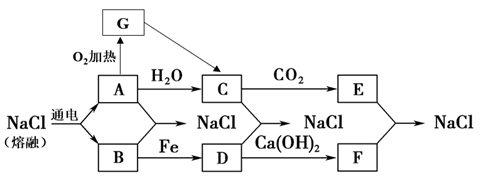
(1)写出化学式:A________ E_________ ,G________ 。
(2)写出A→C的化学方程式:________ 反应类型为:____ 。
写出B→D化学反应方程式:___________ 。
(3)G为_______ (颜色)固体,G→C的化学方程式__________________ 。
(4)若把A投入盛有D的溶液中,溶液中出现____________ 颜色沉淀。
 。已知A、B、C、D、E、F有如下转化关系:
。已知A、B、C、D、E、F有如下转化关系:
(1)写出化学式:A
(2)写出A→C的化学方程式:
写出B→D化学反应方程式:
(3)G为
(4)若把A投入盛有D的溶液中,溶液中出现
您最近一年使用:0次
【推荐1】(1)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应: 2SO2(g)+O2(g)═2SO3(g),此反应放热。2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请填写下列空白:
①从反应开始到达化学平衡,生成SO3的平均反应速率为_______ ;平衡时,SO2转化率为 _____
②下列叙述能证明该反应已达到化学平衡状态的是_________
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
F.混合气体密度不再变化
(2)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2。请回答下列问题:
①电池的负极材料为______ ,发生的电极反应为______ ;
②电池正极发生的电极反应为______ ;
③SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是____ ,反应的化学方程式为______
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为______ ,正极反应式为 ____

①从反应开始到达化学平衡,生成SO3的平均反应速率为
②下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
F.混合气体密度不再变化
(2)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2。请回答下列问题:
①电池的负极材料为
②电池正极发生的电极反应为
③SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】甲醇是重要的化工原料,具有广泛的开发和应用前景。在催化剂作用下,由CO和H2来制备CH3OH的化学方程式为
 。
。
(1)一定条件下,在体积为2L的密闭容器中充入一定量的CO和H2制备CH3OH,醇的物质的量随时间的变化如图所示。
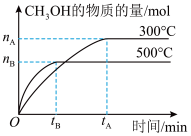
①300℃时,从反应开始到化学平衡状态,以H2表示的化学反应速率
___________ 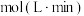 (用
(用 、
、 表示)。
表示)。
②
___________ 0(填“>”“<”或“=”)。
③下列不能说明该反应已达到平衡状态的是___________ (填字母序号)。
A.CH3OH的质量不变 B.混合气体的平均相对分子质量不再改变
C. D.混合气体的密度不再发生改变
D.混合气体的密度不再发生改变
(2)某温度,将2mol CO与4mol H2的混合气体充入容积为2L的密闭容器中,发生上述制备甲醇的反应。反应达到平衡,测得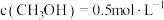 。若保持体积不变,再充入1mol CO和1molCH3OH,此时v(正)
。若保持体积不变,再充入1mol CO和1molCH3OH,此时v(正)___________ v(逆)(填“>”“<”或“=”)。
(3)在容积为1L的恒容容器中,分别研究在 ℃、
℃、 ℃和
℃和 ℃三种温度下合成甲酸的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
℃三种温度下合成甲酸的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
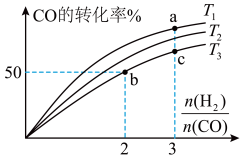
① ℃时,上述反应的化学平衡常数K=
℃时,上述反应的化学平衡常数K=___________ 。
②曲线上a、b、c点对应的化学平衡常数分别为 、
、 、
、 ,则
,则 、
、 、
、 的大小关系为
的大小关系为___________ 。
(4)某学习小组利用甲醇燃料电池进行电解原理的探究实验。请回答下列问题:
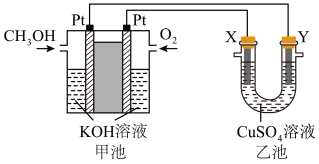
①甲池中通入甲醇电极的电极反应式为___________ 。
②若X、Y均为石墨,则乙池中总的离子方程式为___________ 。

 。
。(1)一定条件下,在体积为2L的密闭容器中充入一定量的CO和H2制备CH3OH,醇的物质的量随时间的变化如图所示。

①300℃时,从反应开始到化学平衡状态,以H2表示的化学反应速率

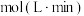 (用
(用 、
、 表示)。
表示)。②

③下列不能说明该反应已达到平衡状态的是
A.CH3OH的质量不变 B.混合气体的平均相对分子质量不再改变
C.
 D.混合气体的密度不再发生改变
D.混合气体的密度不再发生改变(2)某温度,将2mol CO与4mol H2的混合气体充入容积为2L的密闭容器中,发生上述制备甲醇的反应。反应达到平衡,测得
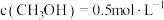 。若保持体积不变,再充入1mol CO和1molCH3OH,此时v(正)
。若保持体积不变,再充入1mol CO和1molCH3OH,此时v(正)(3)在容积为1L的恒容容器中,分别研究在
 ℃、
℃、 ℃和
℃和 ℃三种温度下合成甲酸的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
℃三种温度下合成甲酸的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
①
 ℃时,上述反应的化学平衡常数K=
℃时,上述反应的化学平衡常数K=②曲线上a、b、c点对应的化学平衡常数分别为
 、
、 、
、 ,则
,则 、
、 、
、 的大小关系为
的大小关系为(4)某学习小组利用甲醇燃料电池进行电解原理的探究实验。请回答下列问题:

①甲池中通入甲醇电极的电极反应式为
②若X、Y均为石墨,则乙池中总的离子方程式为
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
【推荐3】餐厨垃圾在酶发酵下可获得乙醇,继续反应可制备乙酸乙酯(C)和高分子材料G。
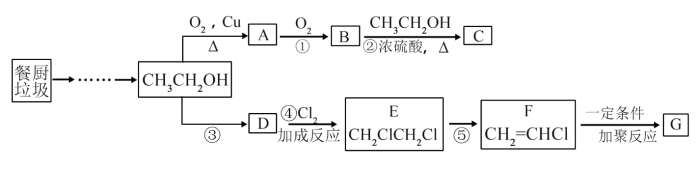
(1)乙醇含有的官能团的名称是___________ 。
(2)A的结构简式 。则由乙醇转变为A的过程中n(氧化剂):n(还原剂)=
。则由乙醇转变为A的过程中n(氧化剂):n(还原剂)=___________ 。
(3)反应②的反应类型是___________ 。
(4)D是衡量国家化工水平的重要标志,可以由石油精馏产物——戊烷裂化裂解制备。戊烷的分子式为___________ 。其同分异构体中有四个甲基的分子的名称是___________ 。
(5)下列说法中,不正确的是___________ (填字母)。
A.C不溶于水,密度比水大
B.乙醇和F均能使酸性高锰酸钾溶液褪色
C.E的同分异构体是非极性分子
(6)F→G的化学方程式是___________ 。
(7)餐厨垃圾的发酵程度可以用碱性燃料电池酒精检测仪检测,总反应类似于乙醇的燃烧反应,写出电池负极的反应方程式___________ 。

(1)乙醇含有的官能团的名称是
(2)A的结构简式
 。则由乙醇转变为A的过程中n(氧化剂):n(还原剂)=
。则由乙醇转变为A的过程中n(氧化剂):n(还原剂)=(3)反应②的反应类型是
(4)D是衡量国家化工水平的重要标志,可以由石油精馏产物——戊烷裂化裂解制备。戊烷的分子式为
(5)下列说法中,不正确的是
A.C不溶于水,密度比水大
B.乙醇和F均能使酸性高锰酸钾溶液褪色
C.E的同分异构体是非极性分子
(6)F→G的化学方程式是
(7)餐厨垃圾的发酵程度可以用碱性燃料电池酒精检测仪检测,总反应类似于乙醇的燃烧反应,写出电池负极的反应方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】下表是元素周期表的一部分,针对表中的 元素,用元素符号或化学式填空回答以下问题:
元素,用元素符号或化学式填空回答以下问题:
(1)化学性质最不活泼的元素原子的原子结构示意图为________ ;
(2)元素 、
、 的简单氢化物中的稳定性最强的是
的简单氢化物中的稳定性最强的是______________  用化学式表示
用化学式表示 ;
;
(3)元素的最高价氧化物对应的水化物中酸性最强的是________ ,碱性最强的是_______ ,呈两性的氢氧化物是_______________ ,元素 的最高价氧化物对应水化物中含有的化学键类型为
的最高价氧化物对应水化物中含有的化学键类型为________________ ;
(4)在 四种元素中,简单离子半径最小的是
四种元素中,简单离子半径最小的是_________ ;
(5) 的电子式为
的电子式为___________ ; 的电子式为
的电子式为_________ ;
(6)在 与
与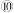 的单质中,氧化性较强的是
的单质中,氧化性较强的是__________ ,用化学反应方程式证明:___________________________ 。
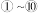 元素,用元素符号或化学式填空回答以下问题:
元素,用元素符号或化学式填空回答以下问题:IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 |
|
| ||||||
三 |
|
|
|
|
|
| ||
四 |
|
|
(2)元素
 、
、 的简单氢化物中的稳定性最强的是
的简单氢化物中的稳定性最强的是 用化学式表示
用化学式表示 ;
;(3)元素的最高价氧化物对应的水化物中酸性最强的是
 的最高价氧化物对应水化物中含有的化学键类型为
的最高价氧化物对应水化物中含有的化学键类型为(4)在
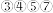 四种元素中,简单离子半径最小的是
四种元素中,简单离子半径最小的是(5)
 的电子式为
的电子式为 的电子式为
的电子式为(6)在
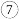 与
与 的单质中,氧化性较强的是
的单质中,氧化性较强的是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】已知:A、B、C、D、E是原子序数依次增大的短周期元素,F、G为长周期元素。请根据下列信息回答有关问题。
(1)写出B元素的原子结构示意图:________ ;C、D、E、F的简单离子半径由大到小的顺序为_________ (填离子符号)。
(2)C元素的某氧化物为淡黄色固体,写出该氧化物与水反应的离子方程式:________________ 。
(3)G元素的单质可以在E元素的单质中燃烧,其产物的饱和溶液与沸水反应可以得到能产生丁达尔效应的分散系,写出该产物的浓溶液与沸水反应的化学方程式:________________ 。
(4)C元素的最高价氧化物对应的水化物与E元素的最高价氧化物对应的水化物反应的离子方程式为________ 。
(5)A元素与F元素形成的化合物属于___ (填“离子”或“共价”)化合物,该化合物中所含的化学键为___ (填“共价键”或“离子键”)。
| ① | A的单质在所有单质中密度最小 |
| ② | B的一种氧化物可用于人工降雨 |
| ③ | C的一种氧化物可以作供氧制,该氧化物的焰色试验为黄色 |
| ④ | D的氧化物既能与强酸反应,又能与强碱反应生成盐和水 |
| ⑤ | E的一种含氧酸常用作漂白剂和消毒剂,其单质为黄绿色气体 |
| ⑥ | F的焰色试验为紫色(透过蓝色钴玻璃观察) |
| ⑦ | G是用途最广泛的金属,它的一种氧化物可以作磁性材料 |
(2)C元素的某氧化物为淡黄色固体,写出该氧化物与水反应的离子方程式:
(3)G元素的单质可以在E元素的单质中燃烧,其产物的饱和溶液与沸水反应可以得到能产生丁达尔效应的分散系,写出该产物的浓溶液与沸水反应的化学方程式:
(4)C元素的最高价氧化物对应的水化物与E元素的最高价氧化物对应的水化物反应的离子方程式为
(5)A元素与F元素形成的化合物属于
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:
(1)⑧所对应的元素名称为_____ ,其在周期表中的位置________________ 。
(2)在①~⑨元素中,原子半径最大的是_____ (填元素符号),其某种氧化物可用于呼吸面具中氧气来源,请写出该反应化学方程式_______________ 。
(3)⑤⑥⑦三种元素所形成的最高价氧化物对应的水化物碱性最强的是_______ (填化学式)。
(4)比较④与⑨的气态氢化物的稳定性______ >_______ (填化学式)。
(5)由下列元素形成的化合物中含有离子键的是_________ 。
A.①和③ B.②和③ C.①和④ D.⑥和⑨
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)在①~⑨元素中,原子半径最大的是
(3)⑤⑥⑦三种元素所形成的最高价氧化物对应的水化物碱性最强的是
(4)比较④与⑨的气态氢化物的稳定性
(5)由下列元素形成的化合物中含有离子键的是
A.①和③ B.②和③ C.①和④ D.⑥和⑨
您最近一年使用:0次